Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e234c294a980c01 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Цинк. Химия цинка и его соединений
Положение в периодической системе химических элементов
Цинк расположены в побочной подгруппе II группы (или в 12 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение цинка и свойства
Электронная конфигурация цинка в основном состоянии :
+30Zn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2
2s 
3s 

Характерная степень окисления цинка в соединениях +2.
Физические свойства
Цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (быстро тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Температура плавления цинка 420°С, температура кипения 906°С, плотность 7,13 г/см 3 .
Нахождение в природе
Среднее содержание цинка в земной коре 8,3·10 -3 мас.%. Основной минерал цинка: сфалерит (цинковая обманка) ZnS..
Цинк играет важную роль в процессах, протекающих в живых организмах.
В природе цинк как самородный металл не встречается.
Способы получения
Цинк получают из сульфидной руды. На первом этапе руду обогащают, повышая концентрацию сульфидов металлов. Сульфид цинка обжигают в печи кипящего слоя:
2ZnS + 3O2 → 2ZnO + 2SO2
Чистый цинк из оксида получают двумя способами.
При пирометаллургическом способе , который использовался издавна, оксид цинка восстанавливают углём или коксом при 1200—1300 °C:
ZnO + С → Zn + CO
Далее цинк очищают от примесей.
В настоящее время основной способ получения цинка — электролитический (гидрометаллургический) . При этом сульфид цинка обрабатывают серной кислотой:
При это получаемый раствор сульфата цинка очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу.
При электролизе чистый цинк осаждается на алюминиевых катодах, с которых его удаляют и подвергают плавлению в индукционных печах. Таким образом можно получить цинк с высокой чистотой (до 99,95 %).
Качественные реакции
Качественная реакция на ионы цинка — взаимодействие избытка солей цинка с щелочами . При этом образуется белый осадок гидроксида цинка.
Например , хлорид цинка взаимодействует с гидроксидом натрия:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид цинка растворяется с образованием комплексной соли тетрагидроксоцинката:
Обратите внимание , если мы поместим соль цинка в избыток раствора щелочи, то белый осадок гидроксида цинка не образуется, т.к. в избытке щелочи соединения цинка сразу переходят в комплекс:
Химические свойства
1. Цинк – сильный восстановитель . Цинк – довольно активный металл, но на воздухе он устойчив, так как покрывается тонким слоем оксида, предохраняющим его от дальнейшего окисления. При нагревании цинк реагирует со многими неметаллами .
1.1. Цинк реагируют с галогенами с образованием галогенидов:
Реакция цинка с иодом при добавлении воды:
1.2. Цинк реагирует с серой с образованием сульфидов:
Zn + S → ZnS
1.3. Цинк реагируют с фосфором . При этом образуется бинарное соединение — фосфид:
1.4. С азотом цинк непосредственно не реагирует.
1.5. Цинк непосредственно не реагирует с водородом, углеродом, кремнием и бором.
1.6. Цинк взаимодействует с кислородом с образованием оксида:
2Zn + O2 → 2ZnO
2. Цинк взаимодействует со сложными веществами:
2.1. Цинк реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn 0 + H2 + O → Zn +2 O + H2 0
2.2. Цинк взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой и др.). При этом образуются соль и водород.
Например , цинк реагирует с соляной кислотой :
Zn + 2HCl → ZnCl2 + H2↑
Демонстрация количества выделения водорода при реакции цинка с кислотой:
Цинк реагирует с разбавленной серной кислотой:
2.3. Цинк реагирует с концентрированной серной кислотой . В зависимости от условий возможно образование различных продуктов. При нагревании гранулированного цинка с концентрированной серной кислотой образуются оксид серы (IV), сульфат цинка и вода:
Порошковый цинк реагирует с концентрированной серной кислотой с образованием сероводорода, сульфата цинка и воды:
2.4. Аналогично: при нагревании гранулированного цинка с концентрированной азотной кислотой образуются оксид азота (IV) , нитрат цинка и вода :
При нагревании цинка с очень разбавленной азотной кислотой образуются нитрат аммония , нитрат цинка и вода :
2.5. Цинк – амфотерный металл, он взаимодействует с щелочами. При взаимодействии цинка с раствором щелочи образуется тетрагидроксоцинкат и водород:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Цинк реагирует с расплавом щелочи с образованием цинката и водорода:
В отличие от алюминия, цинк растворяется и в водном растворе аммиака:
2.6. Цинк вытесняет менее активные металлы из оксидов и солей .
Например , цинк вытесняет медь из оксида меди (II):
Zn + CuO → Cu + ZnO
Еще пример : цинк восстанавливает медь из раствора сульфата меди (II):
CuSO4 + Zn = ZnSO4 + Cu
И свинец из раствора нитрата свинца (II):
Восстановительные свойства цинка также проявляются при взаимодействии его с сильными окислителями: нитратами и сульфитами в щелочной среде, перманганатами, соединениями хрома (VI):
Оксид цинка
Способы получения
Оксид цинка можно получить различными методами :
1. Окислением цинка кислородом:
2Zn + O2 → 2ZnO
2. Разложением гидроксида цинка при нагревании:
3. Оксид цинка можно получить разложением нитрата цинка :
Химические свойства
Оксид цинка — типичный амфотерный оксид . Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида цинка с основными оксидами образуются соли-цинкаты.
Например , оксид цинка взаимодействует с оксидом натрия:
2. Оксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли . При этом оксид цинка проявляет кислотные свойства.
Например , оксид цинка взаимодействует с гидроксидом натрия в расплаве с образованием цинката натрия и воды:
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката:
3. Оксид цинка не взаимодействует с водой.
ZnO + H2O ≠
4. Оксид цинка взаимодействует с кислотными оксидами . При этом образуются соли цинка. В этих реакциях оксид цинка проявляет основные свойства.
Например , оксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
5. Оксид цинка взаимодействует с растворимыми кислотами с образованием солей.
Например , оксид цинка реагирует с соляной кислотой:
ZnO + 2HCl = ZnCl2 + H2O
6. Оксид цинка проявляет слабые окислительные свойства .
Например , оксид цинка при нагревании реагирует с водородом и угарным газом:
ZnO + С(кокс) → Zn + СО
ZnO + СО → Zn + СО2
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната бария:
Гидроксид цинка
Способы получения
1. Гидроксид цинка можно получить пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоцинката натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить исходное вещество Na2[Zn(OH)4] на составные части: NaOH и Zn(OH)2. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Zn(OH)2 не реагирует с СО2, то мы записываем справа Zn(OH)2 без изменения.
2. Гидроксид цинка можно получить действием недостатка щелочи на избыток соли цинка.
Например , хлорид цинка реагирует с недостатком гидроксида калия с образованием гидроксида цинка и хлорида калия:
Химические свойства
1. Гидроксид цинка реагирует с растворимыми кислотами .
Например , гидроксид цинка взаимодействует с азотной кислотой с образованием нитрата цинка:
2. Гидроксид цинка взаимодействует с кислотными оксидами .
Например , гидроксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
3. Гидроксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли . При этом гидроксид цинка проявляет кислотные свойства.
Например , гидроксид цинка взаимодействует с гидроксидом калия в расплаве с образованием цинката калия и воды:
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксоцинката:
4. Г идроксид цинка разлагается при нагревании :
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Например , тетрагидроксоцинкат натрия разбиваем на гидроксид цинка и гидроксид натрия:
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы цинка реагируют с кислотными оксидами .
Например , гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид цинка не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Например , с соляной кислотой:
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
Z nS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
Упражнения типа «мысленный эксперимент» по химии цинка (тренажер задания 32 ЕГЭ по химии)
- Оксид цинка растворили в растворе хлороводородной кислоты и раствор нейтрализовали, добавляя едкий натр. Выделившееся студенистое вещество белого цвета отделили и обработали избытком раствора щелочи, при этом осадок полностью растворился. нейтрализация полученного раствора кислотой, например, азотной, приводит к повторному образованию студенистого осадка. Напишите уравнения описанных реакций.
- Цинк растворили в очень разбавленной азотной кислоте и в полученный раствор добавили избыток щелочи, получив прозрачный раствор. Напишите уравнения описанных реакций.
- Соль, полученную при взаимодействии оксида цинка с серной кислотой, прокалили при температуре 800°С. Твердый продукт реакции обработали концентрированным раствором щелочи, и через полученный раствор пропустили углекислый газ. Напишите уравнения описанных реакций.
- Нитрат цинка прокалили, продукт реакции при нагревании обработали раствором едкого натра. Через образовавшийся раствор пропустили углекислый газ до прекращения выделения осадка, после чего обработали избытком концентрированного нашатырного спирта, при этом осадок растворился. Напишите уравнения описанных реакций.
- Цинк растворили в очень разбавленной азотной кислоте, полученный раствор осторожно выпарили и остаток прокалили. Продукты реакции смешали с коксом и нагрели. Напишите уравнения описанных реакций.
- Несколько гранул цинка растворили при нагревании в растворе едкого натра. В полученный раствор небольшими порциями добавляли азотную кислоту до образования осадка. Осадок отделили, растворили в разбавленной азотной кислоте, раствор осторожно выпарили и остаток прокалили. Напишите уравнения описанных реакций.
- В концентрированную серную кислоту добавили металлический цинк. образовавшуюся соль выделили, растворили в воде и в раствор добавили нитрат бария. После отделения осадка в раствор внесли магниевую стружку, раствор профильтровали, фильтрат выпарили и прокалили. Напишите уравнения описанных реакций.
- Сульфид цинка подвергли обжигу. Полученное твердое вещество полностью прореагировало с раствором гидроксида калия. Через полученный раствор пропустили углекислый газ до выпадения осадка. Осадок растворили в соляной кислоте. Напишите уравнения описанных реакций.
- Некоторое количество сульфида цинка разделили на две части. Одну из них обработали соляной кислотой, а другую подвергли обжигу на воздухе. При взаимодействии выделившихся газов образовалось простое вещество. Это вещество нагрели с концентрированной азотной кислотой, причем выделился бурый газ. Напишите уравнения описанных реакций.
- Цинк растворили в растворе гидроксида калия. Выделившийся газ прореагировал с литием, а к полученному раствору по каплям добавили соляную кислоту до прекращения выпадения осадка. Его отфильтровали и прокалили. Напишите уравнения описанных реакций.
И электродные реакции для некоторых металлов
| Электрод | Электродная реакция | j o , В | Электрод | Электродная реакция | j o , В |
| Li + /Li | Li + + ē = Li | –3,045 | Cd 2+ /Cd | Cd 2+ + 2ē = Cd | –0,403 |
| Rb + /Rb | Rb + + ē = Rb | –2,925 | Co 2+ /Co | Co 2+ + 2ē = Co | –0,277 |
| K + /K | K + + ē = K | –2,924 | Ni 2+ /Ni | Ni 2+ + 2ē = Ni | –0,250 |
| Cs + /Cs | Cs + + ē = Cs | –2,923 | Sn 2+ /Sn | Sn 2+ + 2ē = Sn | –0,136 |
| Ba 2+ /Ba | Ba 2+ + 2ē = Ba | –2,906 | Pb 2+ /Pb | Pb 2+ + 2ē = Pb | –0,126 |
| Ca 2+ /Ca | Ca 2+ + 2ē = Ca | –2,866 | Fe 3+ /Fe | Fe 3+ + 3ē = Fe | –0,036 |
| Na + /Na | Na + + ē = Na | –2,714 | 2H + /H2 | 2H + + 2ē = H2 | 0,000 |
| Mg 2+ /Mg | Mg 2+ + 2ē = Mg | –2,363 | Bi 3+ /Bi | Bi 3+ + 3ē = Bi | +0,215 |
| A1 3+ /A1 | Al 3+ + 3ē = Al | –1,662 | Cu 2+ /Cu | Cu 2+ + 2ē = Cu | +0,337 |
| Ti 2+ /Ti | Ti 2+ + 2ē = Ti | –1,628 | Ag + /Ag | Ag + + ē = Ag | +0,799 |
| Mn 2+ /Mn | Mn 2+ + 2ē = Mn | –1,180 | Hg 2+ /Hg | Hg 2+ + 2ē = Hg | +0,854 |
| Zn 2+ /Zn | Zn 2+ + 2ē = Zn | –0,763 | Pt 2+ /Pt | Pt 2+ + 2ē = Pt | +1,190 |
| Cr 3+ /Cr | Cr 3+ + 3ē = Cr | –0,744 | Au 3+ /Au | Au 3+ + 3ē = Au | +1,498 |
| Fe 2+ /Fe | Fe 2+ + 2ē = Fe | –0,440 | Au + /Au | Au + + ē = Au | +1,691 |
Расположенные в порядке увеличения стандартного электродного потенциала металлы образуют ряд напряжений металлов. Положение металла в ряду напряжений определяет относительную окислительно-восстановительную способность металла и его ионов. Чем меньшее значение имеет стандартный электродный потенциал металла, тем более сильным восстановителем он является. Чем больше потенциал металлического электрода, тем более высокой окислительной способностью обладают его ионы. Каждый металл способен вытеснять из растворов солей только те металлы, которые имеют большее значение электродного потенциала – более активный металл замещает менее активный.
Последовательность металлов в ряду напряжений сохраняется только для стандартной температуры (25 °С) и концентрации ионов металла в растворе 1моль/л. При других концентрациях электролита электродный потенциал рассчитывается по уравнению Нернста:
j = j 0 + 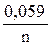
где j 0 − стандартный электродный потенциал, n – число электронов, участвующих в электродной реакции; C – концентрация ионов металла в растворе (моль/л).
Если два электрода, погруженные в растворы электролитов, соединить металлическим проводником, образуется гальванический элемент. Гальваническими элементаминазывают устройства, в которых химическая энергия окислительно-восстановительных процессов преобразуется в электрическую энергию.
Так, реакция CuSO4 + Zn = Cu + ZnSO4 в электрохимическом варианте является основой гальванического элемента Даниэля – Якоби, схема которого (–) Zn | ZnSO4 || CuSO4 |Cu (+) отражает систему обозначений для гальванических элементов. Слева записывается анод Zn | Zn 2+ – электрод, имеющий меньшее значение электродного потенциала, отрицательный полюс (–), на нем протекает процесс окисления – анодная реакция: Zn –2ē = Zn 2+ . Справа – катод Cu 2+ | Cu – электрод, имеющий большее значение электродного потенциала, положительный полюс (+), на нем протекает процесс восстановления – катодная реакция: Cu 2+ + 2ē = Cu. Одна вертикальная черта изображает фазовый раздел между металлом и раствором электролита. Двойная вертикальная линия отделяет анодное пространство от катодного.
Суммарная реакция, протекающая в гальваническом элементе, называется токообразующей. В случае элемента Даниэля – Якоби токообразующая реакция имеет вид Cu 2+ + Zn = Cu + Zn 2+ .
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой(ЭДС). Обозначается E, измеряется в вольтах. ЭДС элемента равна разности потенциалов катода и анода: E = j к – j а
Стандартная ЭДС равна разности стандартных электродных потенциалов катода и анода:E 0 = j 0 к– j 0 а Так, для элемента Даниэля – Якоби стандартная ЭДС равна: E 0 = j 0 Сu 2+ /Cu – j 0 Zn 2+ /Zn = +0,337 – (–0,763) = +1,100 В.
Окислительно-восстановительная реакция, характеризующая работу гальванического элемента, протекает в направлении, в котором ЭДС имеет положительное значение. В этом случае DG 0 х.р. 0 = – nE 0 F,
где n – число электронов, участвующих в электродной реакции; F – постоянная Фарадея, равная 96500 Кл; E 0 – стандартная ЭДС.
Гальванический элемент, состоящий из двух электродов одного и того же металла, погруженных в растворы его соли разной концентрации, представляет собой концентрационный элемент. В этом случае электрод, погруженный в раствор электролита с меньшей концентрацией ионов металла, будет анодом. В качестве катода будет выступать электрод, опущенный в электролит с большей концентрацией ионов металла.
Пример 12.1.Определить ЭДС концентрационного серебряного элемента с концентрациями ионов серебра, равными 10 –1 моль/л у одного электрода и
10 –4 моль/л у другого при 298 К.
Решение.Схема такого гальванического элемента Ag½Ag + ||Ag + ½Ag. По уравнению Нернста рассчитываем потенциалы двух серебряных электродов.
Для первого электрода:
j Ag + /Ag = j 0 Ag + /Ag + 0,059 lg10 -1 = 0,799 + 0,059×(–1) = 0,74 В
Для второго электрода:
j Ag + /Ag = j 0 Ag + /Ag + 0,059 lg10 -4 = 0,799 + 0,059×(–4) = 0,563 В
Первый электрод с большим значением потенциала в данном элементе является катодом, второй – анодом. ЭДС рассчитываем по формуле:
E = j к – j а = 0,74 – 0,563 = 0,177 В.
Пример 12.2. Рассчитать ЭДС элемента Cd½Cd 2+ || Ni 2+ ½Ni при концентрации ионов Cd 2+ и Ni 2+ , равных соответственно 0,1 и 0,001 моль/л.
Решение.Используя уравнения Нернста и данные таблицы стандартных электродных потенциалов, рассчитываем электродные потенциалы кадмия и никеля:
j Сd 2+ /Cd = j 0 Сd 2+ /Cd + 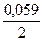
j Ni 2+ /Ni = j 0 Ni 2+ /Ni + 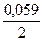
Так как j Сd 2+ /Cd 2+ /Ni , то токообразующей в этом гальваническом элементе является реакция Cd 0 + Ni 2+ = Cd 2+ + Ni 0 . Рассчитываем ЭДС элемента E = j Ni 2+ /Ni – j Сd 2+ /Cd = -0,2795 — (-0,4915) = 0,212 В.
Пример 12.3. Исходя из значений стандартных электродных потенциалов и DG 0 х.р., указать, можно ли в гальваническом элементе осуществить реакцию Pb 2+ + Ti = Pb + Ti 2+ . Составить схему гальванического элемента, написать уравнения электродных реакций.
Решение. В соответствии с уравнением реакции схему гальванического элемента можно представить следующим образом: (–) Ti½Ti 2+ || Pb 2+ ½Pb (+). Уравнения электродных реакций имеют вид:
на аноде: Ti 0 – 2ē ® Ti 2+
на катоде: Pb 2+ + 2ē ® Pb 0
Рассчитываем стандартное значение ЭДС:
Энергию Гиббса рассчитываем по уравнению DG 0 = –nE 0 F=
–2×1,502×96500 = –289,9 кДж. Так как DG 0 2+ + Zn = Cu + Zn 2+
Один моль эквивалентов цинка (32,69 г/моль) будет замещаться на один моль эквивалентов меди (31,77 г/моль) или свинца (103,6 г/моль). Учитывая молярные массы эквивалентов этих элементов, в растворе CuSO4 масса цинковой пластины будет незначительно уменьшаться, а в растворе Pb(NO3)2 – заметно увеличиваться.
Стандартный потенциал магния имеет меньшее значение, чем потенциал цинка. Это означает, что ионы магния не могут окислять цинковую пластинку. Поведение цинка в таком растворе аналогично окислению цинковой пластинки в воде: Zn – 2ē = Zn 2+ . Протекание такого процесса приведет к малозаметному снижению массы цинковой пластинки.
Пример 12.5.Как происходит коррозия цинка, находящегося в контакте с кадмием, во влажном воздухе и в кислом растворе (НСl)? Составить уравнения анодного и катодного процессов. Привести схемы образующихся при этом гальванических элементов. Определить состав продуктов коррозии.
Решение.Цинк имеет меньшее значение потенциала (–0,763 В), чем кадмий (–0,403 В), поэтому он является анодом, а кадмий – катодом. Следовательно, цинк растворяется, а на поверхности кадмия идет восстановление: в кислом растворе – ионов водорода, во влажном воздухе – растворенного в воде кислорода.
Анодный процесс: Zn – 2ē = Zn 2+
Катодный процесс: в кислом растворе 2Н + + 2ē ® Н2
во влажном воздухе О2 + 2Н2О + 4ē ® 4ОН –
Схема образующегося гальванического элемента во влажном воздухе:
Схема образующегося гальванического элемента в кислом растворе:
Во влажном воздухе ионы Zn 2+ с гидроксильными группами, выделяющимися на катоде, образуют малорастворимый гидроксид цинка Zn(ОН)2, который и является продуктом коррозии.
В кислой среде на поверхности кадмия выделяется газообразный водород. В раствор переходят ионы Zn 2+ .
Пример 12.6. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадает в кислую среду (НС1)? Привести уравнения анодного и катодного процессов, схему образующегося гальванического элемента. Каков состав продуктов коррозии?
Решение.По положению в ряду напряжений металлов видно, что хром более активный металл (j 0 Сr 3+ /Cr = –0,744 В), чем медь (j 0 Сu 2+ /Cu = 0,337 В). В образованной гальванической паре Cr – анод, он окисляется, а Cu – катод, на ее поверхности выделяется (восстанавливается) водород из НС1.
Анодный процесс: Cr –3ē = Cr 3+
Катодный процесс в кислой среде: 2Н + + 2ē ® Н2
Схема гальванического элемента: (–) Cr½HCl½Cu (+)
Появляющиеся ионы Cr 3+ образуют с хлорид-анионами (из НС1) растворимое соединение – CrC13, на поверхности меди выделяется Н2.
Задачи
№ 12.1. а) Чему равна величина ЭДС гальванического элемента, составленного из стандартных цинкового и серебряного электродов, погруженных в растворы их солей? Привести схему гальванического элемента и реакции, протекающие на электродах при его работе. (Ответ: 1,562 В).
б) Возможна ли электрохимическая коррозия алюминия, контактирующего со свинцом в нейтральном водном растворе, содержащем растворенный кислород? Если да, то написать уравнения реакций анодного и катодного процессов. Составить схему образующегося гальванического элемента.
№ 12.2. а) Чему равна величина ЭДС цинкового концентрационного элемента, составленного из двух цинковых электродов, опущенных в растворы с концентрациями ионов Zn 2+ , равными 10 –2 и 10 –6 моль/л? Привести схему такого элемента и реакции, протекающие на электродах при его работе.
б) Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составить уравнения анодного и катодного процессов. Привести схемы образующихся гальванических элементов.
№ 12.3. а) Имеется гальванический элемент, в котором протекает токообразующая реакция Ni + Cu 2+ = Cu + Ni 2+ . Привести схему такого элемента, написать уравнения электродных процессов.
б) Изделие из алюминия склепано с медью. Какой из металлов будет подвергаться коррозии, если эти металлы попадут в кислую среду (НСl)? Составить уравнения происходящих при этом процессов, привести схему образующегося гальванического элемента. Определить продукты коррозии.
№ 12.4. а) Составить схему, написать уравнения токообразующей и электродных реакций для гальванического элемента, у которого один из электродов кобальтовый (СCо 2+ = 10 –1 моль/л), а другой – стандартный водородный. Рассчитать ЭДС элемента при 298 К. Как изменится ЭДС, если концентрация ионов Со 2+ уменьшить в 10 раз? (Ответ: 0,307 В; 0,336 В).
б) Составить уравнения анодного и катодного процессов при коррозии пары магний – свинец в кислой среде и во влажном воздухе. Какие продукты коррозии образуются в первом и во втором случаях?
№ 12.5. а)Каково значение ЭДС элемента, состоящего из медного и свинцового электродов, погруженных в растворы солей этих металлов с концентрациями их ионов 1 моль/л? Изменится или нет ЭДС этого элемента и почему, если концентрации ионов металлов будут составлять 0.001 моль/л? Составить уравнения электродных и токообразующей реакций. Привести схему гальванического элемента. (Ответ: 0,463 В).
б) Привести по одному примеру катодного и анодного покрытия для кобальта. Составить уравнения катодных и анодных процессов во влажном воздухе и в растворе соляной кислоты при нарушении целостности покрытия.
№ 12.6. а) Составить схему, привести уравнения электродных процессов и вычислить ЭДС концентрационного гальванического элемента, состоящего из медных электродов, опущенных в растворы СuSO4 с концентрациями 0,01 и 0,1 моль/л. (Ответ: 0,0295 В).
б)К какому типу покрытий относятся олово на меди и на железе? Какие процессы будут протекать при атмосферной коррозии указанных пар в нейтральной среде? Написатьуравнения катодных и анодных реакций.
№ 12.7. а)После нахождения в растворах каких из приведенных солей масса кадмиевой пластинки увеличится или уменьшится: а) MgCl2; б) Hg(NO3)2;
в) CuSO4; г) AgNO3; д) CaCl2? Ответ обосновать
б) Медное изделие покрыли серебром. К какому типу относится такое покрытие – к анодному или катодному? Составить уравнения электродных процессов коррозии этого изделия при нарушении целостности покрытия во влажном воздухе и в растворе соляной кислоты. Привести схемы образующихся при этом гальванических элементов.
№ 12.8. а) Составить схему, привести уравнения электродных процессов и вычислить ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, которые опущены в растворы своих солей с концентрацией ионов Pb 2+ и Mg 2+ , равных 1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить в 100 раз? Ответ обосновать. (Ответ: 2,237 В).
б) В воду, содержащую растворенный кислород, опустили никелевую пластинку и никелевую пластинку, частично покрытую медью. В каком случае процесс коррозии никеля происходит интенсивнее? Почему? Составить уравнения анодного и катодного процессов для пластинки покрытой медью.
№ 12.9. а)В два сосуда с голубым раствором сульфата меди поместили в первый хромовую пластинку, а во второй платиновую. В каком сосуде цвет раствора постепенно исчезает? Почему? Составить электронные и молекулярные уравнения соответствующих реакций.
б) Какой металл целесообразнее выбрать для протекторной защиты железного изделия: цинк, никель или кобальт? Почему? Составить уравнения анодного и катодного процессов атмосферной коррозии таких изделий. Каков состав продуктов коррозии?
№ 12.10. а) Составить схемы двух гальванических элементов, в одном из которых оловянная пластинка была бы катодом, а в другом анодом. Написать для каждого из этих элементов уравнения электродных (катодных и анодных) процессов и токообразующих реакций.
б) Железо покрыто хромом. Какой из металлов будет корродировать в случае нарушения поверхностного слоя покрытия при атмосферной коррозии? Какое это покрытие катодное или анодное? Составить схему процессов, происходящих на электродах образующегося гальванического элемента.
№ 12.11. а) Составить схему гальванического элемента, в основе работы которого лежит реакция: Ni + Pb(NO3)2 = Ni(NO3)2 + Pb. Написать уравнения электродных (катодных и анодных) процессов. Вычислить ЭДС этого элемента, если СNi 2+ = 0,01 моль/л, а СPb 2+ = 0,0001 моль/л. (Ответ: 0,065 В).
б) Рассчитать энергию Гиббса реакции
и определить, какой из металлов – магний или медь, интенсивнее будет корродировать во влажном воздухе. Стандартные энергии Гиббса образования D¦G 0 Mg(OH)2, Cu(OH)2, H2O (ж) соответственно равны –833,7; –356,9; –237,3 кДж/моль.
№ 12.12. а) Вычислить электродный потенциал цинка в растворе ZnCl2, в котором концентрация Zn 2+ составляет 0,1 моль/л. Как изменится значение потенциала при разбавлении раствора в 100 раз? (Ответ: –0,79 В; –0,85 В).
б) Какой из металлов – алюминий или золото, будет подвергаться коррозии во влажном воздухе по уравнению: 4Ме + 6Н2О (ж) + 3О2 = 4Ме(ОН)3.
Ответ обосновать, рассчитав энергию Гиббса реакции. Стандартные энергии Гиббса образования D¦G 0 Al(OH)3, Au(OH)3, H2O (ж) соответственно равны
–1139,7; –289,9; –237,3 кДж/моль.
№ 12.13. а) Составить схему гальванического элемента, электродами в котором служат пластинки из олова и меди. Исходя из величин стандартных электродных потенциалов, рассчитать значения Е 0 и DG 0 . Определить направление протекания токообразующей реакции. (Ответ: 0,473 В; –91,3 кДж).
б)Какие из перечисленных металлов могут быть использованы для протекторной защиты железного изделия в присутствии электролита, содержащего растворенный кислород в нейтральной среде: алюминий, хром, серебро, кадмий? Привести уравнения анодного и катодного процессов атмосферной коррозии таких изделий. Каков состав продуктов коррозии?
№ 12.14. а) Составить схему гальванического элемента, образованного железом и свинцом, погруженными в растворы их солей с концентрациями ионов металлов 0,01 моль/л. Рассчитать ЭДС. (Ответ: 0,314 В).
б) Изделие из хрома спаяно свинцом. Какой из металлов будет корродировать при попадании такого изделия в кислотную среду (НСl)? Привести уравнения анодного и катодного процессов и образующиеся продукты коррозии.
№ 12.15. а) Исходя из величин стандартных электродных потенциалов, рассчитать значения ЭДС и DG 0 и определить, будет ли работать гальванический элемент, в котором на электродах протекают реакции:
(Ответ: –0,98 В; +189,1 кДж).
б) Составить уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого серебром, во влажном воздухе и в кислой среде. Определить тип покрытия – анодное или катодное? Какие продукты образуются в результате коррозии?
№ 12.16. а) Исходя из величин стандартных электродных потенциалов, рассчитать значения ЭДС и DG 0 и сделать вывод о возможности протекания реакции в прямом направлении: Cu + 2Ag + 
(Ответ: 0,462 В; –89,2 кДж).
б) Какие металлы могут быть использованы в качестве анодного покрытия сплава Zn – Cd? Привести уравнения анодного и катодного процессов при коррозии такого сплава во влажном воздухе в отсутствие анодного покрытия.
№ 12.17. а) Как изменится масса хромовой пластинки после нахождения в растворах солей: а) CuSO4; б) MgCl2; в) AgNO3; г) CaCl2? Ответ обосновать.
б) Привести уравнения анодного и катодного процессов при коррозии сплава Fe – Sn во влажном воздухе и в кислой среде. Определить продукты коррозии.
№ 12.18. а) Составить схемы двух гальванических элементов, в одном из которых цинк – отрицательный электрод, а в другом – положительный. Привести уравнения токообразующих реакций и электродных процессов.
б) Привести уравнения анодного и катодного процессов, происходящих при коррозии сплава Al – Ni в атмосфере влажного воздуха и в кислой среде (НС1). Определить продукты коррозии.
№ 12.19. а) Электродные потенциалы железа и серебра соответственно равны –0,44 и +0,799 В. Какая реакция самопроизвольно протекает в железо-серебряном гальваническом элементе?
Fe 0 + 2Ag + = Fe 2+ + 2Ag 0 или 2Ag 0 + Fe 2+ = Fe 0 + 2Ag +
Ответ обосновать, рассчитав энергию Гиббса каждой из приведенных реакций.
б) Хромовую пластинку и пластинку из хрома, частично покрытую серебром, поместили в раствор соляной кислоты. В каком случае процесс коррозии хрома протекает более интенсивно? Почему? Привести уравнения соответствующих процессов.
№ 12.20. а) Вычислить ЭДС гальванического элемента, состоящего из водородного электрода, опущенного в чистую воду, и оловянного электрода, опущенного в раствор с концентрацией ионов олова (II) 1 моль/л. (Ответ: 0,16 В).
б) Составить уравнения самопроизвольно протекающих реакций при атмосферной коррозии цинка и олова, находящихся в контакте. Привести схему образующегося гальванического элемента.
http://chemege.ru/zink/
http://helpiks.org/5-20614.html













