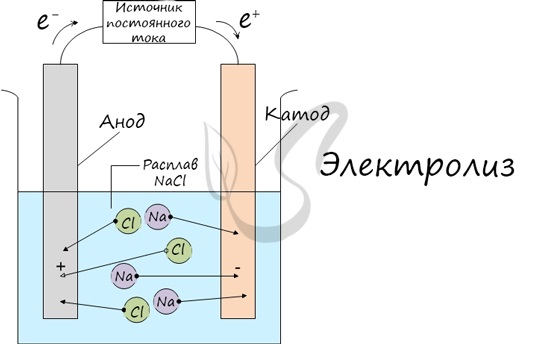
Электролиз
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na + , K + , Cu 2+ , Fe 3+ , Ag + и т.д.
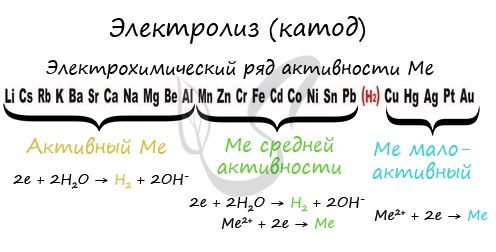
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H + (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H + — 2e = H2
К аноду притягиваются анионы — отрицательно заряженные ионы: SO4 2- , PO4 3- , Cl — , Br — , I — , F — , S 2- , CH3COO — .
При электролизе кислородсодержащих анионов: SO4 2- , PO4 3- — на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ — CO2.
Примеры решения
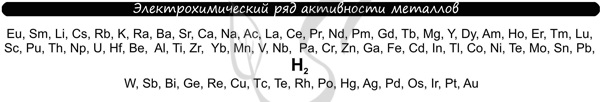
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.
Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
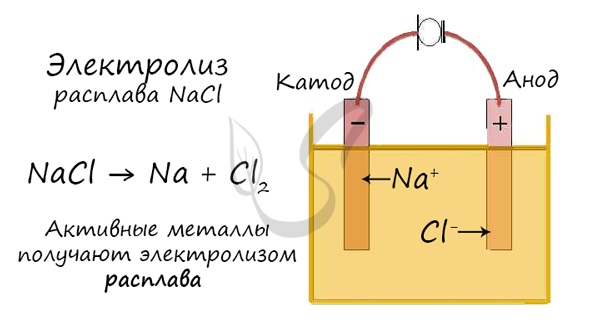
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de97519ec5e7b33 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Электронные уравнения процессов, происходящих на электродах при электролизе растворов солей
Решение задач по химии на электролиз соли
Задание 274.
Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора КВг. Какая масса вещества выделяется на катоде и аноде, если электролиз проводить в течение 1 ч 35 мин при силе тока 15 А? Ответ: 0,886 г; 70,79 г.
Решение:
Стандартный электродный потенциал системы К + + 
2Н2О + 2 
На аноде будет происходить электрохимическое окисление ионов Br-, приводящее к выделению брома:
2Br — — 2 
поскольку отвечающий этой системе стандартный электродный потенциал (+1,07 В) значительно ниже, чем стандартный потенциал (+1,23 В), характеризующий систему:
2Н2О — 4 
Массу веществ, выделившихся на электродах находим из уравнения Фарадея, имея в виду, что 1 ч 35 мин = 5700 с и МЭ(Н2) = 1 г/моль, МЭ(Br2) = 79,916 г/моль получим:
m(B) = МЭ(B) . I . t/F
m(H2) = МЭ(H2) . I . t/F = 1 . 15 . 5700/96500 = 0,886 г;
m(Br2) = МЭ(Br2) . I . t/F = 79,916 . 15 . 5700/96500 = 70,81 г.
m(B) – масса выделившегося вещества, г; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500.
Ответ: m(H2) = 0,886 г; m(Br2) = 70,81 г.
Задание 275.
Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора СuCl2. Вычислите массу меди, выделившейся на катоде, если на аноде выделилось 560 мл газа (н.у.). Ответ: 1,588 г.
Решение:
а) Электролиз соли хлорида меди на угольных электродах:
Стандартный электродный потенциал системы Cu 2+ + 2 
Cu 2+ + 2 
На аноде будет происходить электрохимическое окисление ионов Cl — , приводящее к выделению хлора:
2Cl — — 2 
поскольку отвечающий этой системе стандартный электродный потенциал (+1,36 В) значительно выше, чем стандартный потенциал (+1,23 В), характеризующий систему
2Н2О — 4 
Чтобы вычислить массу меди, выделившейся на катоде при электролизе CuCl2, рассчитаем количество эквивалентов хлора, выделившегося на аноде, зная его объём и эквивалентный объём, получим:
Эквивалентный объём хлора равен 11,2 л/моль. Тогда количество эквивалентов выделившегося хлора равно:
Так как (Cl2) = (Cu), то можно рассчитать массу выделившейся меди при электролизе CuCl2, получим:
m(Cu) = (Cu) . MЭ(Cu) = 0,05 . 31,77 = 1,588 г.
Ответ: m(Cu) = 1,588 г.
Задание 275.
Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора СuCl2. Вычислите массу меди, выделившейся на катоде, если на аноде выделилось 560 мл газа (н.у.). Ответ: 1,588 г.
Решение:
а) Электролиз соли медного купороса на угольных электродах:
Стандартный электродный потенциал системы Cu 2+ + 2 
Cu 2+ + 2 
На аноде будет происходить электрохимическое окисление ионов Cl — , приводящее к выделению хлора:
2Cl — — 2 
поскольку отвечающий этой системе стандартный электродный потенциал (+1,36 В) значительно ниже, чем стандартный потенциал (+1,23 В), характеризующий систему
2Н2О — 4 
Чтобы вычислить массу меди, выделившейся на катоде при электролизе CuCl2, рассчитаем количество эквивалентов хлора, выделившегося на аноде, зная его объём и эквивалентный объём, получим:
Эквивалентный объём хлора равен 11,2 л/моль. Тогда количество эквивалентов выделившегося хлора равно:
Так как (Cl2) = (Cu), то можно рассчитать массу выделившейся меди при электролизе CuCl2, получим:
m(Cu) = (Cu) . MЭ(Cu) = 0,05 . 31,77 = 1,588 г.
Ответ: m(Cu) = 1,588 г.
Задание 276.
При электролизе соли трехвалентного металла при силе тока 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислите атомную массу металла. Ответ: 114,835.
Решение:
Эквивалентную массу металла рассчитаем из уравнения Фарадея относительно массы вещества, подставив в него данные из задачи, получим:
m(В) = МЭ(В) . I . t/F;
МЭ(Ме) = m(В) . F/(I . t) = (1,071 . 96500)/(1,5 . 60 . 30) = 38,278 г/моль.
Здесь m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Учитывая, что металл трёхвалентный рассчитаем его атомную массу:
Аr(Ме) = МЭ(Ме) . В = 38,278 . 3 = 114,835, где В – валентность металла.
http://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/273.html
http://buzani.ru/zadachi/khimiya-shimanovich/946-elektroliz-electrolysis-uravnenie-faradeya-zadaniya-274-276