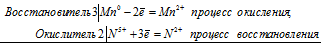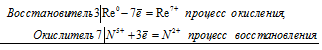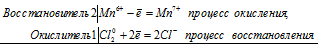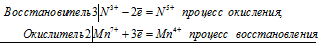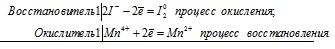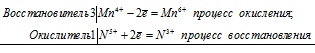Химические свойства марганца
Задание 417
Марганец окисляется азотной кислотой до низшей степени окисления, а рений приобретает высшую степень окисления. Какие соединения при этом получаются? Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
а) Марганец взаимодействует с азотной кислотой с образованием нитрата марганца (II) оксида азота (II)
3Mn 0 + 2N 5+ = 3Mn 2+ + 2N 2+
б) Рений окисляется азотной кислотой до высшей степени окисления. При этом образуются рениевая кислота HReO4 и оксид азота (II) NO:
3Re 0 + 7N 5+ = 3Re 2+ + 7N 2+
Задание 418
Хлор окисляет манганат калия К2MnO4. Какое соединение при этом получается? Как меняется окраска раствора в результате этой реакции? Составьте электронные и молекулярное уравнения реакции.
Решение:
При окислении хлором манганата калия образуются перманганат калия и хлорид калия:
2Mn 6+ + Сl2 0 = 2Mn 7+ + 2Cl —
Манганат-ионы MnO4 2- окрашивают раствор в ярко-зелёный цвет, перманганат-ионы MnO4 — в красно-фиолетовый. Поэтому при окислении манганата калия хлором раствор изменяет окраску с ярко-зелёного на красно-фиолетовый цвет.
Задание 419
Как меняется степень окисления марганца при восстановлении КМпО4 в кислой, нейтральной и щелочной средах? Составьте электронные и молекулярное уравнения реакций между КМпО4 и KNO2 в нейтральной среде.
Решение:
Степень окисления марганца при восстановлении КМпО4 в кислой, нейтральной и щелочной средах меняется следующим образом: в кислой среде марганец уменьшает свою степень окисления от +7 до +2 (перманганат-ион MnO4 — превращается в ион Mn 2+ ); в нейтральной среде марганец уменьшает свою степень окисления от +7 до +4 (ион MnO4- восстанавливается до MnO2); в щелочной среде марганец уменьшает свою степень окисления от +7 до +6 (ион MnO4 — превращается в ион MnO4 2- ).
Электронные и молекулярное уравнения реакций между КМпО4 и KNO2 в нейтральной среде:
2Mn 7+ + 3N 3+ = 2Mn 4+ + 3N 5+
Задание 420
На основании электронных уравнений составьте уравнение реакции получения манганата калия K2MnO4 сплавлением оксида марганца (IV) с хлоратом калия КСlО3 в присутствии гидроксида калия. Окислитель восстанавливается максимально, приобретая низшую степень окисления.
Решение:
При сплавлении MnO2 со щёлочью ) с хлоратом калия КСlО3 в присутствии гидроксида калия образуются манганат калия, хлорид калия и вода:
3Mn 4+ + Сl 5+ = 3Mn 6+ + Cl —
Задание 421
Почему оксид марганца (IV) может проявлять и окислительные, и восстанвительные свойства? Исходя из электронных уравнений, составьте уравнения реакций:
а)МnО2 + КI + Н2SO4 = ; б)МnO2 + КNO3 + КОН = .
Решение:
Марганец в MnO2 находится в своей промежуточной степени окисления +4, поэтому в окислительно-восстановительных реакциях атом марганца в оксиде марганца (IV) может как увеличивать свою степень окисления, т.е. проявлять свойства восстановителя, так и уменьшать свою степень окисления – проявлять свойства окислителя.
а)МnО2 + КI + Н2SO4 =
Mn 4+ + 2I — = Mn 2+ + I2 0
б)МnO2 + КNO3 + КОН = .
Mn 4+ + N 5+ = Mn 6+ + N 3+
Задание 422
Для получения хлора в лаборатории смешивают оксид марганца (IV) с хлоридом натрия в присутствии концентрированной серной кислоты. Составьте электронные и молекулярное уравнения этой реакции.
Решение:
Уравнение реакции получения хлора в лаборатории
Примеры ОВР соединений марганца
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
ОВР соединений марганца
Рассмотрим окислительно – восстановительные свойства соединений марганца, проявляемые ими в разных условиях (в кислотной, нейтральной или щелочной). При проведении ОВР для создания в растворе кислотной среды обычно используют серную кислоту . Азотную кислоту используют крайне редко, так как она сама является сильным окислителем; соляную, бромоводородную и йодоводородную кислоты не используют из-за их способности к окислению. Щелочная среда создается добавлением в раствор гидроксидов натрия или калия.
Перманганат калия К MnO 4 всегда является окислителем. Продукты восстановления зависят от характера среды:
Условия протекания окислительно-восстановительных превращений для соединений марганца можно представить в виде схемы, приведенной на рисунке 2.
Как видно из приведенной на этом рисунке схемы, перманганат-ион, входящий в состав самого популярного в лабораторной практике окислителя, KMnO 4 , в различных средах восстанавливается по-разному. В наибольшей степени окислительные свойства перманганат калия проявляет в кислотной среде, в несколько меньшей – в нейтральной и в наименьшей степени – в щелочной.
Рассмотрим эти случаи на конкретных примерах.
Пример 1. Составьте уравнение реакции, протекающей при пропускании оксида серы ( IV ) через подкисленный серной кислотой раствор перманганата калия.
Для составления уравнения воспользуемся методом электронного баланса.
При составлении уравнений ОВР наличием в растворе гидросульфатных ионов обычно пренебрегают. (Наличием ионов HSO 4 — нельзя пренебрегать при составлении уравнений ОВР типа взаимодействия концентрированной H 2 SO 4 с NaBr (среди прочего образуется NaHSO 4 ), но уравнения этих реакций составляют, используя метод электронного балланса.)
2. После умножения каждого из уравнений полуреакций на соответствующие множители, сложения уравнений и приведения подобных членов получаем ионное уравнение.
2MnO 4 — + 16 Н + + 5SO 2 + 10H 2 O = 2Mn 2+ + 5SO 4 2- + 20 H + + 8H 2 O
3. Добавив в левой части уравнения необходимое количество противоионов и не забывая о них при написании формул продуктов реакции, запишем молекулярное уравнение:
Из уравнения видно, что серная кислота, которая по смыслу задания должна была вступить в реакцию, в действительности в реакцию не вступает, а, наоборот, в процессе реакции выделяется, то есть добавлена в раствор только как средообразователь . Но это скорее исключение, чем правило. Убедимся в этом на другом примере.
Пример 2. Составьте уравнение реакции, протекающей при сливании раствора перманганата калия с раствором аммиака.
1 . Аммиак – слабое основание, поэтому среда в его водном растворе слабощелочная. Перманганат-ион в этих условиях при восстановлении превращается в диоксид марганца, выпадающий из раствора в виде бурого осадка. В нейтральной и щелочной среде очень мало ионов оксония, поэтому для связывания «лишних» атомов кислорода могут быть использованы лишь молекулы воды. Каждая молекула воды, присоединяя один атом кислорода, превращается в два гидроксид-иона. Аммиак в этих условиях окисляется до азота (ближайшая устойчивая степень окисления – ноль).
2. Ионное уравнение:
2MnO 4 — + 10H 2 O + 2NH 3 = 2MnO 2 + 8OH — + N 2 
3. Так как в одной из полуреакций образуются гидроксид-ионы, а в другой – ионы водорода, что вполне допустимо в нейтральной (или близкой к ней) среде, перед приведением подобных членов в ионном уравнении необходимо учесть, что эти ионы одновременно в водном растворе существовать не могут (пройдет реакция нейтрализации).
После приведения подобных членов получаем ионное уравнение:
2MnO 4 — + 2NH 3 = 2MnO 2 + 2OH — + N 2 
4. Запишем молекулярное уравнение:
2 KMnO 4 + 2 NH 3 = 2 MnO 2 + 2 KOH + N 2 
Пример 3. Составить уравнение реакции, протекающей при сливании раствора перманганата калия с раствором сульфита калия в присутствии гидроксида калия.
Пример 4. Составить уравнение реакции, протекающей при сливании раствора перманганата калия с раствором сульфита натрия в присутствии серной кислоты.
Пример 5. Составить уравнение реакции, протекающей при сливании раствора перманганата калия с раствором сульфита натрия.
Метод электронного баланса и ионно-электронный метод (метод полуреакций)
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители .
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn +7 , ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S +4 коэффициентом перед окислителем:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO4 2- , из которых 5 – за счет превращения 5SO3 2- → 5SO4 2- , а 3 – за счет молекул серной кислоты 8SO4 2- — 5SO4 2- = 3SO4 2- .
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H + + 3O -2 = 3H2O
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO4 — , который, соединяясь с H + образует воду:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона. Как видно образовавшийся ион SO4 2- содержит больше кислорода, чем исходный SO3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Также, как и предыдущем примере, окислителем является MnO4 — , а восстановителем SO3 2- .
В нейтральной и слабощелочной среде MnO4 — принимает 3 электрона и восстанавливается до MnО2. SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
В щелочной среде окислитель MnO4 — принимает 1 электрон и восстанавливается до MnО4 2- . Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
http://infourok.ru/primeri-ovr-soedineniy-marganca-1455408.html
http://zadachi-po-khimii.ru/obshaya-himiya/metod-elektronnogo-balansa-ionno-elektronnyj-metod-metod-polureakcij.html