Эмпирическое уравнение аррениуса аналитический вывод этого уравнения
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
2.1 СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
2.1.9 Влияние температуры на константу скорости реакции
Константа скорости реакции есть функция от температуры; повышение температуры, как правило, увеличивает константу скорости. Первая попытка учесть влияние температуры была сделана Я. Г. Вант-Гоффом, который сформулировал следующее эмпирическое правило:
При повышении температуры на каждые 10 градусов константа скорости элементарной химической реакции увеличивается в 2 – 4 раза.
Величина, показывающая, во сколько раз увеличивается константа скорости при повышении температуры на 10 градусов, есть температурный коэффициент константы скорости реакции γ . Математически правило Вант-Гоффа можно записать следующим образом:
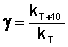
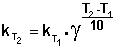
Однако правило Вант-Гоффа применимо лишь в узком температурном интервале, поскольку температурный коэффициент скорости реакции γ сам является функцией от температуры; при очень высоких и очень низких температурах γ становится равным единице (т.е. скорость химической реакции перестает зависеть от температуры).
2.1.10 Уравнение Аррениуса
Очевидно, что взаимодействие частиц осуществляется при их столкновениях; однако число столкновений молекул очень велико и, если бы каждое столкновение приводило к химическому взаимодействию частиц, все реакции протекали бы практически мгновенно. С. Аррениус постулировал, что столкновения молекул будут эффективны (т.е. будут приводить к реакции) только в том случае, если сталкивающиеся молекулы обладают некоторым запасом энергии – энергией активации.
Энергия активации есть минимальная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию.
Рассмотрим путь некоторой элементарной реакции
Поскольку химическое взаимодействие частиц связано с разрывом старых химических связей и образованием новых, считается, что всякая элементарная реакция проходит через образование некоторого неустойчивого промежуточного соединения, называемого активированным комплексом:
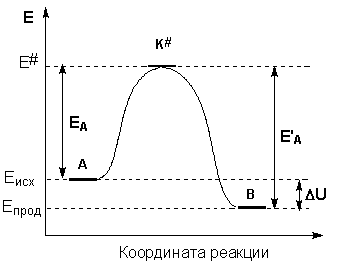
Образование активированного комплекса всегда требует затраты некоторого количества энергии, что вызвано, во-первых, отталкиванием электронных оболочек и атомных ядер при сближении частиц и, во-вторых, необходимостью построения определенной пространственной конфигурации атомов в активированном комплексе и перераспределения электронной плотности. Таким образом, по пути из начального состояния в конечное система должна преодолеть своего рода энергетический барьер. Энергия активации реакции приближённо равна превышению средней энергии активированного комплекса над средним уровнем энергии реагентов. Очевидно, что если прямая реакция является экзотермической, то энергия активации обратной реакции Е’А выше, нежели энергия активации прямой реакции EA. Энергии активации прямой и обратной реакции связаны друг с другом через изменение внутренней энергии в ходе реакции. Вышесказанное можно проиллюстрировать с помощью энергетической диаграммы химической реакции (рис. 2.5).
Рис. 2.5 Энергетическая диаграмма химической реакции.
Eисх – средняя энергия частиц исходных веществ,
Eпрод – средняя энергия частиц продуктов реакции
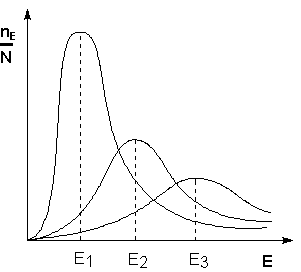
Поскольку температура есть мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции (рис.2.6):
Рис. 2.6 Распределение частиц по энергии
Здесь nЕ/N – доля частиц, обладающих энергией E;
Ei — средняя энергия частиц при температуре Ti (T1 уравнения Аррениуса . Согласно уравнению изобары Вант-Гоффа,
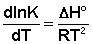
Поскольку константа равновесия есть отношение констант скоростей прямой и обратной реакции, можно переписать выражение (II.31) следующим образом:
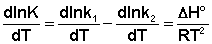
Представив изменение энтальпии реакции ΔHº в виде разности двух величин E1 и E2, получаем:
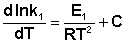
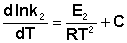
Здесь С – некоторая константа. Постулировав, что С = 0, получаем уравнение Аррениуса, где EA – энергия активации :
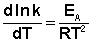
После неопределенного интегрирования выражения (II.35) получим уравнение Аррениуса в интегральной форме:
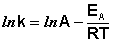
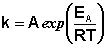
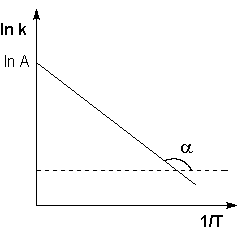
Рис. 2.7 Зависимость логарифма константы скорости химической
реакции от обратной температуры.
Здесь A – постоянная интегрирования. Из уравнения (II.37) нетрудно показать физический смысл предэкспоненциального множителя A, который равен константе скорости реакции при температуре, стремящейся к бесконечности. Как видно из выражения (II.36), логарифм константы скорости линейно зависит от обратной температуры (рис.2.7); величину энергии активации EA и логарифм предэкспоненциального множителя A можно определить графически (тангенс угла наклона прямой к оси абсцисс и отрезок, отсекаемый прямой на оси ординат).
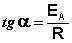
Зная энергию активации реакции и константу скорости при какой-либо температуре T1, по уравнению Аррениуса можно рассчитать величину константы скорости при любой температуре T2:
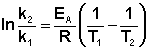
Copyright © С. И. Левченков, 1996 — 2005.
Вывод уравнения Аррениуса
Теория столкновений позволяет установить математическое соотношение между скоростью реакции и частотой столкновений, а также вероятностью того, что энергия столкновения E превосходит минимальную энергию Еm, необходимую для осуществления реакции. Это соотношение имеет вид
Скорость реакции = (Частота столкновений) • (Вероятность того, что E > Em) Из этого соотношения можно вывести следующее уравнение:
где к-константа скорости реакции; Р-стерический фактор, имеющий значение от 0 до 1 и соответствующий той части сталкивающихся молекул, которые имеют необходимую взаимную ориентацию при столкновении; Z-число столкновений, которое связано с частотой столкновений; Еа-энергия активации, соответствующая минимальной энергии столкновений, которую должны иметь реагирующие молекулы; Л-газовая постоянная; T-абсолютная температура.
Два множителя, P и Z, можно объединить в одну постоянную А, которую называют предэкспоненциальным множителем или константой Аррениуса. В результате получается известное уравнение Аррениуса, с которым мы уже познакомились в предыдущем разделе:
ТЕОРИЯ ПЕРЕХОДНОГО СОСТОЯНИЯ
Теория переходного состояния рассматривает реагирующие молекулы как единую систему. Она подробно исследует изменения геометрического расположения атомов в этой системе по мере того, как в ней происходит превращение реагентов в продукты. Геометрическое положение атомов в такой молекулярной системе называется конфигурацией. По мере того, как конфигурация реагентов превращается в конфигурацию продуктов, происходит постепенное возрастание потенциальный энергии системы до тех пор, пока она не достигнет максимума. В момент достижения максимума энергии молекулы имеют критическую конфигурацию, которая называется переходным состоянием или активированным комплексом. Достичь этой критической конфигурации способны лишь те молекулы, которые обладают достаточной полной энергией. По мере того, как конфигурация этого переходного состояния превращается в конфигурацию продуктов, происходит уменьшение потенциальной энергии (рис. 9.12). Координата реакции на этих двух диаграммах представляет изменения в геометрическом расположении атомов реагирующих молекул, рассматриваемых как единая система, по мере того, как эта система испытывает превращение, начинающееся с конфигурации реагентов, переходящее в критическую конфигурацию и завершающееся конфигурацией продуктов. Если в реакции образуются интермедиаты, то возникновению каждого интермедиата соответствует минимум на графике зависимости потенциальной энергии от координаты реакции (рис. 9.13).
Рис. 9.12. Энергетический профиль реакции — график зависимости потенциальной энергии от координаты реакции, а-для экзотермической реакции; б-для эндотермической реакции.
Теория переходного состояния может использоваться для прогнозирования постоянных А и Ел в уравнении Аррениуса. Использование этой теории и современной вычислительной техники позволяет устанавливать точную картину протекания химических реакций на молекулярном уровне.
Константа скорости и температура по уравнению Аррениуса
Уравнение Аррениуса используется для расчета скорости реакции. Это важная часть химической кинетики. Это помогает понять влияние температуры на скорость реакции. Это уравнение было предложено в 1889 году Сванте Аррениусом.
Где k = константа скорости
A = коэффициент частоты
Ea = энергия активации
R = газовая постоянная
T = температура Кельвина
В основе уравнения Аррениуса лежит теория столкновений. Согласно этой теории, реакция — это столкновение двух молекул (одного или двух разных веществ) с образованием промежуточного соединения. Образованный таким образом промежуточный продукт нестабилен и существует в течение короткого периода времени. Промежуточные разрывы дают две молекулы продукта. Энергия, используемая для образования промежуточного продукта, известна как энергия активации.
Теперь, если мы возьмем логарифм с обеих сторон уравнения Аррениуса, реакция изменится на
Ln — натуральный логарифм, значения могут быть взяты из логарифмической таблицы.
Для графического представления
Если сравнить это уравнение с уравнением прямой, получим
Это дает прямолинейный график, но с отрицательным наклоном.
График кв / с (1 / Т)
Влияние температуры
Из графика мы заключаем, что температура и скорость реакции пропорциональны. С повышением температуры скорость реакции также увеличивается. Кинетическая энергия увеличивается с температурой. Итак, когда мы увеличиваем температуру, количество молекул с кинетической энергией больше, чем энергия активации, увеличивается. Это увеличивает скорость общей реакции за счет уменьшения энергии активации.
При изменении температуры на 10 К скорость увеличивается почти вдвое.
Возьмем уравнения Аррениуса для моментов времени T1 и T2, где скорости реакции равны K1 и K2 соответственно.
ln k1 = -Ea / RT1 + ln A —— (1)
ln k2 = -Ea / RT2 + ln A —— (2)
вычитание (1) из (2)
ln k2 — ln k1 = Ea / RT1 — Ea / RT2
ln k2 / k1 = (Ea / R) 1 / T 1 – 1 / T 2 «> 1 / т 1 — 1 / т 2 1 / Т 1 — 1 / Т 2
преобразование ln в журнал;
журнал k2 / k1 = (Ea /2.303R) ( T 2 – T 1 ) / T 1 T 2 «> ( Т 2 — Т 1 ) / Т 1 т 2 ( Т 2 — Т 1 ) / Т 1 Т 2
Уравнение Аррениуса также подразумевает, что некаталитическая реакция больше зависит от температуры по сравнению с каталитической реакцией.
Некоторые реальные примеры из жизни:
Молоко скисает быстрее, если хранить его при комнатной температуре, а не в холодильнике;
Сливочное масло летом прогоркает быстрее, чем зимой;
Яйца варятся вкрутую намного быстрее на уровне моря, чем в горах.
Хладнокровные животные, такие как насекомые и рептилии, более вялые в холодные дни.
Эффект катализатора
Катализатор также помогает увеличить скорость реакции. Катализатор достигает этого за счет снижения энергии активации, необходимой для протекания реакции.
Ниже приведен пример задачи, которая поможет вам лучше понять и решить вопросы, основанные на уравнении Аррениуса.
1. Найдите энергию активации реакции (в кДж / моль), если константа скорости при 650 К составляет 3,4 М-1 с-1 и 35,0 при 750 К.
k2 / k1 = (Ea /2.303R) ( T 2 – T 1 ) / T 1 T 2 «> ( Т 2 — Т 1 ) / Т 1 т 2 ( Т 2 — Т 1 ) / Т 1 Т 2
35,0 / 3,4 = (Ea / 2,303 * 8,314) ( 750 – 650 ) / 750 ∗ 650 «> ( 750 — 650 ) / 750 * 650 ( 750 — 650 ) / 750 * 650
10.294 = (Ea /19.147) ( 100 ) / 487500 «> ( 100 ) / 487500 ( 100 ) / 487500
1.0125 = (Ea /19.147) ( 100 ) / 487500 «> ( 100 ) / 487500 ( 100 ) / 487500
Ea = 1,0125 * 19,147 * 4875
Ea = 94508,395 Дж / моль
Ea = 9,4508 * 104 Дж / моль
Ea = 9,4503 кДж / моль
Важность уравнения Аррениуса
Уравнение Аррениуса важно по следующим причинам:
Это позволяет учесть факторы, влияющие на скорость реакции, которую нельзя определить с помощью закона скорости.
С помощью этого уравнения можно найти влияние энергетического барьера, температуры, частоты, наличия катализатора, ориентации столкновений.
Таким образом, это причины, по которым понимание и изучение уравнения Аррениуса так важно.
http://www.himikatus.ru/art/ch-act/0434.php
http://bystudin.ru/%D0%BA%D0%BE%D0%BD%D1%81%D1%82%D0%B0%D0%BD%D1%82%D0%B0-%D1%81%D0%BA%D0%BE%D1%80%D0%BE%D1%81%D1%82%D0%B8-%D0%B8-%D1%82%D0%B5%D0%BC%D0%BF%D0%B5%D1%80%D0%B0%D1%82%D1%83%D1%80%D0%B0-%D0%BF%D0%BE-%D1%83/