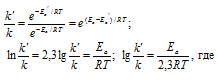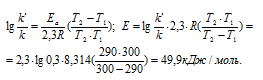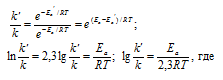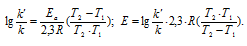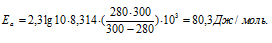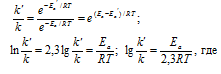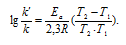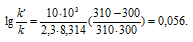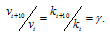Расчеты энергии активации реакции по уравнению Аррениуса
Задача 341.
Чему равна энергия активации реакции, если при повышении температуры от 290 до 300 К скорость ее увеличится в 2 раза?
Решение:
Из уравнения Аррениуса 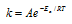
Ea — энергия активации, k и k’ — константы скорости реакции, Т – температура в К (298). Учитывая, что происходит повышение температуры реакции от 290 К до 300 К, уравнение можно преобразовать, получим:
Ответ: 49,9кДж/моль.
Задача 342.
Каково значение энергии активации реакции, скорость которой при 300 К в 10 раз больше, чем при 280 К?
Решение:
Из уравнения Аррениуса 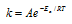
Ea — энергия активации, k и k’ — константы скорости реакции, Т – температура в К (298). Учитывая зависимость константы скорости реакции от изменения температуры, получим:
Подставляя в последнее уравнение данные задачи и, выражая энергию активации в джоулях, получим:
Ответ: 80,3кДж/моль.
Задача 343.
Энергия активации реакции O3(г) + NO(г) → O2(г) + NO2(г) равна 10 кДж/моль. Во сколько раз изменится скорость реакции при повышении температуры от 27 до 37 °С ?
Решение:
Из уравнения Аррениуса 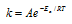
Ea — энергия активации, k и k’ — константы скорости реакции, Т – температура в К (298). Учитывая зависимость константы скорости реакции от изменения температуры, получим:
Подставляя в последнее уравнение данные задачи и, выражая энергию активации в джоулях, получим:
Окончательно находим: k/k’ = 1,14.
Ответ: В 1,14 раз.
Задача 344.
Зависит ли температурный коэффициент скорости реакции от значения энергии активации? Ответ обосновать.
Решение:
Согласно правилу Вант-Гоффа, зависимость скорости реакции от температуры определяется уравнением:
Здесь vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С ); 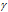
Возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости реакции 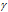
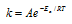
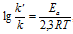
Еа — энергия активации, k и k’ — константы скорости реакции, Т – температура в К (298). Учитывая зависимость константы скорости реакции от изменения температуры, получим:
Из чего следует, что чем меньше энергия активации и выше температура, тем больше константа скорости реакции и k’/k .
В стандартных условиях энергия активации различных реакций различна и она зависит от природы реагирующих веществ.
Таким образом, температурный коэффициент (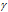
Задача 345.
Зависит ли значение энергии активации реакции в случае гетерогенного катализа от площади поверхности катализатора и от ее структуры?
Решение:
Известно, что катализатор снижает энергию активации реакции, чем дольше активность катализатора, тем большее снижение энергии активации реакции наблюдается в присутствии катализатора.
При гетерогенном катализе реакция протекает на поверхности катализатора. Отсюда следует, что активность катализатора зависит от величины поверхности (площади) его и свойств этой поверхности. Чаще всего используют пористую структуру (пемза, асбест и др.). Чтобы увеличить активность данного катализатора, нужно увеличить площадь соприкосновения его с реагентом. Применяют катализаторы с различной структурой поверхности (пористую, порошковую, в виде колец, трубок и т.п.).
Таким образом, с увеличением площади поверхности твёрдого катализатора увеличивается его активность и, соответственно, значительно уменьшается энергия активация катализируемой реакции.
Задача 346.
Реакция 2Н2(г) + О2(г) = 2Н2О(г) протекает с выделением теплоты. Однако для того, чтобы реакция началась, исходную смесь газов надо нагреть. Как это объяснить?
Решение:
Данная реакция является экзотермической, но для начала протекания реакции необходимо дополнительно подогреть смесь водорода и кислорода. Это можно объяснить тем, что энергия активации реакции слишком велика ( больше 120 кДж/моль), значит лишь только малая часть столкновений молекул водорода и кислорода друг с другом приводит к их взаимодействию. Для того чтобы увеличить число активных столкновений необходимо исходную смесь нагреть, т.е. повысить температуру системы, что вызовет разрыв или ослабление связей между атомами молекул газов. При нагревании смеси Н2 и О2 в отношении 2 : 1 происходит взрыв. Объясняется это тем, что из атомов водорода и кислорода, изначально образовавшихся при подогревании газовой смеси, образуются радикалы * ОН, которые легко реагируют с молекулой Н2 с образованием молекул Н2О и * Н. Последний реагирует с молекулой О2 с образованием радикалов * О *, и * ОН. В свою очередь, атом кислорода, реагируя с молекулой Н2, порождает радикалы * Н и * ОН, при столкновении которых образуется молекула Н2О.
Таким образом, при нагревании смеси водорода и кислорода происходит увеличение образования активных частиц(* О * , *Н, *ОН), что порождает цепную реакцию, и скорость её резко возрастает, происходит взрыв смеси газов.
Уравнение Аррениуса. Энергия активации химической реакции





Уравнение Аррениуса. Энергия активации химической реакции
- Уравнение Аррениуса. Энергия химической активации Вы. Формулы (V.19) и (V.20) являются только приблизительными Зависимости u = f (T) и k = f (T). Зависит от функции Константа скорости химической реакции k от температуры Обновлено шведским ученым С. Аррениусом (1889): * = (V. 2 1) Где А — предэкспоненциальный фактор. EA-acty energy.
- Реакция реакции; Т — абсолютная температура К. В химической кинетике часто используется уравнение Арре. Хорошая логарифмическая форма; в * = -E>, / RT + \ nA. (V.22) Из уравнения (V.22) зависимость постоянной равна Температура роста химической реакции встроена в кору Создайте чернила / T, линейные (рисунок V.3). Эта зависимость Энергию активации реакции Ea можно определить по тангенсу угла.
Наклон линии вдоль разреза и предэкспоненциальный множитель А Если ku, 1/7 = 0, обрезать вертикальную ось. Людмила Фирмаль
Исследование советских химиков (В. И. Гольданский и др.) Ультранизкая температура (ниже точки кипения азота -77 К) показала Закон Аррениуса для серии взаимодействий при очень низких температурах Остановите поведение, потому что 1 р / г зависит от 1 / т. Рис, v.u. Зависит от Химическая скорость Температура реакции Рига V.4. ^ Постоянная зависимость Скорость реакции от темпа Отклонение от Ирати: Аркениус (Рисунок V L) нелинейный.
Скорость таких реакций низкая Температура (Т ^ 10К) составляет Уравнение Аррениуса. Уравнение Аррениуса имеет две [величины; £ a и A Некоторые характеристики каждой реакции. Их фи Логический смысл получается по следующим причинам: Неплохо Предпосылки для инициирования химических взаимодействий между Две молекулы должны столкнуться.
Но не все Молекулярные столкновения заканчиваются действием химических взаимодействий Действия, то есть не все коллизии действительны. Также процент Как правило, общее количество эффективных столкновений Незначительный, большинство столкновений между молекулами Не вызывает реакции. Это можно легко проверить, рассчитав Возможное число на основе газовой кинетики.
Молекулярные столкновения и соответствующие скорости Сравните реакцию, затем ожидание (с расчетом 100% Эффективность) фактическая скорость; первое во мне Последние несколько раз. Аррениус предположил, что химический Действия выполняются только между этими конфликтами Молекулы, которые достигли определенной энергии.
Характерный уровень этой реакции, ее энергия Барьеры. Если такая молекула считается активной, эффект Столкновения происходят только между активами Pattern. Все молекулы в системе с низким накоплением энергии Энергетический барьер реакции находится в особом состоянии, Обычно это называется переходным состоянием или активным состоянием.
Комплекс, можно предположить, что система настроена Институт Активации комплекса характеризуется тем, что он в нем Уже нет исходного материала, но нет продукта реакции [1; Исходный материал передается продукту реакции. Принципиальная схема Переход лыж от исходных материалов A и B к продукту реакции C А через активированный комплекс А …
В состояние Иллюстрация льна. D.5 *. R. При взятии среднего уровня энергии исходной молекулы Вещество в системе равно £ |, а средняя энергия перехода Разность состояний E’-E \ представляет энергию Активация этой реакции, системная энергия (рисунок U.5) Переходное состояние максимально. Это значит Купальные сооружения очень нестабильны.
В процессе реакции он Расширяется до произведения взаимодействий C и O. На рассмотрении В этом примере средний уровень энергии молекул продукта реакции Е 2 ниже среднего уровня энергии исходной молекулы Вещество E . Это означает, что процесс будет продолжен с назначением Энергия (экзотермическая реакция). Средняя энергия молекул продукта реакции £ 2.
Может быть выше, чем средний энергетический уровень молекулы источника Детали E 1 (рисунок U.b). Процесс переходит к поглощению энергии. Гии (эндотермическая реакция) из окружающей среды. разница £ 2-¿ 1 равно тепловому эффекту процесса АЭ. Энергия активации является одним из основных параметров. ry характеризует скорость химического взаимодействия. стабилитрон Активация Процесс активации зависит от характера реакции Висячие.
- Чем выше энергия активации, тем меньше Равное условие) скорость реакции. Энергия активации Необходим в основном для ослабления химических связей Преодоление отталкивания с исходным материалом Электроны, генерируемые, когда молекулы и атомы объединяются Предотвращает взаимодействие веществ и их столкновения. Реакция между веществами, которые обычно имеют сильные ковалентные связи Облигации £ Медленно.
Это относится ко многим взаимодействиям Взаимодействие с органическим веществом Н2 + У2 0 2 = П20 и л и Н 2 + ЗЫ2 = 2НХ², скорость равна Стандартное условие практически нулевое. небольшой „„ И очень высокая скорость характеризуется ионами Взаимодействие в электролите (например: + 5 0 4 ’= $ 04 или Ag при * * + SG ‘= AgCl).
Это В связи с тем, что противоположно заряженные ионы притягиваются друг к другу. Людмила Фирмаль
Будьте друзьями и не нужно тратить энергию на преодоление силы Отталкивание взаимодействующих частиц. Простой расчет энергии активации химической реакции Согласно уравнению Аррениуса (U.22) значение известно Константы скорости k / -и k-1 при разных температурах: кг: I—, / I 1 (D.23) • nramot () и [) обрабатывают координаты реакции. Ход реакции. Axhibiro Bunny. С комплексом … LN 0 Координаты реакции Рис, д.5.
Диаметр энергии Граммы лихорадки Акии Координаты реакции Рисунок D.6. Диаметр энергии Грамм для эндотермы реакция Дает энергию активации нескольких химических реакций После: N20, -2N02, Hg + 12 ^ 2H1 C2H4 + I2 — CrNb, 2H1-Hg + b. C2H5Br ^ C2H4 + HBr. C H 4 C + 2H, Е д = 54,4 кДж / моль, £ = 165,5 кДж / моль, EV = 180,5 кДж / моль L ‘= 186,4 кДж / моль, £ = 218,0 кДж / мл £ = 334,7 кДж / моль, Обычно реакция ->! При 50 кДж / моль, Не протекать при комнатной температуре.
Замечательная энергия активации Это расстройство движения, Многие химические взаимодействия не остывают Рассмотрено с точки зрения химической термодинамики (DO •




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Энергия химической активации: из чего состоит, расчет
Энергия химической активации: из чего состоит, расчет — Наука
Содержание:
Вэнергия химической активации (с точки зрения кинетических исследований) означает минимально возможное количество энергии, необходимое для начала химической реакции. Согласно теории столкновений в химической кинетике, считается, что все движущиеся молекулы обладают определенной кинетической энергией.
Это означает, что чем больше скорость его движения, тем больше величина его кинетической энергии. В этом смысле молекула, которая совершает быстрое движение, не может быть разделена на фрагменты сама по себе, поэтому должно произойти столкновение между ней и другой молекулой, чтобы произошла химическая реакция.
Когда это происходит — когда происходит столкновение между молекулами — часть их кинетической энергии преобразуется в энергию колебаний. Аналогичным образом, если в начале процесса кинетическая энергия высока, молекулы, которые участвуют в столкновении, будут представлять такую сильную вибрацию, что некоторые из имеющихся химических связей будут разорваны.
Этот разрыв связей составляет первый шаг в превращении реагентов в продукты; то есть в их образовании. Напротив, если в начале этого процесса кинетическая энергия будет небольшой, произойдет явление «отскока» молекул, благодаря которому они разделятся практически целыми.
Из чего он состоит?
Исходя из концепции столкновений между молекулами для инициирования ранее описанных химических реакций, можно сказать, что для возникновения столкновения требуется минимальное количество энергии.
Таким образом, если значение энергии меньше этого необходимого минимума, просто не будет никаких изменений между молекулами после столкновения, а это означает, что, когда эта энергия отсутствует, участвующие частицы остаются практически нетронутыми, и этого не произойдет. любые изменения из-за этого сбоя.
В этом порядке идей минимальная энергия, необходимая для того, чтобы изменение произошло после столкновения между молекулами, называется энергией активации.
Другими словами, молекулы, участвующие в столкновении, должны иметь общую кинетическую энергию, равную или превышающую энергию активации, чтобы произошла химическая реакция.
Точно так же во многих случаях молекулы сталкиваются и порождают новый вид, называемый активированным комплексом, структуру, которую также называют «переходным состоянием», потому что она существует только временно.
Это вызвано реагентами из-за столкновения и до образования продуктов реакции.
Активированный комплекс
Вышеупомянутый активированный комплекс образует разновидность, которая имеет очень низкую стабильность, но, в свою очередь, имеет большую величину потенциальной энергии.
На следующей диаграмме показано превращение реагентов в продукты, выраженное в единицах энергии, с учетом того, что величина энергии образованного активированного комплекса значительно больше, чем у реагентов и продуктов.
Если в конце реакции продукты обладают большей стабильностью, чем реагирующие вещества, высвобождение энергии происходит в виде тепла, вызывая экзотермическую реакцию.
Напротив, если реагенты приводят к большей стабильности, чем продукты, это означает, что реакционная смесь проявляет поглощение энергии в виде тепла из окружающей среды, что приводит к эндотермической реакции.
Точно так же, если случается тот или иной случай, следует построить диаграмму, подобную показанной ранее, на которой отображается потенциальная энергия системы, которая реагирует против продвижения или прогресса реакции.
Таким образом, получаются изменения потенциальной энергии, которые происходят по мере протекания реакции и превращения реагентов в продукты.
Как рассчитывается?
Энергия активации химической реакции тесно связана с константой скорости указанной реакции, и зависимость этой константы от температуры представлена уравнением Аррениуса:
В этом выражении k представляет собой константу скорости реакции (которая зависит от температуры) и параметр К это называется частотным фактором, и это мера частоты столкновений между молекулами.
В свою очередь,а также выражает основание ряда натуральных логарифмов. Он возведен в степень, равную отрицательному отношению энергии активации (Ea) между произведением газовой постоянной (р) и абсолютной температуры (Т) рассматриваемой системы.
Следует отметить, что частотный фактор можно рассматривать как постоянный в некоторых реакционных системах в широком диапазоне температур.
Это математическое выражение было первоначально предложено голландским химиком Якобусом Хенрикусом вант Хоффом в 1884 году, но тем, кто придал ему научную ценность и интерпретировал его предпосылку, был шведский химик Сванте Аррениус в 1889 году.
Расчет энергии активации химической реакции
Уравнение Аррениуса определяет прямую пропорциональность, которая существует между константой скорости реакции и частотой столкновений между молекулами.
Точно так же это уравнение можно представить более удобным способом, применив свойство натурального логарифма к каждой стороне уравнения, получив:
ln k = ln A — Ea / RT
Когда члены переставляют, чтобы получить уравнение прямой (y = mx + b), получается следующее выражение:
ln k = (- Ea / R) (1 / T) + ln A
Итак, при построении графика зависимости ln k от 1 / T получается прямая линия, где ln k представляет собой координату, а (-Ea / R) представляет собой наклон линии (m), (1 / T) представляет координату x, а ln A представляет точку пересечения с осью ординат (b).
Как видно, крутизна, полученная в результате этого расчета, равна значению –Ea / R. Это означает, что если вы хотите получить значение энергии активации с помощью этого выражения, вы должны выполнить простое уточнение, в результате чего:
Здесь значение m известно, а R — постоянная величина, равная 8,314 Дж / К · моль.
Как энергия активации влияет на скорость реакции?
При попытке получить картину энергии активации ее можно рассматривать как барьер, который не позволяет реакции происходить между молекулами с более низкой энергией.
Как и в обычной реакции, количество молекул, которые могут реагировать, довольно велико, скорость — и, что эквивалентно, кинетическая энергия этих молекул — может быть очень переменной.
Обычно бывает, что только небольшое количество всех молекул, которые испытывают столкновение — те, которые имеют большую скорость движения — имеют достаточно кинетической энергии, чтобы быть в состоянии превысить величину энергии активации. Итак, эти молекулы подходят и могут участвовать в реакции.
Согласно уравнению Аррениуса, отрицательный знак, предшествующий частному между энергией активации и произведением газовой постоянной и абсолютной температуры, означает, что константа скорости уменьшается по мере увеличения энергии активации, а также рост при повышении температуры.
Примеры расчета энергии активации
Для расчета энергии активации путем построения графика в соответствии с уравнением Аррениуса константы скорости реакции разложения ацетальдегида были измерены при пяти различных температурах, и желательно определить энергию активации для реакции, которая выражается как:
Данные для пяти измерений следующие:
к (1 / М 1/2 S): 0,011 — 0,035 — 0,105 — 0,343 — 0,789
Т (К): 700 — 730 — 760 — 790 — 810
Прежде всего, чтобы решить эту неизвестную и определить энергию активации, необходимо построить график ln k vs 1 / T (y vs x), чтобы получить прямую линию и отсюда взять наклон и найти значение Ea, как объяснено.
Преобразуя данные измерений, согласно уравнению Аррениуса [ln k = (- Ea / R) (1 / T) + ln A], находятся следующие значения для y и x соответственно:
ln k: (-4,51) — (-3,35) — (-2,254) — (-1,070) — (-0,237)
1 / Т (К -1 ): 1,43*10 -3 – 1,37*10 -3 – 1,32*10 -3 – 1,27*10 -3 – 1,23*10 -3
Из этих значений и с помощью математического расчета наклона — либо в компьютере, либо в калькуляторе, с помощью выражения m = (Y2-Y1) / (ИКС2-ИКС1) или методом линейной регрессии — получаем m = -Ea / R = -2,09 * 10 4 К. Таким образом:
Ea = (8,314 Дж / К моль) (2,09 * 10 4 K)
= 1,74*10 5 = 1,74*10 2 кДж / моль
Для определения других энергий активации графически выполняется аналогичная процедура.
Ссылки
- Википедия. (н.д.). Энергия активации. Восстановлено с en.wikipedia.org
- Чанг, Р. (2007). Химия, Девятое издание. Мексика: Макгроу-Хилл.
- Britannica, E. (s.f.). Энергия активации. Получено с britannica.com
- Мур, Дж. У. и Пирсон, Р. Г. (1961). Кинетика и механизм. Восстановлено с books.google.co.ve
- Кэше, Х. (2003). Коррозия металлов: физико-химические основы и современные проблемы. Получено с books.google.co.ve
Мавританский роман: происхождение, характеристика, представители и произведения
Нумерологические навязчивые идеи: постоянно думать о числах
http://lfirmal.com/uravnenie-arreniusa-energiya-aktivacii-himicheskoj-reakcii/
http://ru1.warbletoncouncil.org/energia-activacion-quimica-15325