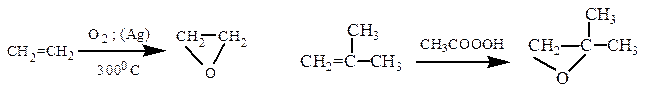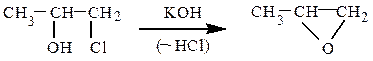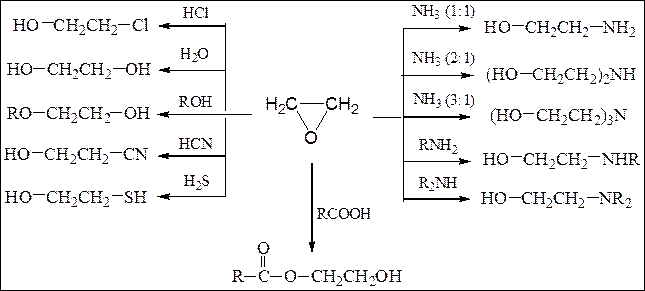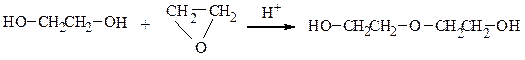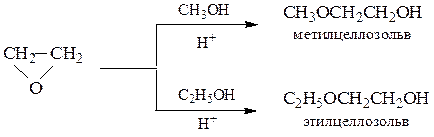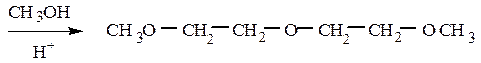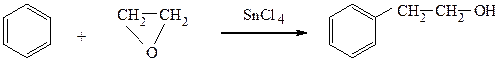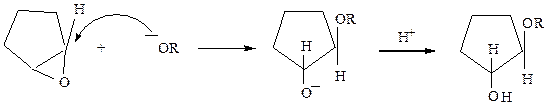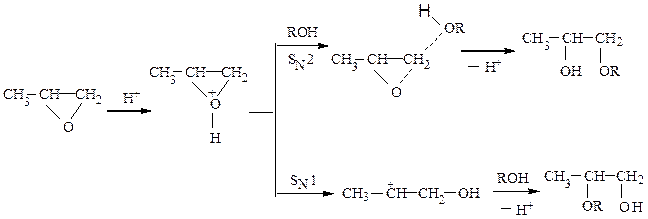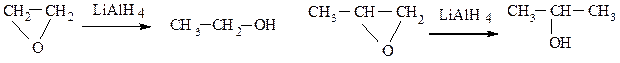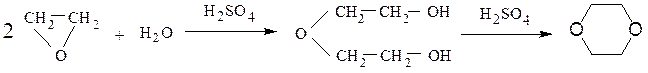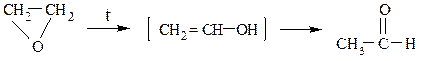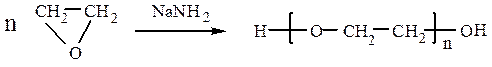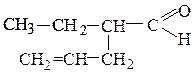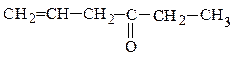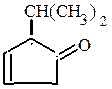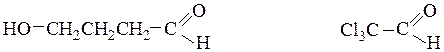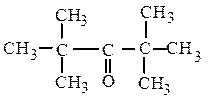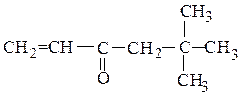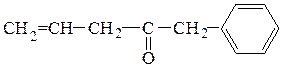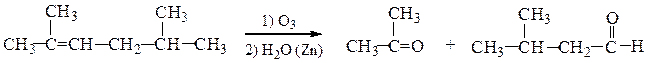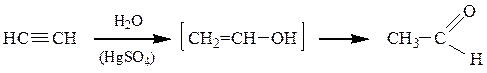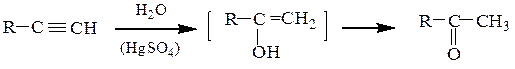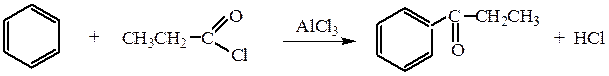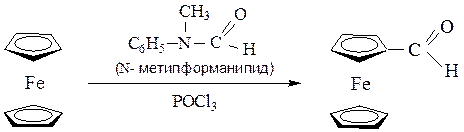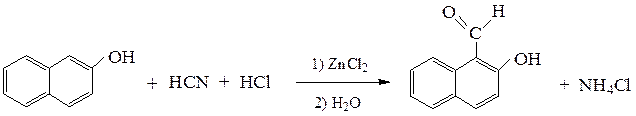ОКИСИ АЛКЕНОВ (ОКСИРАНЫ, ЭПОКСИДЫ)
Определение.Соединения, содержащие атом кислорода в трехчленном цикле.
Способы получения. Получают окислением алкенов кислородом на серебряном катализаторе (400 ºС) или надкислотами (реакция Прилежаева), а также дегидрогалогенированием галогенгидринов спиртовым раствором КОН.
В настоящее время окись этилена в промышленности получают окислением этилена над серебряным катализатором (375 0 С).
Химические свойства.В отличие от простых эфиров α-окиси алкенов отличаются высокой реакционной способностью. Ввиду сильного напряжения в трехчленном цикле, реакции проходят обычно с его раскрытием. Полярность связи С δ+ – О δ- обуславливает возможность атаки нуклеофилом по углеродному атому и протоном по кислородному атому. Суммарно реакции протекают как присоединение реагента, содержащего нуклеофильную частицу.
Схема 11. Основные реакции окиси этилена:
При взаимодействии эпоксиэтана (окиси этилена) со спиртами образуются моно- и диэфиры этиленгликоля и диэтиленгликоля, которые находят широкое применение в качестве высококипящих растворителей, незамерзающих охлаждающих смесей для автомобилей (антифризов). Целлозольвы – моноэфиры этиленгликоля, карбитолы – моноэфиры диэтиленгликоля, диглимы – диэфиры диэтиленгликоля.
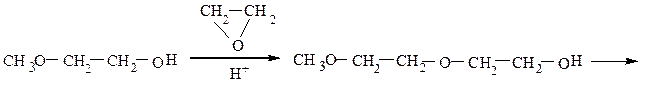
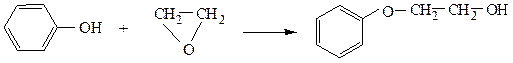
С фенолами окись этилена образует фениловые эфиры этиленгликоля:
С продуктом алкилирования фенола диизобутиленом получают неонол (ПАВ):
Галогенгидрины, являющиеся продуктами взаимодействия окиси этилена с галогеноводородами применяются в качестве растворителей эфиров целлюлозы и как β-оксиэтилирующие реагенты.
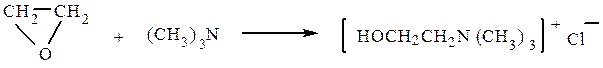
Продукт взаимодействия окиси этилена с триметиламином – холин в результате ацилирования превращается в ацетилхолин, обладающий высокой физиологической активностью (резко понижает кровяное давление, усиливает перистальтику кишечника):
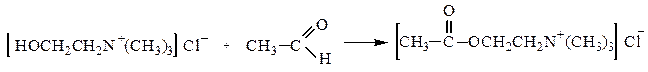
Ароматические углеводороды алкилируются окисью этилена в присутствии кислот Льюиса. Взаимодействием бензола с окисью этилена получают β-фенилэтиловый спирт, обладающий запахом розы и широко применяемый в парфюмерии.
Реакции окиси этилена с реактивами Гриньяра позволяют синтезировать первичные спирты, а прочих α-окисей алкенов – вторичные спирты (см. выше, способы получения спиртов).
В производных окиси этилена типа 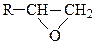
В кислой среде реакции могут идти по механизмам SN1 и SN2 :
Механизм реакций раскрытия трехчленного оксидного цикла зависит от наличия в реакционной среде нуклеофильных частиц (в основном, от ее кислотности) и определяется правилом Красуского: окиси типа 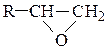
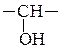
α-Окиси алкенов восстанавливаются алюмогидридом лития во вторичные спирты (окись этилена превращается в первичный спирт – этанол):
При нагревании окиси этилена с разбавленной серной кислотой наблюдается димеризация приводящая к диоксану:
Окись этилена при 300 – 400 0 С (без катализатора) или при 150 – 300 0 С (кат. Al2O3, H3PO4) изомеризуется в уксусный альдегид:
Окись этилена под действием амида натрия или триизобутилалюминия (ТИБА) полимеризуется:
Полимеры с молекулярной массой выше 1 млн применяются в качестве флотореагентов, коагуляторов, загустителей латексов; низкомолекулярный полиэтиленоксид (желеобразный) является основой косметических композиций последнего поколения.
Контрольные вопросы к главе 10 «α-Окиси алкенов»
№ 1.Перечислите методы синтезов α-окисей алкенов.
№ 2.Предложите схему синтеза следующих веществ из окиси этилена:
(а) (β,β’-дихлордиэтил)сульфида (иприта) из окиси этилена; (б) карбитола СН3СН2ОСН2СН2ОСН2СН2ОН из окиси этилена; (в)фенилкарбитола С6Н5-О-СН2СН2-О-СН2ОН из фенола и окиси этилена; (г) этилцелозольва С2Н5ОСН2СН2ОН из этилена; (д) b-меркаптоэтиламина HS-CH2CH2-NH2 (антирадиационного препарата) из окиси этилена.
№ 3. Рассмотрите механизм гидратации α-окиси пропилена в кислой и щелочной среде.
№ 4. Какие продукты образуются при раскрытии эпоксидного цикла окиси изобутилена при действии метилатом натрия и метанола в кислой среде?
АЛЬДЕГИДЫ И КЕТОНЫ
Большая группа органических соединений содержит карбонильную группу С=О. Если карбонильный атом углерода связан только с атомом водорода или углеводородными радикалами, то такие соединения относятся к альдегидам и кетонам.
Определение.Альдегиды и кетоны относятся к карбонильным органическим соединениям и обладают высокой реакционной способностью. Почти все химические свойства связаны с наличием в них сильно поляризованной карбонильной группы С=О.
Электронное строение карбонильной группы.sp 2 -Гибридизированный атом углерода и атом кислорода, содержащий несмешанные s- и р-орбитали, образуют σ-связь за счет sp 2 —орбитали углерода и р-орбитали кислорода. π-Связь карбонильной группы С=О возникает при перекрывании р-орбитали атомов углерода и кислорода. Остаются две sp 2 —орбитали углерода, используемые для образования σ-связей, а также одна s— и одна р-орбитали кислорода, на каждой из которых находится по паре свободных электронов.
Благодаря большой электроотрицательности кислорода обе углерод-кислородные связи сильно поляризуются и атом углерода приобретает частичный положительный заряд (δ+). Этот положительный заряд является причиной индуктивного смещения электронов в связях между атомом углерода и соседними группами. Все эти особенности электронного строения карбонильной группы могут объяснить многие характерные реакции карбонилсодержащих соединений. Свободная пара электронов на атоме кислорода обусловливает электрофильную атаку; углерод карбонильной группы из-за частичного положительного заряда является местом атаки нуклеофильных частиц; индуктивный сдвиг электронов вдоль связей между углеродным атомом и соседними группами объясняет некоторые особые свойства групп, расположенных по соседству с карбонильной функцией, например, подвижность атомов водорода при α-углеродном атоме.
Классификация.
1) По характеру углеводородного радикала альдегиды и кетоны делятся на:
алифатические и алициклические (карбоциклические, ароматические, гетероциклические):
(алифатический кетон) (ароматический альдегид)
По наличию или отсутствию кратных связей в радикале бывают предельные и непредельные альдегиды и кетоны, например:
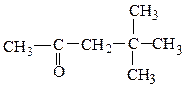
метилнеопентилкетон этилаллилуксусный альдегид этилаллилкетон
(предельный кетон) (непредельный альдегид) (непредельный кетон)
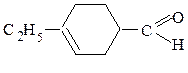
(непредельный циклический альдегид) (непредельный циклический кетон)
2) По количеству карбонильных групп: монокарбонильные, дикарбониль-
α-бромизовалериановый альдегид ацетонилацетон (гександион-2,5)
(монокарбонильное соединение) (дикарбонильное соединение)
Номенклатура.
Рациональная номенклатура.Основой названия альдегидов могут быть уксусный альдегид или какой-либо другой альдегид, более простого строения.В качестве основы рационального названия кетонов используется указание класса соединения, а радикалы, связанные с карбонилом, перечисляются по старшинству.
Номенклатура IUPAC. В систематической номенклатуре наличие альдегидной группы в молекуле обозначается суффиксом «-аль», а кетонной суффиксом «-он» добавляемым к названию углеводорода, соответствующему длине главной углеродной цепи. Если карбонильная группа в полифункциональном соединении не является главной, то независимо от ее природы ее обозначают приставкой «оксо-», причем альдегидная группа считается старше кетонной. (Если С-атом альдегидной группы не входит в главную цепь – «формил-» или «-карбальдегид»).
g-оксимасляный альдегид (рац.) трихлоруксусный альдегид (рац.)
4-гидроксибутаналь (IUPAC) 2,2,2-трихлорэтаналь (IUPAC)
дитретбутилкетон (рац.) винилнеопентилкетон (рац.)
2,2,4,4-тетраметилпентанон-3 (IUPAC) 5,5-диметилгексен-1-он-3 (IUPAC)
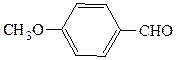
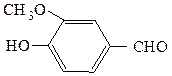
аллилбензилкетон (рац.) 3-метокси-4-гидроксибензальдегид (IUPAC)
Довольно часто используются названия альдегидов, образованные от названий соответствующих карбоновых кислот (валериановый альдегид, кротоновый альдегид) и тривиальные названия оксосоединений – ацетон, ацетофенон, бензофенон и др.
Способы получения.
1. Озонолиз алкенов.В зависимости от степени замещенности атомов углерода при двойной связи могут образовываться альдегиды или кетоны.
Использование алкенов симметричного строения позволяет получать один продукт:
2. Кучерова реакция — гидратация ацетилена в присутствии HgSO4, приводит к уксусному альдегиду, остальных алкинов – к кетонам.
3. Фриделя–Крафтса реакция — ацилирование аренов действием галоидангидридов или ангидридов карбоновых кислот в присутствии кислот Льюиса дает жирноароматические кетоны.
Для получения ароматических альдегидов используют разнообразные методы формилирования, которые с успехом могут быть применены лишь для активированных ароматических систем, поскольку в процессе протекания этих реакций образуются недостаточно активные электрофильные частицы, например:
а) формилирование по Вильсмейеру – N-метилформамидом в присутствии POCl3:
б) реакция Гаттермана – формилирование фенолов с помощью НCN и HCl в присутствии кислот Льюиса (обычно ZnCl2 или AlCl3).
в) формилирование по Гаттерману–Коху — получение ароматических альдегидов обработкой аренов оксидом углерода (II) и HCl в присутствии катализатора.
ЭТИЛЕНОКСИ́Д
В книжной версии
Том 35. Москва, 2017, стр. 488
Скопировать библиографическую ссылку:
ЭТИЛЕНОКСИ́Д (оксиран, 1,2-эпоксиэтан), простейший представитель эпоксидов :
Оксид этилена: структура, свойства, риски и применение
Оксид этилена: структура, свойства, риски и применение — Наука
Содержание:
В окись этилена Это органическое соединение семейства эпоксидов. При комнатной температуре он газообразный, бесцветный и, хотя он почти не имеет запаха, имеет легкий сладкий запах, похожий на запах эфиров.
Это очень универсальный химический строительный блок, поскольку он используется в широком спектре промышленных приложений для производства других химических соединений с множеством применений. Это связано с его высокой реакционной способностью, то есть с легкостью реагирования с другими веществами.
Одно из основных его применений — это сырье при производстве компонентов антифриза для автомобильных радиаторов. Его производные используются в качестве ингредиентов в промышленных или бытовых чистящих средствах, косметических продуктах и шампунях, пластификаторах, фармацевтических препаратах или мазях.
Это широко используемое дезинфицирующее средство, например, при стерилизации медицинского и стоматологического оборудования, поскольку оно способно уничтожать вирусы, бактерии, грибки и споры, особенно в сухих условиях. Кроме того, его использовали для фумигации пищевых продуктов для упаковки, хотя такое использование вызывает сомнения.
Несмотря на его полезность, с ним нужно обращаться с особой осторожностью, так как он может вызвать раздражение глаз и кожи. Вдыхание оксида этилена в течение длительного времени может повлиять на нервную систему. Поэтому лица, подвергающиеся воздействию его паров или растворов, должны носить защитную одежду и оборудование.
Состав
Его молекулярная формула C2ЧАС4О. Он принадлежит к группе эпоксидов, являясь наиболее простыми и важными из них. Он имеет форму трехчленного кольца.
Из-за своей треугольной кольцевой структуры оксид этилена очень реакционноспособен, что связано с легкостью, с которой кольцо открывается. В среднем валентные углы составляют 60º, что ослабляет ваши связи. Молекула менее стабильна, чем у линейного эфира, и имеет тенденцию легко реагировать с другими химическими соединениями.
Свойства
Другие имена
Физическое состояние
При комнатной температуре и атмосферном давлении это газ. При температуре ниже 10,6 ºC и при атмосферном давлении это жидкость. Ниже -111 ° C он твердый.
Молекулярный вес
Точка возгорания
Менее 0ºF (-17,8ºC).
Плотность
Его плотность ниже, чем у воды, 0,882 при 10 ºC. В свою очередь, его пары тяжелее воздуха.
Растворимость
Он растворим в воде, бензоле, ацетоне, этаноле и эфире. Смешивается с четыреххлористым углеродом.
температура самовоспламенения
Другие свойства
— Если он подвергается нагреванию или загрязнению, он может экзотермически полимеризоваться (выделяя большое количество тепла). Если внутри контейнера происходит полимеризация, он может сильно разорваться.
— Может реагировать с окислителями.
— Он чрезвычайно токсичен, канцероген и является хорошим генератором мутаций в клетках бактерий и млекопитающих.
Производство
В промышленных масштабах его получают окислением этилена кислородом (O2) с воздуха. Скорость этой реакции увеличивается в присутствии металлического серебра (Ag) и воздействия температуры. Реакция показана ниже:
Риски
На здоровье
— Сообщалось, что он вызывает неврологические расстройства и может привести к смерти. Самая низкая концентрация, которая может вызвать токсические эффекты при вдыхании, составляет 12 500 ppm / 10 секунд (ppm означает: части на миллион).
— Сильно раздражает кожу, глаза и дыхательные пути.
— Воздействие паров окиси этилена высокой концентрации может вызвать раздражение глаз, воспаление глазной оболочки и повреждение роговицы.
— Развитие катаракты связано с воздействием ее паров и брызг. Концентрированные растворы вызывают сильное поражение глаз.
— Контакт водных растворов окиси этилена с кожей вызывает раздражение и может привести к тяжелому дерматиту с волдырями и ожогами.
— Его вдыхание может повлиять на нервную систему, вызывая, среди прочего, головные боли и тошноту.
Огонь
— При воздействии пламени или тепла существует опасность взрыва. При нагревании образуются опасные пары.
— Пар образует с воздухом взрывоопасные смеси в широком диапазоне концентраций.
— Избегайте работы с оборудованием, которое содержит металлы, такие как медь, серебро, ртуть, магний, алюминий или оксиды железа, а также избегайте таких агентов, как аммиак, окислители, органические кислоты или основания и другие. Все эти материалы могут ускорять полимеризацию и / или взрыв.
Приложения
Промышленное применение
Он используется в качестве промежуточного звена в производстве других химикатов, которые, в свою очередь, используются при производстве полиэфирных волокон для одежды, обивки, ковров и подушек.
Оксид этилена производит этиленгликоль, который используется в антифризах автомобильных двигателей. Этиленгликоль также используется в производстве стекловолоконных и пластиковых упаковочных пленок.
Другие химические вещества, производимые из окиси этилена, включают неионные поверхностно-активные вещества, используемые в моющих средствах и рецептурах посуды.
Медицинские приложения
Он используется в качестве стерилизующего агента для медицинского оборудования, такого как хирургические инструменты, иглы и инъекторы для подкожных инъекций или протезы.
Он также используется для стерилизации гемодиализных аппаратов, лабораторного оборудования, стоматологических инструментов, ветеринарных инструментов, термометров, хирургической одежды или оборудования для оказания первой помощи, среди прочего.
Несмотря на то, что существуют различные методы стерилизации медицинского оборудования, в некоторых случаях использование оксида этилена не может быть заменено никакими средствами.
Это касается стерилизации некоторых материалов, чувствительных к теплу и излучению, а также некоторых инструментов и устройств, требующих стерилизации на месте использования в больницах.
Библиотеки и музеи
В этих местах оксид этилена используется для борьбы с вредителями, такими как грибы и насекомые. Однако это использование не так распространено и используется, когда другие альтернативы не эффективны.
Сельское хозяйство и пищевая промышленность
Он использовался как пестицид, фунгицид, фумигант, гербицид, инсектицид, родентицид и другие варианты. Значительно снижает популяцию бактерий и грибков в специях.
Однако из соображений безопасности и защиты окружающей среды использование окиси этилена для фумигации пищевых продуктов было запрещено в Европейском Союзе и в Соединенных Штатах.
http://bigenc.ru/chemistry/text/4916823
http://ru1.warbletoncouncil.org/oxido-de-etileno-14042