Этанол: химические свойства и получение
Этанол C2H5OH или CH3CH2OH, этиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Строение этанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этанол – жидкость с относительно высокой температурой кипения (температура кипения этанола +78 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Этанол смешивается с водой в любых соотношениях.
Изомерия спиртов
Структурная изомерия
Для этанола характерна структурная изомерия – межклассовая изомерия.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Химические свойства этанола
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
В качестве катализатора этой реакции также используют оксид алюминия.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир: |
4. Окисление этанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении первичных спиртов они последовательно превращаются сначала в альдегиды, а потом в карбоновые кислоты. Глубина окисления зависит от окислителя. Первичный спирт → альдегид → карбоновая кислота |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания этанола: |
5. Дегидрирование этанола
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этанола образуется этаналь |
Получение этанола
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорэтана с водным раствором гидроксида натрия образуется этанол |
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
4. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
Т 1: Реакция серебряного зеркала
Практическая работа № 4
Спирты
Т 1: Растворимость спиртов в воде
Приборы и материалы:пробирки химические,этиловый спирт 
вода
Ход работы:
1. В определённые пробирки наливаем 1-2 мл/г этилового спирта, во вторую пробирку наливаем другого спирта.
2. К ним добавляем 2-3 мл/г воды и взбалтываем.
3. Отмечаем, что этиловый спирт полностью растворился в воде, а изоамиловый спирт отделяется при отстаивании в виде масляного слоя над водой.
Вопросы:
1. В чём причина различного «поведения» спиртов в воде?
2. Почему изоамиловый спирт отслаивается над водой?
3. Какие органические жидкие вещества при смешивании с водой будут отслаиваться над водой?
Ответы на вопросы:
1. Причина различного «поведения» спиртов в воде зависит от особенности химической природы спиртов, прежде всего проявляется в строении молекул.
2. Причина в том, что при увеличении числа метиловых групп реакции окисления замедляются.
3. Бутиловый спирт, изоамиловый спирт, пропиловый спирт, цетиловый спирт, амиловый спирт, пропаргиловый спирт.
Т 2: Получение глицерата меди
Приборы и материалы:пробирки химические, 10% раствор сульфата меди


глицирин
Ход работы:
1. В пробирку наливаем около 1 мл/г 10% раствора судьфата меди, сюда же добавляем 1 мл/г 10% раствора гидроксида натрия до образования голубого осадка гидроксида меди.
2. К полученному осадку добавили по каплям глицерин, взболтали смесь.
3. Отмечаем превращение голубуго осадка в растворе тёмно-синего цвета.
Вопросы:
1. Какая реакция лежит в основе получения гидроксида меди? Напишите уравнение реакции.
2. Почему при добавлении глицерина к осадку гидроксида меди осадок растворяется? С чем связано интенсивное окрашивание раствора? Напишите уравнение взаимодействия глицерина с гидроксидом меди.
3. Будут ли этиловый и изоамиловый спирты реагировать с гидроксидом меди?
Ответы на вопросы:
1.
2. Глицерин как многоатомный спирт образовывает растворимые в воде ярко-синие комплексные соединения при взаимодействии со свеже-полученным осадком 

| 


3. Нет, не будут, потому что свеже-осаждённый гидроксид меди реагирует только с многоатомными спиртами.
Т 3: Окисление этилового спирта дихроматом калия
Приборы и материалы:пробирка химическая, 5% раствор дихромата
калия, 20% раствор серной кислоты, спиртовая
Ход работы:
1. В пробирке смешиваем 2 мл/г 5% раствора дихромата калия, 1 мл/г 20% раствора серной кислоты, 0,5% мл/г этилового спирта.
2. Отмечаем цвет раствора.
3. Осторожно нагреваем смесь на пламени спиртовой горелки до начала изменения цвета, при этом ощущается запах уксусного альдегида, образовавшийся в результате реакции.
Вопросы:
1. Почему цвет раствора меняется с оранжевого до синевато-зелёного? Напишите уравнение окисления этилового спирта.
2. Можно ли заменить серную кислоту в данной реакции на соляную?
Ответы на вопросы:
1.
2. Да, я считаю, что можно заменить серную кислоту на соляную.
Практическая работа № 5
Альдегиды и Кетоны
Т 1: Реакция серебряного зеркала
Приборы и материалы:пробирка химическая ПХ-16, формалин
(формальдегид), аммиачный раствор оксида
серебра, спиртовая горелка
Ход работы:
1. В пробирку с 1 мл/г формальна добавляем несколько капель аммиачного раствора оксида серебра.
2. Пробирку слегка нагреваем, выделяющееся серебро выпадает или в виде чёрного осадка или в виде блестящего зеркального налёта.
3. Завершаем опыт.
Вопросы:
1. Что наблюдается в пробирке?
2. Почему поверхность стекла становится зеркальной?
Ответы на вопросы:
1. Наблюдается выделение газа и образование «зеркала».
2. Потому что на ней оседает металлическое серебро.
Спирты
О чем эта статья:
Спирты — это большая группа химических соединений, производные углеводородов, у которых один или несколько атомов водорода замещены на гидроксильную группу ОН − .
Гидроксильная группа является функциональной группой спиртов.
Классификация спиртов
Спирты классифицируют по различным признакам: по количеству гидроксильных групп; по типу атома углерода, с которым связана гидроксогруппа; а также по строению углеводородного радикала.
По количеству гидроксогрупп
По этому признаку выделяют одноатомные и многоатомные спирты.
У одноатомных спиртов одна группа ОН−. Пример — этиловый спирт (этанол):
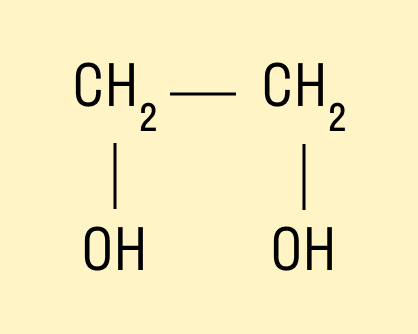
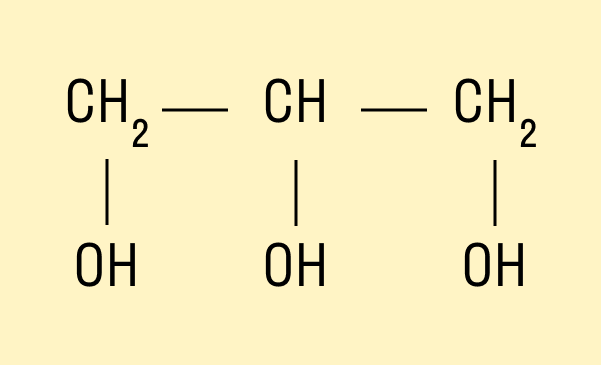
У многоатомных — несколько групп ОН − .
Например, предельный двухатомный спирт этиленгликоль (этандиол):
Трехатомный спирт глицерин:
Современное название многоатомных спиртов — полиолы (диолы, триолы и т. д.).
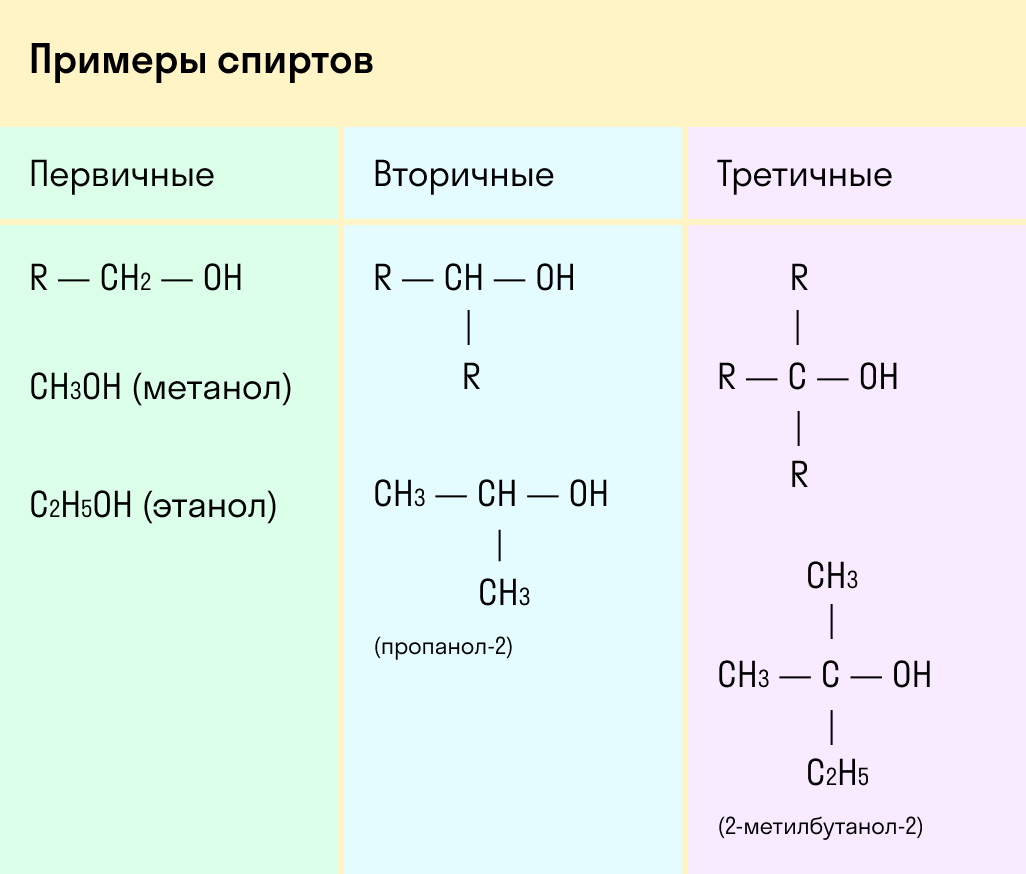
По типу атома углерода, с которым связана гидроксогруппа
Выделяют первичные, вторичные и третичные спирты. Показали примеры каждого вида спиртов в таблице.
По строению углеводородного радикала
По строению углеводородного радикала спирты бывают:
Номенклатура спиртов
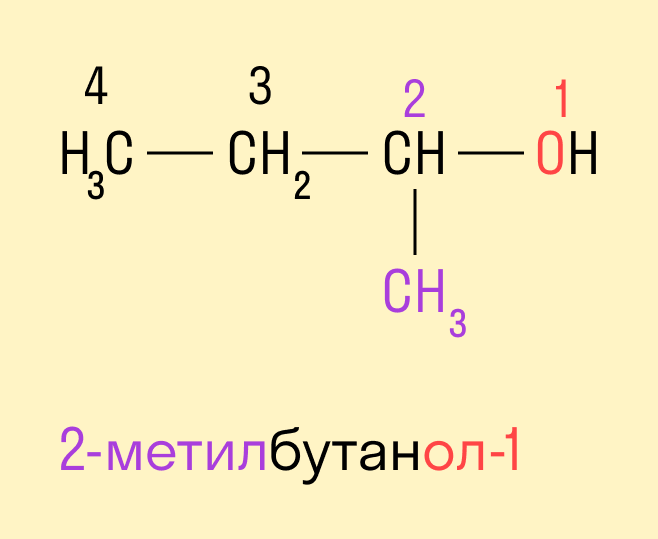
По систематической номенклатуре ИЮПАК (IUPAC)
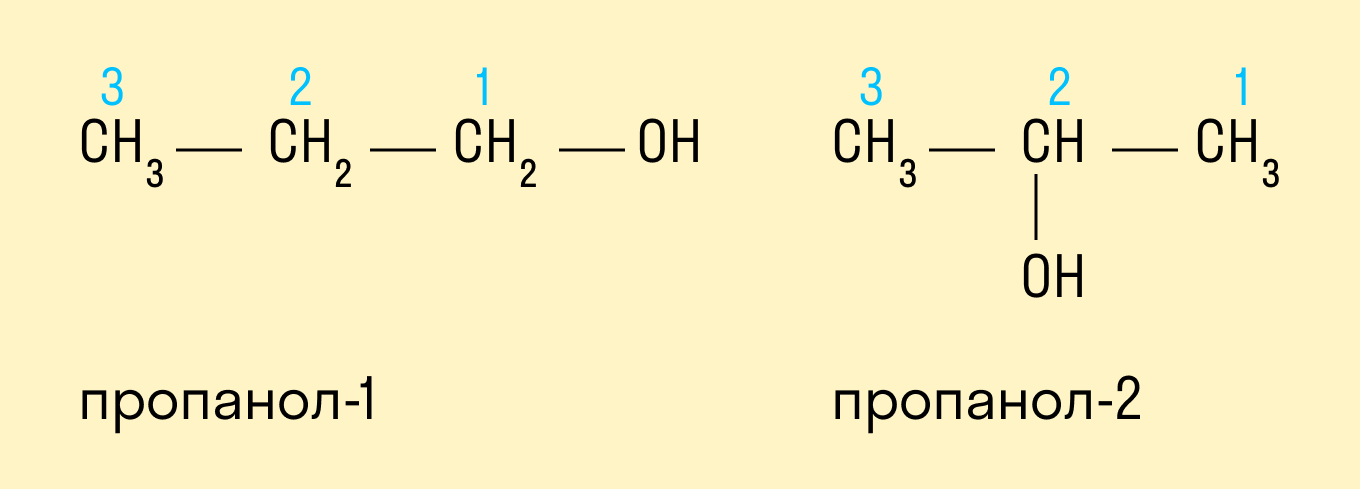
Спиртам дают название по названию углеводорода с добавлением суффикса -ол и цифры, которая показывает положение гидроксильной группы. Для того, чтобы правильно определить, с каким по счету атомом углерода соединена гидроксильная группа, необходимо учитывать следующие правила:
Выбрать самую длинную углеводородную цепь, в состав которой входит гидроксильная группа. Таким образом устанавливают число атомов углерода и соответственно формируют название.
Нумерацию длинной цепи осуществляют с того края, к которому ближе расположена гидроксильная группа.
Местоположение гидроксогруппы в названии определяют написанием цифры после суффикса -ол.
Если в составе спирта присутствуют другие функциональные группы, то нумерация углеродного скелета начинается с того края, где расположена старшая функциональная группа. В таком случае перед названием указывают цифрой, от какого атома углерода идет ответвление.
Радикально-функциональная номенклатура
По такому способу название спирта формируется от названия радикала с добавлением слова «спирт». Например:
СH3—OH — метанол или метиловый спирт;
C2H5OH — этанол или этиловый спирт;
Тривиальная номенклатура
Тривиальные названия были даны спиртам по источнику природного получения. Например, метанол называют древесным спиртом, а этанол — винным спиртом. Показали некоторые тривиальные названия спиртов в таблице:
http://poisk-ru.ru/s48199t9.html
http://skysmart.ru/articles/chemistry/spirty