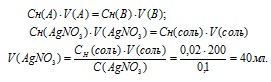Вычисления при обменных реакциях комплексных соединений. Заряды комплексных ионов
Задача 719.
Эмпирическая формула соли CrCl3 . 5H2O. Исходя из того, что координационное число хрома равно б, вычислить, какой объем 0,1 н. раствора AgNO3 понадобится для осаждения внешнесферно связанного хлора, содержащегося в 200 мл 0,01 М раствора комплексной соли; считать, что вся вода, входящая в состав соли, связана внутрисферно.
Решение:
Так как пять молекул воды, входящие в состав соли, связаны внутрисферно, и координационное число центрального атома хрома равно 6, то координационная формула соли будет иметь вид: [Cr(H2O)5Cl]Cl2. Во внешней сфере соли будет находиться два хлорид-иона, т.е. СЭ(Cl) = 2CM = 0,01 . 2 = 0,02н.
Для расчета объёма раствора AgNO3 используем математическое выражение следствия из закона эквивалентов (так называемое правило пропорциональности):
CH(A) . V(A) = CH(B) . V(B)
где Сн(A) и Cн(В) – молярные концентрации эквивалентов веществ А и В, моль; V(A) и V(B) – объёмы растворов веществ А и В.
Подставив данные задачи, вычислим объём раствора нитрата серебра, получим:
Ответ: 40 мл.
Задача 720.
Написать в молекулярной и ионно-молекулярной форме уравнения обменных реакций, происходящих между:
а) K4[Fe(CN)6] и CuSO4; б) Na3[Co(CN)6] и FeSO4; в) K3[Fe(CN)6] и AgNO3, имея в виду, что образующиеся комплексные соли нерастворимы в воде.
Решение:
а) Молекулярная форма:
После приведения членов в обеих частях равенства, получим:
После приведения членов в обеих частях равенства, получим:
3K + + [Fe(CN)6] 3- + 3Ag + + 3NO3 — = Ag3[Fe(CN)6]↓ + 3K+ + 3NO3-
После приведения членов в обеих частях равенства, получим:
Задача 721.
Найти заряды комплексных частиц и указать среди них катионы, анионы и неэлектролиты: а) [Co(NH3)5Cl];
б) [Cr(NH3)4PO4]; в) [Ag(NH3)2]; г) [Cr(OH)6]; д) [Co(NH3)3(NO2)3]; е) [Cu(H2O)4].
Решение:
а) [Co(NH3)5Cl]. Заряды нона кобальта (III) +3, хрома (III), меди (II) и серебра принимаем равными соответственно +3, +3, +2, и +1; заряд молекулы аммиака и молекулы воды равен нулю, заряды хлорид-, нитрит-, гидроксид- и фосфат-ионов соответственно равны -1, -1, -1 и -3.
Составляем алгебраические суммы зарядов для каждого из указанных соединений, получим:
а) +3 + (-1) = +2 (катион); б) +3 + (-3) = 0 (неэлектролит); в) +1 = +1 (катион); г) +3+ 6(-1) = -3 (анион); +3 + 3(-1) = 0 (неэлектролит); е) +2 = +2 (катион).
Задача 722.
Определить степень окисленности комплексообразователя в следующих комплексных ионах: а) [Fe(CN)6] 4- , б) [Ni(NH3)5Cl] + , в) [Co(NH3)2(NO2)4] — , г) [Co(H2O)4Br2] + , д) [AuCl4] — , е) [Hg(CN)4] 2- , ж) [Cd(CN)4] 2- .
Решение:
а) Определение степени окисленности комплексообразователя в [Fe(CN)6] 4– .
Определяем степень окисленности железа, учитывая, что сумма зарядов частиц равна -4. Заряд CN равен -1. Тогда получим: х + 6(-1) = -4; х = -4 + 6; х = +2.
б) Определение степени окисленности комплексообразователя в [Ni(NH 3 ) 5 Cl] +
Определяем степень окисленности никеля, учитывая, что сумма зарядов частиц равна +1. Заряд NH3 равен 0, а Cl равен -1.
Тогда получим: х + 5(0) + (-1) = +1; х = +1 + 1; х = +2.
в) Определение степени окисленности комплексообразователя в [Co(NH 3 ) 2 (NO 2 ) 4 ] —
Заряд Со равен (х), NH3 – (0), NO2 – (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд кобальта: х + 4(-1) + 2(0) = -1; х = +3. Степень окисленности равна +3.
г) Определение степени окисленности комплексообразователя в [Co(H 2 O) 4 Br 2 ] +
Заряд Сr равен (х), H2O – (0), Br – (-1). Отсюда, учитывая, что сумма зарядов частиц равна (+1), найдём заряд хрома: х + 4(0) + 2(-1) = +1; х = +3. Степень окисленности равна +3.
д) Определение степени окисленности комплексообразователя в [AuCl 4 ] — . Заряд Au равен (х), Cl — (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд золота: х + 4(-1) = -1; х = +3. Степень окисленности равна +3.
е) Определение степени окисленности комплексообразователя в [Hg(CN) 4 ] 2-
Заряд Hg равен (х), CN — (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд ртути: х + 4(-1) = -2; х = +2. Степень окисленности ртути равна +2.
ж)Определение степени окисленности комплексообразователя в [Cd(CN) 4 ] 2-
Заряд Сd равен (х), CN — (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд кадмия: х + 4(-1) = -2; х = +2. Степень окисленности кадмия равна +2.
Как составлять ионные уравнения. Задача 31 на ЕГЭ по химии
Достаточно часто школьникам и студентам приходится составлять т. н. ионные уравнения реакций. В частности, именно этой теме посвящена задача 31, предлагаемая на ЕГЭ по химии. В данной статье мы подробно обсудим алгоритм написания кратких и полных ионных уравнений, разберем много примеров разного уровня сложности.
Зачем нужны ионные уравнения
Напомню, что при растворении многих веществ в воде (и не только в воде!) происходит процесс диссоциации — вещества распадаются на ионы. Например, молекулы HCl в водной среде диссоциируют на катионы водорода (H + , точнее, H 3 O + ) и анионы хлора (Cl — ). Бромид натрия (NaBr) находится в водном растворе не в виде молекул, а в виде гидратированных ионов Na + и Br — (кстати, в твердом бромиде натрия тоже присутствуют ионы).
Записывая «обычные» (молекулярные) уравнения, мы не учитываем, что в реакцию вступают не молекулы, а ионы. Вот, например, как выглядит уравнение реакции между соляной кислотой и гидроксидом натрия:
HCl + NaOH = NaCl + H 2 O. (1)
Разумеется, эта схема не совсем верно описывает процесс. Как мы уже сказали, в водном растворе практически нет молекул HCl, а есть ионы H + и Cl — . Так же обстоят дела и с NaOH. Правильнее было бы записать следующее:
H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O. (2)
Это и есть полное ионное уравнение . Вместо «виртуальных» молекул мы видим частицы, которые реально присутствуют в растворе (катионы и анионы). Не будем пока останавливаться на вопросе, почему H 2 O мы записали в молекулярной форме. Чуть позже это будет объяснено. Как видите, нет ничего сложного: мы заменили молекулы ионами, которые образуются при их диссоциации.
Впрочем, даже полное ионное уравнение не является безупречным. Действительно, присмотритесь повнимательнее: и в левой, и в правой частях уравнения (2) присутствуют одинаковые частицы — катионы Na + и анионы Cl — . В процессе реакции эти ионы не изменяются. Зачем тогда они вообще нужны? Уберем их и получим краткое ионное уравнение:
H + + OH — = H 2 O. (3)
Как видите, все сводится к взаимодействию ионов H + и OH — c образованием воды (реакция нейтрализации).
Все, полное и краткое ионные уравнения записаны. Если бы мы решали задачу 31 на ЕГЭ по химии, то получили бы за нее максимальную оценку — 2 балла.
Итак, еще раз о терминологии:
- HCl + NaOH = NaCl + H 2 O — молекулярное уравнение («обычное» уравнения, схематично отражающее суть реакции);
- H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O — полное ионное уравнение (видны реальные частицы, находящиеся в растворе);
- H + + OH — = H 2 O — краткое ионное уравнение (мы убрали весь «мусор» — частицы, которые не участвуют в процессе).
Алгоритм написания ионных уравнений
- Составляем молекулярное уравнение реакции.
- Все частицы, диссоциирующие в растворе в ощутимой степени, записываем в виде ионов; вещества, не склонные к диссоциации, оставляем «в виде молекул».
- Убираем из двух частей уравнения т. н. ионы-наблюдатели, т. е. частицы, которые не участвуют в процессе.
- Проверяем коэффициенты и получаем окончательный ответ — краткое ионное уравнение.
Пример 1 . Составьте полное и краткое ионные уравнения, описывающие взаимодействие водных растворов хлорида бария и сульфата натрия.
Решение . Будем действовать в соответствии с предложенным алгоритмом. Составим сначала молекулярное уравнение. Хлорид бария и сульфат натрия — это две соли. Заглянем в раздел справочника «Свойства неорганических соединений». Видим, что соли могут взаимодействовать друг с другом, если в ходе реакции образуется осадок. Проверим:
BaCl 2 + Na 2 SO 4 = BaSO 4 ↓ + 2NaCl.
Таблица растворимости подсказывает нам, что BaSO 4 действительно не растворяется в воде (направленная вниз стрелка, напомню, символизирует, что данное вещество выпадает в осадок). Молекулярное уравнение готово, переходим к составлению полного ионного уравнения. Обе соли, присутствующие в левой части, записываем в ионной форме, а вот в правой части оставляем BaSO 4 в «молекулярной форме» (о причинах этого — чуть позже!) Получаем следующее:
Ba 2+ + 2Cl — + 2Na + + SO 4 2- = BaSO 4 ↓ + 2Cl — + 2Na + .
Осталось избавиться от балласта: убираем ионы-наблюдатели. В данном случае в процессе не участвуют катионы Na + и анионы Cl — . Стираем их и получаем краткое ионное уравнение:
Ba 2+ + SO 4 2- = BaSO 4 ↓.
А теперь поговорим подробнее о каждом шаге нашего алгоритма и разберем еще несколько примеров.
Как составить молекулярное уравнение реакции
Должен сразу вас разочаровать. В этом пункте не будет однозначных рецептов. Действительно, вряд ли можно рассчитывать, что я смогу разобрать здесь ВСЕ возможные уравнения реакций, которые могут встретиться вам на ЕГЭ или ОГЭ по химии.
Ваш помощник — раздел «Свойства неорганических соединений». Если вы хорошо знакомы с четырьмя базовыми классами неорганических веществ (оксиды, основания, кислоты, соли), если вам известны химические свойства этих классов и методы их получения, можете на 95% быть уверены в том, что у вас не будет проблем на экзамене с написанием молекулярных уравнений.
Оставшиеся 5% — это некоторые «специфические» реакции, которые мы не сможем перечислить. Не будем лить слез по поводу этих 5%, а вспомним лучше номенклатуру и химические свойства базовых классов неорганических веществ. Три задания для самостоятельной работы:
Упражнение 1 . Напишите молекулярные формулы следующих веществ: оксид фосфора (V), нитрат цезия, сульфат хрома (III), бромоводородная кислота, карбонат аммония, гидроксид свинца (II), фосфат стронция, кремниевая кислота. Если при выполнении задания у вас возникнут проблемы, обратитесь к разделу справочника «Названия кислот и солей».
Упражнение 2 . Дополните уравнения следующих реакций:
- KOH + H 2 SO 4 =
- H 3 PO 4 + Na 2 O=
- Ba(OH) 2 + CO 2 =
- NaOH + CuBr 2 =
- K 2 S + Hg(NO 3 ) 2 =
- Zn + FeCl 2 =
Упражнение 3 . Напишите молекулярные уравнения реакций (в водном растворе) между: а) карбонатом натрия и азотной кислотой, б) хлоридом никеля (II) и гидроксидом натрия, в) ортофосфорной кислотой и гидроксидом кальция, г) нитратом серебра и хлоридом калия, д) оксидом фосфора (V) и гидроксидом калия.
Искренне надеюсь, что у вас не возникло проблем с выполнением этих трех заданий. Если это не так, необходимо вернуться к теме «Химические свойства основных классов неорганических соединений».
Как превратить молекулярное уравнение в полное ионное уравнение
Начинается самое интересное. Мы должны понять, какие вещества следует записывать в виде ионов, а какие — оставить в «молекулярной форме». Придется запомнить следующее.
В виде ионов записывают:
- растворимые соли (подчеркиваю, только соли хорошо растворимые в воде);
- щелочи (напомню, что щелочами называют растворимые в воде основания, но не NH 4 OH);
- сильные кислоты (H 2 SO 4 , HNO 3 , HCl, HBr, HI, HClO 4 , HClO 3 , H 2 SeO 4 , . ).
Как видите, запомнить этот список совсем несложно: в него входят сильные кислоты и основания и все растворимые соли. Кстати, особо бдительным юным химикам, которых может возмутить тот факт, что сильные электролиты (нерастворимые соли) не вошли в этот перечень, могу сообщить следующее: НЕвключение нерастворимых солей в данный список вовсе не отвергает того, что они являются сильными электролитами.
Все остальные вещества должны присутствовать в ионных уравнениях в виде молекул. Тем требовательным читателям, которых не устраивает расплывчатый термин «все остальные вещества», и которые, следуя примеру героя известного фильма, требуют «огласить полный список» даю следующую информацию.
В виде молекул записывают:
- все нерастворимые соли;
- все слабые основания (включая нерастворимые гидроксиды, NH 4 OH и сходные с ним вещества);
- все слабые кислоты (H 2 СO 3 , HNO 2 , H 2 S, H 2 SiO 3 , HCN, HClO, практически все органические кислоты . );
- вообще, все слабые электролиты (включая воду. );
- оксиды (всех типов);
- все газообразные соединения (в частности, H 2 , CO 2 , SO 2 , H 2 S, CO);
- простые вещества (металлы и неметаллы);
- практически все органические соединения (исключение — растворимые в воде соли органических кислот).
Уф-ф, кажется, я ничего не забыл! Хотя проще, по-моему, все же запомнить список N 1. Из принципиально важного в списке N 2 еще раз отмечу воду.
Пример 2 . Составьте полное ионное уравнение, описывающие взаимодействие гидроксида меди (II) и соляной кислоты.
Решение . Начнем, естественно, с молекулярного уравнения. Гидроксид меди (II) — нерастворимое основание. Все нерастворимые основания реагируют с сильными кислотами с образованием соли и воды:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O.
А теперь выясняем, какие вещества записывать в виде ионов, а какие — в виде молекул. Нам помогут приведенные выше списки. Гидроксид меди (II) — нерастворимое основание (см. таблицу растворимости), слабый электролит. Нерастворимые основания записывают в молекулярной форме. HCl — сильная кислота, в растворе практически полностью диссоциирует на ионы. CuCl 2 — растворимая соль. Записываем в ионной форме. Вода — только в виде молекул! Получаем полное ионное уравнение:
Сu(OH) 2 + 2H + + 2Cl — = Cu 2+ + 2Cl — + 2H 2 O.
Пример 3 . Составьте полное ионное уравнение реакции диоксида углерода с водным раствором NaOH.
Решение . Диоксид углерода — типичный кислотный оксид, NaOH — щелочь. При взаимодействии кислотных оксидов с водными растворами щелочей образуются соль и вода. Составляем молекулярное уравнение реакции (не забывайте, кстати, о коэффициентах):
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O.
CO 2 — оксид, газообразное соединение; сохраняем молекулярную форму. NaOH — сильное основание (щелочь); записываем в виде ионов. Na 2 CO 3 — растворимая соль; пишем в виде ионов. Вода — слабый электролит, практически не диссоциирует; оставляем в молекулярной форме. Получаем следующее:
СO 2 + 2Na + + 2OH — = Na 2+ + CO 3 2- + H 2 O.
Пример 4 . Сульфид натрия в водном растворе реагирует с хлоридом цинка с образованием осадка. Составьте полное ионное уравнение данной реакции.
Решение . Сульфид натрия и хлорид цинка — это соли. При взаимодействии этих солей выпадает осадок сульфида цинка:
Na 2 S + ZnCl 2 = ZnS↓ + 2NaCl.
Я сразу запишу полное ионное уравнение, а вы самостоятельно проанализируете его:
2Na + + S 2- + Zn 2+ + 2Cl — = ZnS↓ + 2Na + + 2Cl — .
Предлагаю вам несколько заданий для самостоятельной работы и небольшой тест.
Упражнение 4 . Составьте молекулярные и полные ионные уравнения следующих реакций:
- NaOH + HNO 3 =
- H 2 SO 4 + MgO =
- Ca(NO 3 ) 2 + Na 3 PO 4 =
- CoBr 2 + Ca(OH) 2 =
Упражнение 5 . Напишите полные ионные уравнения, описывающие взаимодействие: а) оксида азота (V) с водным раствором гидроксида бария, б) раствора гидроксида цезия с иодоводородной кислотой, в) водных растворов сульфата меди и сульфида калия, г) гидроксида кальция и водного раствора нитрата железа (III).
В следующей части статьи мы научимся составлять краткие ионные уравнения и разберем большое количество примеров. Кроме того, мы обсудим специфические особенности задания 31, которое вам предстоит решать на ЕГЭ по химии.
Химия. Составить уравнения реакции гидролиза NaI(йод), Fe(NO3)2, Na2S
Иодид не гидролизется,нитрат-по катиону,сульфид-по аниону.
1) Fe(NO3)2 + H2O = Fe(OH)NO3 + HNO3
в ионном виде: Fe(2+) + 2NO3(-) + H2O = FeOH(+) + 2NO3(-) + H(+)
гидролиз по катиону, среда кислая
2) Na2S + H2O = NaHS + NaOH
в ионном виде: 2Na(+) + S(2-) + H2O = 2Na(+) = HS(-) + OH(-)
гидролиз по аниону, среда щелочная
3) Иодид натрия не гидролизуется, т. к. образован сильным основанием и сильной кислотой!
http://www.repetitor2000.ru/ionnye_uravnenija_01.html
http://sprashivalka.com/tqa/q/19034373