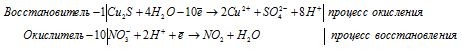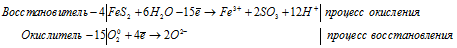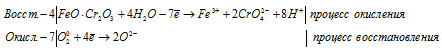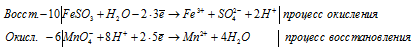По ионным схемам составьте молекулярные уравнения реакций: а) Fe (2+) + S (2-) → FeS↓ б) Fe(OH)3 + . → Fe (3+) + .
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,203
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Составление ионно-молекулярной формы процесса окисления-восстановления с двумя окисляющимися элементами
После приведения членов обеих частей уравнения, получим:
Добавив в обе части равенства соответствующее количество ионов Н+ и NO3-, получим молекулярную форму процесса
4FeS2 + 15O2 0 + 24Н2О = 4Fe 3+ + 8SO3 + 48H + + 30O 2- .
Сорок восемь ионов водорода и двадцать четыре иона кислорода, соединяясь образуют двадцать четыре молекулы воды, получим:
После приведения членов обеих частей уравнения, получим:
Уравнение в молекулярной форме имеет вид:
4FeO . Cr2O3 + 7O2 0 + 16H2O = 4Fe 3+ + 8CrO4 2- + 14H + + 10O 2-
После приведения членов обеих частей уравнения, получим:
Так как в качестве исходного продукта в систему введён карбонат калия, то, подставив его в уравнение, получим:
Для получения полного уравнения после уравнивания калия получим:
4FeO . Cr 2 O 3 + 7O 2 0 + 2H 2 O + 8K 2 CO 3 = 4Fe 3+ + 8K 2 CrO 4 + 4H + + 8CO3 2-
С учётом того, что одним из продуктов реакции является углекислый газ, получим окончательную ионно-молекулярную форму уравнения реакции:
Уравнение в молекулярной форме будет имеет вид:
10FeSO3 + 6MnO4 — + 48H + + 10H2O = 10Fe 3+ + 6Mn 2+ + 10SO4 2- + 20H + + 24H2O
После приведения членов в обеих частях уравнения получим:
10FeSO3 + 6MnO4 — + 28H + = 10Fe 3+ + 6Mn 2+ + 10SO4 2- + 14H2O
Молекулярная форма имеет вид:
В данном процессе восстановитель содержит два окисляющихся элемента. Так FeSO3 содержит атом железа, который увеличивает свою степень окисления от +2 до +3, а атом серы от +4 до +6. При составлении уравнения электронно-ионного баланса число отданных электронов умножаем на 2, для того, чтобы привести к чётному значению числа атомов железа, серы и кислорода в формуле вещества Fe2(SO4)3.
Дисульфид железа (II)
| Дисульфид железа | |
|---|---|
| Систематическое наименование | Дисульфид железа (II), дисульфид(2-) железа (II) |
| Хим. формула | FeS2 |
| Состояние | α-FeS2 светло-жёлтые кристаллы β-FeS2 тёмно-жёлтые кристаллы |
| Молярная масса | 119,98 г/моль |
| Плотность | α — 4,9 β — 5,02 г/см³ |
| Температура | |
| • плавления | 743; 1171 °C |
| Мол. теплоёмк. | 62,32 Дж/(моль·К) |
| Энтальпия | |
| • образования | -163,3 кДж/моль |
| Растворимость | |
| • в воде | 0,00049 г/100 мл |
| Рег. номер CAS | 12068-85-8 и 1309-36-0 |
| PubChem | 123110 |
| Рег. номер EINECS | 235-106-8 |
| SMILES | |
| ChEBI | 86471 |
| ChemSpider | 102635 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Дисульфид железа (II) (дисульфид(2-) железа (II)) — бинарное неорганическое соединение железа и серы с формулой FeS2, светло-жёлтые или тёмно-жёлтые кристаллы, нерастворимые в воде.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
Получение
- В природе распространены минералы марказит — α-FeS2 и пирит — β-FeS2.
- Нагревание порошкообразного железа с серой:
Fe + 2S → T FeS2
- Пропускание сероводорода через суспензию гидроксида железа (III):
2Fe(OH)3 + 3H2S → FeS2 + FeS + 6H2O
Физические свойства
Дисульфид железа (II), α-форма образует светло-жёлтые кристаллы ромбической сингонии, пространственная группа P nnm, параметры ячейки a = 0,4434 нм, b = 0,5420 нм, c = 0,3385 нм, Z = 2.
При температуре 365 °C (по другим данным при 444,5°С) происходит переход в β-форму — тёмно-жёлтые кристаллы кубической сингонии, пространственная группа P a 3 , параметр ячейки a = 0,5418 нм, Z = 4.
Не растворяется в воде, р ПР = 26,27.
http://buzani.ru/zadachi/khimiya-glinka/1218-vosstanovitel-s-dvumya-okislyayushchimisya-elementami-zadacha-636
http://chem.ru/disulfid-zheleza-ii.html