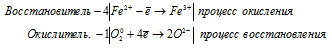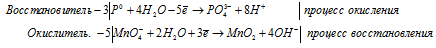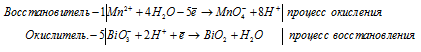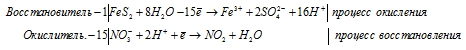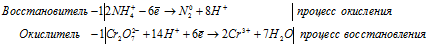Реакция взаимодействия оксида железа (III) и серной кислоты
Реакция взаимодействия оксида железа (III) и серной кислоты
Уравнение реакции взаимодействия оксида железа (III) и серной кислоты:
Реакция взаимодействия оксида железа (III) и серной кислоты.
В результате реакции образуются сульфат железа (III) и вода.
Для проведения реакции используется разбавленный раствор серной кислоты.
Реакция протекает при нормальных условиях.
Формула поиска по сайту: Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O.
Реакция взаимодействия гидроксида натрия, кремния и воды
Реакция взаимодействия серной кислоты и гидроксида калия
Реакция взаимодействия карбоната магния и воды
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Гидролиз сульфата железа (III)
Fe2(SO4)3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая стадия (ступень) гидролиза
Полное ионное уравнение
2Fe 3+ + 3SO4 2- + 2HOH ⇄ 2FeOH 2+ + 2SO4 2- + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
Fe 3+ + HOH ⇄ FeOH 2+ + H +
Вторая стадия (ступень) гидролиза
Полное ионное уравнение
2FeOH 2+ + 2SO4 2- + 2HOH ⇄ 2Fe(OH)2 + + SO4 2- + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
FeOH 2+ + HOH ⇄ Fe(OH)2 + + H +
Третья стадия (ступень) гидролиза
Полное ионное уравнение
2Fe(OH)2 + + SO4 2- + 2HOH ⇄ 2Fe(OH)3 + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
Fe(OH)2 + + HOH ⇄ Fe(OH)3 + H +
Среда и pH раствора сульфата железа (III)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Запись окислительно-восстановительного процесса в молекулярной и ионной форме
4Fe 2+ + O2 0 = 4Fe 3+ + 2O 2- .
б) P + KMnO4 + H2O ⇒ KH2HO4 + K2HO4
Уравнения полуреакций:
3P 0 + 5MnO4 — + 22H2O = 3PO4 3- + 5MnO2 + 20OH — + 24H + .
После приведения членов в обеих частях равенства получим ионно-молекулярную форму:
Молекулярная форма процесса с учётом того, что продуктами являются KH2HO4 и K2HO4:
Подставив коэффициент 2 к K2HO4 чтобы уравнять атомы калия и водорода, получим:
в) Mn(NO3)2 + NaBiO3 + HNO3 ⇒ HMnO4 +
Уравнения полуреакций:
Напишем молекулярную форму реакции с учётом данных задачи, получим:
Добавим в левую часть равенства одну молекулу HNO3 для уравнивания, получим окончательную молекулярную форму процесса:
Mn 2+ + 5NO3 — + 5Na + + 5BiO3 — + 3H + = MnO4 — + H + + 5BiO2 + 5Na + + 5NO3 — + H2O
Mn 2+ + 5BiO 3 — + 3H + = MnO 4 — + H + + 5BiO + H2O.
г) FeS2 + HNO3(конц.) ⇒ H2SO4 +
Уравнения полуреакций:
Приведём члены в обеих частях равенства, получим:
Напишем молекулярную форму реакции с учётом данных задачи, получим:
Для полного уравнивания добавим в левую часть равенства 3 моля HNO3, получим:
Приведём члены в обеих частях равенства, получим:
Для уравнивания водорода отнимем 6 ионов Н + и 3 молекулы Н2О, подставим 3 иона О 2- к 2 ионам Cr 3+ , получим:
Полное ионно-молекулярное уравнение, оно же будет и сокращенным ионным уравнением:
http://chemer.ru/services/hydrolysis/salts/Fe2(SO4)3
http://buzani.ru/zadachi/khimiya-glinka/1220-molekulyarnaya-i-ionnaya-forma-okislitelno-vosstanovitelnogo-protsessa-zadacha-655