Фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация фенолов
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Химические свойства фенолов
| Сходство и отличие фенола и спиртов. |
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |
2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.
Получение фенолов
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем выделяют фенол:
Конденсация фенолов с альдегидами и кетонами
Вы будете перенаправлены на Автор24
Гидроксиметилирование фенолов — процесс конденсации фенолов с альдегидами и кетонами является методом получения фенолформальдегидиих смол (ФФС), или фенопластов, которые широко применяются в виде клеев, лаков, эмалей, компаундов, защитных пленкообразователей или технических изделий типа текстолита, гетинакса, карболита, пресс-порошков, фаолита тому подобных.
Гидроксиметилирование фенола
Реакция гидроксиметилирования фенола или поликонденсация его с альдегидами была открыта А. Байером в 1872 году, а в 1908 А. Бакеланд реализовал ее в промышленности. Легкость протекания этой реакции обусловлена тем, что благодаря сильному активирующему действию $OH$-группы фенолы способны взаимодействовать даже с такими слабыми электрофилами, как альдегиды и кетоны в присутствии кислот или оснований:
Каталитическое действие кислоты заключается в протонировании формальдегида с образованием реакционноспособного электрофила, который замещает атом водорода в о- или п-положении фенола с образованием фенолоспиртов, или метилолфенолов:
Каталитическое действие оснований заключается в образовании фенолят-аниона, нуклеофильные способности которого выше по сравнению с фенолом. Фенолят-анион атакует электрофильный атом углерода формальдегида одним из своих активированных положений:
При избытке формальдегида гидроксиметилирование фенолоспиртов может происходить дальше:
Остановить реакцию на стадии получения моно- или дигидроксиметил- фенолов практически невозможно, и процесс проходит к образованию ФФС.
Такая реакция относится к процессам поликонденсации. При соотношении альдегид: фенол — 6: 7 и комнатной температуре в кислой среде синтезируются новолачные смолы — линейные полимеры (термопласты), которые плавятся при нагревании до 90-130$^\circ$С и растворяются в органических растворителях:
Готовые работы на аналогичную тему
Особенности процесса поликондесации
Поликонденсацией называют процесс образования высокомолекулярных полимерных соединений из исходных низкомолекулярных веществ, который сопровождается выделением какого-либо побочного низкомолекулярного продукта (воды, галоненоводорода, аммиака и т. п.).
Поликонденсация является обратной реакцией. Ход процесса и характер образующихся продуктов реакции, зависят от числа функциональных групп в начальных мономерах, от соотношения начальных компонентов, а также от скорости и полноты удаления низкомолекулярных продуктов реакции. При наличии в каждом из исходных веществ двух функциональных групп в результате реакции поликонденсации образуется линейный полимер. Если же функциональность хотя бы одного из начальных мономеров больше двух, образуется полимер пространственного строения.
Так, взаимодействие фталевого ангидрида и диолов (этиленгликоля, пропиленгликоля) приводит к образованию линейного полиэстера, в то время как взаимодействие фталевого ангидрида и полиолов (глицерина, пентаэритрита, сорбита, маннита и т. д.) приводит к образованию пространственных полиэфиров. В то же время, некоторые вещества (в зависимости от условий реакции) могут проявлять различную функциональность. Так, во время проведения реакции между фталевым ангидридом и глицерином последний при температуре 170-180$^\circ$ С ведет себя как бифункциональное соединение (в реакцию вступают в основном первичные гидроксильные группы), а при 200-220$^\circ$ С — как трифункциональное соединение (в реакцию вступают и менее активные вторичные гидроксильные группы.
Реакции поликонденсации носят ступенчатый характер, поскольку каждый акт взаимодействия функциональных групп приводит к образованию устойчивого соединения — димера, тримера и т. д.
В начале реакции происходит взаимодействие молекул исходных веществ друг с другом и с образовавшимися молекулами димеров, триммеров и олигомеров, а затем, по мере исчерпания исходных веществ, начинают реагировать друг с другом диммеры, триммеры и полимеры. Одновременно с ростом цепи полимера протекает ряд побочных реакций, осложняющих течение процесса: деструктивные реакции и реакции между цепями. Реакция прекращается при исчерпании начальных мономеров и достижении равновесия между полимерным продуктом и низкомолекулярными соединениями, которые выделяются. В результате поликонденсации в зависимости от строения исходных компонентов образуются смолы, воски или вязкие жидкости. Они, например, в случае взаимодействия фталевого ангидрида и диолов (глицерина и полиолов), в зависимости от соотношения компонентов — полиэфиры с концевыми карбоксильными или гидроксильными группами.
Поликонденсация фенолов
В щелочной среде при избытке формальдегида сначала через стадию образования фенолоспиртов синтезируются растворимые резольные смолы (реактопласты, или термореактивные полимеры) с разветвленной линейной строением аналогично предыдущему случаю:
Затем при нагревании резолы дают нерастворимые резиты с трехмерной (сшитой) структурой.
При избытке фенола резолы способны переходить в новолаки, а новолачные смолы в случае избытка формальдегида — в резолы.
Необходимо отметить, что создание ФФС трудно контролируется и происходит сложным путем с получением молекулярно-неоднородной смеси олигомеров с молекулярной массой примерно 500-8000 для новолаков и резолов. Механизм реакции поликонденсации фенолов с альдегидами полностью еще не определен.
Кроме фенола и формальдегида фенол-альдегидные смолы образуют также другие производные фенола и некоторые альдегиды.
Фенол реакция поликонденсации уравнение реакции
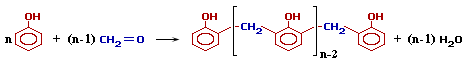
Фенолформальдегидные смолы [-C6H3(OH)-CH2-]n – продукты поликонденсации фенола C6H5OH с формальдегидом CH2=O.
Взаимодействие фенола с формальдегидом идет по схеме:
Роль реакционноспособных функциональных групп в этих соединениях играют:
- в феноле – три С-Н-связи в орто— и пара-положениях (легче идет замещение в двух орто-положениях);
- в формальдегиде – двойная связь С=О, способная к присоединению по атомам С и О.
Это определяет возможность образования цепных макромолекул по схеме поликонденсации:
Реакция проводится в присутствии кислых (соляная, серная, щавелевая и другие кислоты) или щелочных катализаторов (аммиак, гидроксид натрия, гидроксид бария).
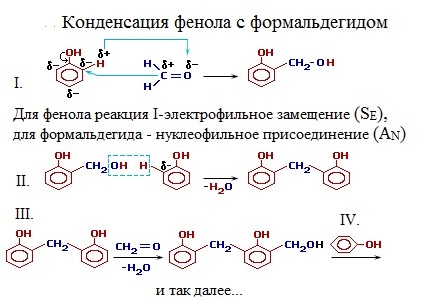
Механизм конденсации фенола с формальдегидом в условиях кислотного катализа
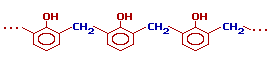
При избытке фенола и кислом катализаторе образуется линейный полимер –новолак, цепь которого содержит приблизительно 10 фенольных остатков, соединенных между собой метиленовыми (-СН2-) мостиками.
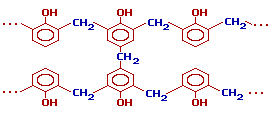
Новолаки – термопластичные полимеры, которые сами по себе не способны переходить в неплавкое и нерастворимое состояние. Но они могут превращаться в трехмерный полимер при нагревании их с дополнительной порцией формальдегида в щелочной среде. При использовании щелочных катализаторов и избытка альдегида в начальной стадии поликонденсации получаются линейные цепи резола:
При дополнительном нагревании эти цепи «сшиваются» между собой за счет групп -CH2OH, находящихся в пара-положении фенольного кольца, с образованием трехмерного полимера – резита:
Таким образом, резолы являются термореактивными полимерами. Фенолоформальдегидные полимеры применяются в виде прессовочных композиций с различными наполнителями, а также в производстве лаков и клея.
Учебный фильм «Фенолоформальдегидные пластмассы»
Учебный фильм «Термоактивные пластмассы»
http://spravochnick.ru/himiya/poluchenie_fenolov/kondensaciya_fenolov_s_aldegidami_i_ketonami/
http://himija-online.ru/organicheskaya-ximiya/fenol/fenolformaldegidnye-smoly.html