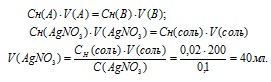HTTP Status 400 – Bad Request
Type Exception Report
Message Invalid character found in the request target [/ru/?s=FeSO4+++K3[Fe(CN)6]+=+Fe4[Fe(CN)6]3+++K2SO4+++KCN ]. The valid characters are defined in RFC 7230 and RFC 3986
Description The server cannot or will not process the request due to something that is perceived to be a client error (e.g., malformed request syntax, invalid request message framing, or deceptive request routing).
Note The full stack trace of the root cause is available in the server logs.
FeSO4 + K3 [Fe(CN)6] = K2SO4 + Fe[Fe(CN)6]↓ Помогите, пожалуйста, Составить ионное уравнение из исходного?
Химия | 5 — 9 классы
FeSO4 + K3 [Fe(CN)6] = K2SO4 + Fe[Fe(CN)6]↓ Помогите, пожалуйста, Составить ионное уравнение из исходного.
FeSO4 + K3 [Fe(CN)6] = K2SO4 + KFe[Fe(CN)6]↓
Fe(2 + ) + SO4(2 — ) + 3K( + ) + [Fe(CN)6( — ) = 2K( + ) + SO4(2 — ) + KFe[Fe(CN)6]↓
Fe(2 + ) K( + ) + [Fe(CN)6( — ) = KFe[Fe(CN)6]↓.
Запишите уравнения реакций в ионной и сокращенно ионной формах :1) FeSO₄ ⇒Fe₂(SO₄)₃2) Fe(OH)₂ ⇒Fe(OH)₃?
Запишите уравнения реакций в ионной и сокращенно ионной формах :
Помогите составить ионное уравнение : Аммиак + вода =?
Помогите составить ионное уравнение : Аммиак + вода =.
Помогите составить полное и сокращенное ионное уравнение?
Помогите составить полное и сокращенное ионное уравнение.
Помогите составить ионное уравнение?
Помогите составить ионное уравнение!
Исходные вещества CuSO4 и KNO3 составить молекулярное, полное ионно — молекулярное и сокращенное ионно — молекулярное уравнения реакций?
Исходные вещества CuSO4 и KNO3 составить молекулярное, полное ионно — молекулярное и сокращенное ионно — молекулярное уравнения реакций.
HCl + K2SO4 составить молекулярное, ионное и сокращенное уравнения?
HCl + K2SO4 составить молекулярное, ионное и сокращенное уравнения.
Помогите пожалуйста?
Из этих ионных уравнения нужно составить полные ионные уравнения.
Составить молекулярные, полные ионные и сокращенные ионные уравнения реакций между хлоридом кальция и нитратом серебра?
Составить молекулярные, полные ионные и сокращенные ионные уравнения реакций между хлоридом кальция и нитратом серебра.
Нужно составить ионное уравнение, помогите пожалуйста 2NaOH + SiO2 = Na2SiO3 + H2O?
Нужно составить ионное уравнение, помогите пожалуйста 2NaOH + SiO2 = Na2SiO3 + H2O.
Составить полное ионное и кратко ионное уравнения реакций и заполнить пропуски, помогите пожалуйста, заранее спасибо))?
Составить полное ионное и кратко ионное уравнения реакций и заполнить пропуски, помогите пожалуйста, заранее спасибо)).
На этой странице вы найдете ответ на вопрос FeSO4 + K3 [Fe(CN)6] = K2SO4 + Fe[Fe(CN)6]↓ Помогите, пожалуйста, Составить ионное уравнение из исходного?. Вопрос соответствует категории Химия и уровню подготовки учащихся 5 — 9 классов классов. Если ответ полностью не удовлетворяет критериям поиска, ниже можно ознакомиться с вариантами ответов других посетителей страницы или обсудить с ними интересующую тему. Здесь также можно воспользоваться «умным поиском», который покажет аналогичные вопросы в этой категории. Если ни один из предложенных ответов не подходит, попробуйте самостоятельно сформулировать вопрос иначе, нажав кнопку вверху страницы.
Первая реакция это окисление первичной гидроксогруппы в альдегид, а так как есть вода, то через промежуточный геминальный диол получаем карбоксильную группу. Обобщенная схема представлена на рисунке 1. Β — кетокислота, как и все β — кетокислоты, не..
Скорей всего был оксид углерода 2, ибо : 1. C + 4Na = Na₄C 2. C + 2H₂ = CH₄ 3. C + CO₂ = 2CO C + CO≠ 4. C + 2H₂SO₄ = 2SO₂ + CO₂ + 2H₂O.
Масса атома — это масса ядра + масса всех электронов. Её можно найти как отношение молярной массы к числу Авогадро. Относительной атомной массой (Аг) называется масса одного атома, выраженная в атомных единицах массы (а. Е. м. ) . Относительная а..
Cr2O3 — хром (III) оксиді.
Чистые в — ва нефть . Руда, алюминий, углекислый газ однород смеси лимонад, морская вода неоднород смеси воздух гранит кровь пыль.
Cu + O = CuO + 155Кдж Наверное так.
CH₄ + 3O₂ = CO₂ + 2H₂O количество вещества углекислого газа n(CO₂) = n(CH₄) = v(CH₄) / v₀ n(CO₂) = 4, 48 / 22, 4 = 0, 2 моль количество вещества гидроксида натрия n(NaOH) = m(NaOH) / M(NaOH) = vpw / M(NaOH) n(NaOH) = 100 * 1, 31 * 0, 28 / 40 = 0, 917..
Держи характеристику калия.
1) 2Cu + 2H2O→2CuOH + H2 2) Re + Pb(NO3)2→Fe(NO3)2 + Pb 3) Zn + S→ZnS 4) 2Al + 6HCl→2AlCl3 + 3H2.
Вычисления при обменных реакциях комплексных соединений. Заряды комплексных ионов
Задача 719.
Эмпирическая формула соли CrCl3 . 5H2O. Исходя из того, что координационное число хрома равно б, вычислить, какой объем 0,1 н. раствора AgNO3 понадобится для осаждения внешнесферно связанного хлора, содержащегося в 200 мл 0,01 М раствора комплексной соли; считать, что вся вода, входящая в состав соли, связана внутрисферно.
Решение:
Так как пять молекул воды, входящие в состав соли, связаны внутрисферно, и координационное число центрального атома хрома равно 6, то координационная формула соли будет иметь вид: [Cr(H2O)5Cl]Cl2. Во внешней сфере соли будет находиться два хлорид-иона, т.е. СЭ(Cl) = 2CM = 0,01 . 2 = 0,02н.
Для расчета объёма раствора AgNO3 используем математическое выражение следствия из закона эквивалентов (так называемое правило пропорциональности):
CH(A) . V(A) = CH(B) . V(B)
где Сн(A) и Cн(В) – молярные концентрации эквивалентов веществ А и В, моль; V(A) и V(B) – объёмы растворов веществ А и В.
Подставив данные задачи, вычислим объём раствора нитрата серебра, получим:
Ответ: 40 мл.
Задача 720.
Написать в молекулярной и ионно-молекулярной форме уравнения обменных реакций, происходящих между:
а) K4[Fe(CN)6] и CuSO4; б) Na3[Co(CN)6] и FeSO4; в) K3[Fe(CN)6] и AgNO3, имея в виду, что образующиеся комплексные соли нерастворимы в воде.
Решение:
а) Молекулярная форма:
После приведения членов в обеих частях равенства, получим:
После приведения членов в обеих частях равенства, получим:
3K + + [Fe(CN)6] 3- + 3Ag + + 3NO3 — = Ag3[Fe(CN)6]↓ + 3K+ + 3NO3-
После приведения членов в обеих частях равенства, получим:
Задача 721.
Найти заряды комплексных частиц и указать среди них катионы, анионы и неэлектролиты: а) [Co(NH3)5Cl];
б) [Cr(NH3)4PO4]; в) [Ag(NH3)2]; г) [Cr(OH)6]; д) [Co(NH3)3(NO2)3]; е) [Cu(H2O)4].
Решение:
а) [Co(NH3)5Cl]. Заряды нона кобальта (III) +3, хрома (III), меди (II) и серебра принимаем равными соответственно +3, +3, +2, и +1; заряд молекулы аммиака и молекулы воды равен нулю, заряды хлорид-, нитрит-, гидроксид- и фосфат-ионов соответственно равны -1, -1, -1 и -3.
Составляем алгебраические суммы зарядов для каждого из указанных соединений, получим:
а) +3 + (-1) = +2 (катион); б) +3 + (-3) = 0 (неэлектролит); в) +1 = +1 (катион); г) +3+ 6(-1) = -3 (анион); +3 + 3(-1) = 0 (неэлектролит); е) +2 = +2 (катион).
Задача 722.
Определить степень окисленности комплексообразователя в следующих комплексных ионах: а) [Fe(CN)6] 4- , б) [Ni(NH3)5Cl] + , в) [Co(NH3)2(NO2)4] — , г) [Co(H2O)4Br2] + , д) [AuCl4] — , е) [Hg(CN)4] 2- , ж) [Cd(CN)4] 2- .
Решение:
а) Определение степени окисленности комплексообразователя в [Fe(CN)6] 4– .
Определяем степень окисленности железа, учитывая, что сумма зарядов частиц равна -4. Заряд CN равен -1. Тогда получим: х + 6(-1) = -4; х = -4 + 6; х = +2.
б) Определение степени окисленности комплексообразователя в [Ni(NH 3 ) 5 Cl] +
Определяем степень окисленности никеля, учитывая, что сумма зарядов частиц равна +1. Заряд NH3 равен 0, а Cl равен -1.
Тогда получим: х + 5(0) + (-1) = +1; х = +1 + 1; х = +2.
в) Определение степени окисленности комплексообразователя в [Co(NH 3 ) 2 (NO 2 ) 4 ] —
Заряд Со равен (х), NH3 – (0), NO2 – (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд кобальта: х + 4(-1) + 2(0) = -1; х = +3. Степень окисленности равна +3.
г) Определение степени окисленности комплексообразователя в [Co(H 2 O) 4 Br 2 ] +
Заряд Сr равен (х), H2O – (0), Br – (-1). Отсюда, учитывая, что сумма зарядов частиц равна (+1), найдём заряд хрома: х + 4(0) + 2(-1) = +1; х = +3. Степень окисленности равна +3.
д) Определение степени окисленности комплексообразователя в [AuCl 4 ] — . Заряд Au равен (х), Cl — (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд золота: х + 4(-1) = -1; х = +3. Степень окисленности равна +3.
е) Определение степени окисленности комплексообразователя в [Hg(CN) 4 ] 2-
Заряд Hg равен (х), CN — (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд ртути: х + 4(-1) = -2; х = +2. Степень окисленности ртути равна +2.
ж)Определение степени окисленности комплексообразователя в [Cd(CN) 4 ] 2-
Заряд Сd равен (х), CN — (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд кадмия: х + 4(-1) = -2; х = +2. Степень окисленности кадмия равна +2.
http://himia.my-dict.ru/q/208204_feso4-k3-fecn6-k2so4-fefecn6-pomogite/
http://buzani.ru/zadachi/khimiya-glinka/1246-obmennye-reaktsii-kompleksnykh-soedinenij-zadachi-719-722