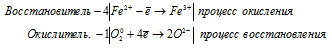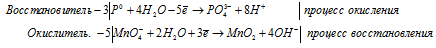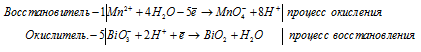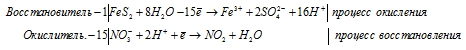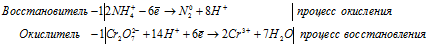Уравнять окислительно — восстановительную реакцию ионно — электронным методом FeSO4 + K2Cr2O7 + H2SO4 — — > ; Fe2(SO4)3 + Cr2(SO4)3 + H2O + K2SO4?
Химия | 5 — 9 классы
Уравнять окислительно — восстановительную реакцию ионно — электронным методом FeSO4 + K2Cr2O7 + H2SO4 — — > ; Fe2(SO4)3 + Cr2(SO4)3 + H2O + K2SO4.
6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + 7 H2O + K2SO42Fe( + 2) — 2e = 2Fe( + 3) 3 в — ль, ок — ие2Cr( + 6) + 6e = 2 Cr( + 3) 1 ок — ль, в — ие.
Помогите уравнять реакции методом ионно — электронного баланса?
Помогите уравнять реакции методом ионно — электронного баланса.
Уравнять методом полуреакций окислительно — восстановительную реакцию, указать окислитель и восстановитель?
Уравнять методом полуреакций окислительно — восстановительную реакцию, указать окислитель и восстановитель.
Уравнять окислительно – восстановительную реакцию методом электронного баланса I2 + H2O2→HIO3 + H2O расставить коэффициенты, указать окислитель и восстановитель?
Уравнять окислительно – восстановительную реакцию методом электронного баланса I2 + H2O2→HIO3 + H2O расставить коэффициенты, указать окислитель и восстановитель.
С помощью метода электронно — ионного баланса поставить коэффициенты в окислительно — восстановительной реакции КMnO4 + NaI + KOH = I2 + K2MnO4 + NaOH?
С помощью метода электронно — ионного баланса поставить коэффициенты в окислительно — восстановительной реакции КMnO4 + NaI + KOH = I2 + K2MnO4 + NaOH.
Помогите пожалуйста решить окислительно — восстановительные реакции электронно — ионным методом NO2 + NaOH = NaNO3 + NaNO2 + H2O?
Помогите пожалуйста решить окислительно — восстановительные реакции электронно — ионным методом NO2 + NaOH = NaNO3 + NaNO2 + H2O.
3) Уравняйте окислительно — восстановительную реакцию методом электронного баланса : HNO3(конц?
3) Уравняйте окислительно — восстановительную реакцию методом электронного баланса : HNO3(конц.
) + Cu = Cu(NO3)2 + NO2 + H2O.
Закончить и уравнять окислительно — восстановительные реакции ионно — электронным методом ?
Закончить и уравнять окислительно — восстановительные реакции ионно — электронным методом :
Уравняйте окислительно — восстановительную реакцию методом электронного баланса : H2SO4конц?
Уравняйте окислительно — восстановительную реакцию методом электронного баланса : H2SO4конц.
+ Cu = SO2↑ + CuSO4 + H2O.
Уравняйте окислительно — восстановительную реакцию методом электронного баланса : H2SO4(конц?
Уравняйте окислительно — восстановительную реакцию методом электронного баланса : H2SO4(конц.
) + Zn = ZnSO4 + H2S + H2O.
Помогите составить уравнения окислительно — восстановительной реакции методом электронного баланса?
Помогите составить уравнения окислительно — восстановительной реакции методом электронного баланса.
Вы открыли страницу вопроса Уравнять окислительно — восстановительную реакцию ионно — электронным методом FeSO4 + K2Cr2O7 + H2SO4 — — > ; Fe2(SO4)3 + Cr2(SO4)3 + H2O + K2SO4?. Он относится к категории Химия. Уровень сложности вопроса – для учащихся 5 — 9 классов. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Химия, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху.
Cao кислотный оксид koh основание cuso4 соль so2 кислотный оксид h3po4 кислота.
M = 160 (г) M(Al(NO3)3) = 27 + 3 * 14 + 9 * 16 = 213 (г / моль) n = m / M = 160 / 213 = 0. 75 (моль) N = Na * n, гдеNa — число Авогадро = 6. 02 * 10 ^ 23 (молекул / моль) N = 6. 02 * 10 ^ 23 * 0. 75 = 4. 515 * 10 ^ 23 (молекул).
Ну если бы не зарубежные, то тогда о химии не узнали бы зарубежные люди, а наши ученые изобрели химию, если бы не они, ее бы и не было.
4)HCl + Fe(OH)2 = FeCl2 + H2O.
Метан, этан, пропан, бутан, пентан, гексан, гептан, октан, нонан, декан. Каждый раз на один углерод больше. Изомеры : сначала находите главную цепь (в той, которой больше углеродов), для удобства ее можно обвести, затем смотрите какие есть ответвле..
Вещества в природе огромное количество. В основном это руды металлов с неметаллами. Газы в воздухе. Физические явления явления меняющие агрегатные состояния, массы. Химические которые из одного вещества, получают существенно другое вещество.
А — 4 W(O2) = ((16×2) / 58) * 100% = 55. 2% Б — 3 W(O2) = ((16×7) / 183) * 100% = 61. 2%.
Запись окислительно-восстановительного процесса в молекулярной и ионной форме
4Fe 2+ + O2 0 = 4Fe 3+ + 2O 2- .
б) P + KMnO4 + H2O ⇒ KH2HO4 + K2HO4
Уравнения полуреакций:
3P 0 + 5MnO4 — + 22H2O = 3PO4 3- + 5MnO2 + 20OH — + 24H + .
После приведения членов в обеих частях равенства получим ионно-молекулярную форму:
Молекулярная форма процесса с учётом того, что продуктами являются KH2HO4 и K2HO4:
Подставив коэффициент 2 к K2HO4 чтобы уравнять атомы калия и водорода, получим:
в) Mn(NO3)2 + NaBiO3 + HNO3 ⇒ HMnO4 +
Уравнения полуреакций:
Напишем молекулярную форму реакции с учётом данных задачи, получим:
Добавим в левую часть равенства одну молекулу HNO3 для уравнивания, получим окончательную молекулярную форму процесса:
Mn 2+ + 5NO3 — + 5Na + + 5BiO3 — + 3H + = MnO4 — + H + + 5BiO2 + 5Na + + 5NO3 — + H2O
Mn 2+ + 5BiO 3 — + 3H + = MnO 4 — + H + + 5BiO + H2O.
г) FeS2 + HNO3(конц.) ⇒ H2SO4 +
Уравнения полуреакций:
Приведём члены в обеих частях равенства, получим:
Напишем молекулярную форму реакции с учётом данных задачи, получим:
Для полного уравнивания добавим в левую часть равенства 3 моля HNO3, получим:
Приведём члены в обеих частях равенства, получим:
Для уравнивания водорода отнимем 6 ионов Н + и 3 молекулы Н2О, подставим 3 иона О 2- к 2 ионам Cr 3+ , получим:
Полное ионно-молекулярное уравнение, оно же будет и сокращенным ионным уравнением:
Задачи 30, 31 ЕГЭ по химии-2020
Задачи 30 и 31 из реального ЕГЭ по химии-2020, все задачи на окислительно-восстановительные реакции из реального экзамена ЕГЭ по химии, задания 30 и 31 из реального ЕГЭ 2020 (основная волна и резервные дни — 16 июля 2020 года, 24 июля 2020) с текстовыми решениями и ответами.
| Выдержка из формулировки каждого варианта 30 задания: «В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.» Выдержка из формулировки каждого варианта 31 задания: «Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.» Ниже приведены перечни веществ, а также дополнительные условия, которые были указаны в соответствующем варианте 30 и 31 задания. 1) Если вещество растворимо в воде, то допустимо использование водного раствора этого вещества. 2) Если концентрация кислоты указана, то следует использовать кислоту указанной концентрации. 3) Если концентрация кислоты не указана, то можно использовать и разваленную и концентрированную кислоту. |
1. Нитрат бария, сульфид калия, соляная кислота, нитрит натрия, перманганат калия, ацетат железа(II).
http://buzani.ru/zadachi/khimiya-glinka/1220-molekulyarnaya-i-ionnaya-forma-okislitelno-vosstanovitelnogo-protsessa-zadacha-655
http://chemege.ru/zadachi-30-31-ege-po-ximii-2020/