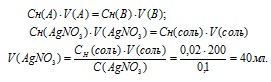HTTP Status 400 – Bad Request
Type Exception Report
Message Invalid character found in the request target [/ru/?s=FeSO4+++K3[Fe(CN)6]+=+K2SO4+++Fe3[Fe(CN)6]2 ]. The valid characters are defined in RFC 7230 and RFC 3986
Description The server cannot or will not process the request due to something that is perceived to be a client error (e.g., malformed request syntax, invalid request message framing, or deceptive request routing).
Note The full stack trace of the root cause is available in the server logs.
FeSO4 + K3 [Fe(CN)6] = K2SO4 + Fe[Fe(CN)6]↓ Помогите, пожалуйста, Составить ионное уравнение из исходного?
Химия | 5 — 9 классы
FeSO4 + K3 [Fe(CN)6] = K2SO4 + Fe[Fe(CN)6]↓ Помогите, пожалуйста, Составить ионное уравнение из исходного.
FeSO4 + K3 [Fe(CN)6] = K2SO4 + KFe[Fe(CN)6]↓
Fe(2 + ) + SO4(2 — ) + 3K( + ) + [Fe(CN)6( — ) = 2K( + ) + SO4(2 — ) + KFe[Fe(CN)6]↓
Fe(2 + ) K( + ) + [Fe(CN)6( — ) = KFe[Fe(CN)6]↓.
Запишите уравнения реакций в ионной и сокращенно ионной формах :1) FeSO₄ ⇒Fe₂(SO₄)₃2) Fe(OH)₂ ⇒Fe(OH)₃?
Запишите уравнения реакций в ионной и сокращенно ионной формах :
Помогите составить ионное уравнение : Аммиак + вода =?
Помогите составить ионное уравнение : Аммиак + вода =.
Помогите составить полное и сокращенное ионное уравнение?
Помогите составить полное и сокращенное ионное уравнение.
Помогите составить ионное уравнение?
Помогите составить ионное уравнение!
Исходные вещества CuSO4 и KNO3 составить молекулярное, полное ионно — молекулярное и сокращенное ионно — молекулярное уравнения реакций?
Исходные вещества CuSO4 и KNO3 составить молекулярное, полное ионно — молекулярное и сокращенное ионно — молекулярное уравнения реакций.
HCl + K2SO4 составить молекулярное, ионное и сокращенное уравнения?
HCl + K2SO4 составить молекулярное, ионное и сокращенное уравнения.
Помогите пожалуйста?
Из этих ионных уравнения нужно составить полные ионные уравнения.
Составить молекулярные, полные ионные и сокращенные ионные уравнения реакций между хлоридом кальция и нитратом серебра?
Составить молекулярные, полные ионные и сокращенные ионные уравнения реакций между хлоридом кальция и нитратом серебра.
Нужно составить ионное уравнение, помогите пожалуйста 2NaOH + SiO2 = Na2SiO3 + H2O?
Нужно составить ионное уравнение, помогите пожалуйста 2NaOH + SiO2 = Na2SiO3 + H2O.
Составить полное ионное и кратко ионное уравнения реакций и заполнить пропуски, помогите пожалуйста, заранее спасибо))?
Составить полное ионное и кратко ионное уравнения реакций и заполнить пропуски, помогите пожалуйста, заранее спасибо)).
На этой странице вы найдете ответ на вопрос FeSO4 + K3 [Fe(CN)6] = K2SO4 + Fe[Fe(CN)6]↓ Помогите, пожалуйста, Составить ионное уравнение из исходного?. Вопрос соответствует категории Химия и уровню подготовки учащихся 5 — 9 классов классов. Если ответ полностью не удовлетворяет критериям поиска, ниже можно ознакомиться с вариантами ответов других посетителей страницы или обсудить с ними интересующую тему. Здесь также можно воспользоваться «умным поиском», который покажет аналогичные вопросы в этой категории. Если ни один из предложенных ответов не подходит, попробуйте самостоятельно сформулировать вопрос иначе, нажав кнопку вверху страницы.
3O₂ = 2O₃ по схеме реакции V(O₃) = 2V(O₂) / 3 максимальный объем озона V(O₃) = 2 * 67, 2 / 3 = 44, 8 л.
Гидроксид натрия можно определить добавив голубой раствор сульфата меди, выпадет голубой осадок гидроксида меди 2NaOH + CuSO4 = Cu(OH)2 + Na2SO4 2Na + + 2OH — + Cu 2 + + SO4 2 — = Cu(OH)2 + 2Na + + SO4 2 — 2OH — + Cu2 + = Cu(OH)2 сульфат натрия можно..
Сырьём для керамического производства служат различного рода глины. Глины характеризуются рядом свойств, которые учитываются при их промышленном использовании : пластичностью, воздушной и огневой усадкой, пористостью, огнеупорностью, спеканием, гидр..
Кислотные свойства увеличиваются.
Реакции разложения — это когда из одного вещества образуется несколько веществ, здесь это реакция А реакции обмена — это когда вещества обмениваются своими частями ив результате реакции образуется столько же веществ, как и до нее. Здесь это реакция ..
1) пропан , там везде одинарные связи, а это и есть сигма — связи 2) а) С2H4 + Cl2 = C2H4Cl2 (реакция присоединения, это когда из нескольких вещество образуется одно новое) в б) — реакция замещения, в) — реакция замещения, г) — реакция обмена 3) Найд..
C6H5OH + KOH=C6H5OK + H2O 1) n (C6H5OH) = 4. 7 / 94=0. 05 моль 2) m (KOH) = 0. 14 * 120=16. 8 г 3) n (KOH) = 16. 8 / 56= 0. 3 моль 4) n(C6H5OK) = n (C6H5OH) = 0. 05 моль m(C6H5OK) = n * M (C6H5OK) = 0. 05 * 132= 6. 6 г Ответ : m (C6H5OK) =6.
Первое вещество диссоциирует в несколько ступеней : Fe(OH)2NO3 = Fe(OH)2 + 2NO3 Fe(OH)2 = FeOH + OH FeOH = Fe + OH Cr(NO3)3 = Cr + 3NO3.
1. ВОЗМОЖНА МЕЖДУ РАСТВОРАМИ Na2CO3 и HNO3 ( признак — выделение газа) 2. Для определения иона серебра : AgNO3 + HCl = HNO3 + AgCl↓ Для определения сульфат — анионов : Na2SO4 + BaCl2 = 2NaCl + BaSO4↓ Для определения катиона водорода : H2SO4 + 2KOH =..
Вычисления при обменных реакциях комплексных соединений. Заряды комплексных ионов
Задача 719.
Эмпирическая формула соли CrCl3 . 5H2O. Исходя из того, что координационное число хрома равно б, вычислить, какой объем 0,1 н. раствора AgNO3 понадобится для осаждения внешнесферно связанного хлора, содержащегося в 200 мл 0,01 М раствора комплексной соли; считать, что вся вода, входящая в состав соли, связана внутрисферно.
Решение:
Так как пять молекул воды, входящие в состав соли, связаны внутрисферно, и координационное число центрального атома хрома равно 6, то координационная формула соли будет иметь вид: [Cr(H2O)5Cl]Cl2. Во внешней сфере соли будет находиться два хлорид-иона, т.е. СЭ(Cl) = 2CM = 0,01 . 2 = 0,02н.
Для расчета объёма раствора AgNO3 используем математическое выражение следствия из закона эквивалентов (так называемое правило пропорциональности):
CH(A) . V(A) = CH(B) . V(B)
где Сн(A) и Cн(В) – молярные концентрации эквивалентов веществ А и В, моль; V(A) и V(B) – объёмы растворов веществ А и В.
Подставив данные задачи, вычислим объём раствора нитрата серебра, получим:
Ответ: 40 мл.
Задача 720.
Написать в молекулярной и ионно-молекулярной форме уравнения обменных реакций, происходящих между:
а) K4[Fe(CN)6] и CuSO4; б) Na3[Co(CN)6] и FeSO4; в) K3[Fe(CN)6] и AgNO3, имея в виду, что образующиеся комплексные соли нерастворимы в воде.
Решение:
а) Молекулярная форма:
После приведения членов в обеих частях равенства, получим:
После приведения членов в обеих частях равенства, получим:
3K + + [Fe(CN)6] 3- + 3Ag + + 3NO3 — = Ag3[Fe(CN)6]↓ + 3K+ + 3NO3-
После приведения членов в обеих частях равенства, получим:
Задача 721.
Найти заряды комплексных частиц и указать среди них катионы, анионы и неэлектролиты: а) [Co(NH3)5Cl];
б) [Cr(NH3)4PO4]; в) [Ag(NH3)2]; г) [Cr(OH)6]; д) [Co(NH3)3(NO2)3]; е) [Cu(H2O)4].
Решение:
а) [Co(NH3)5Cl]. Заряды нона кобальта (III) +3, хрома (III), меди (II) и серебра принимаем равными соответственно +3, +3, +2, и +1; заряд молекулы аммиака и молекулы воды равен нулю, заряды хлорид-, нитрит-, гидроксид- и фосфат-ионов соответственно равны -1, -1, -1 и -3.
Составляем алгебраические суммы зарядов для каждого из указанных соединений, получим:
а) +3 + (-1) = +2 (катион); б) +3 + (-3) = 0 (неэлектролит); в) +1 = +1 (катион); г) +3+ 6(-1) = -3 (анион); +3 + 3(-1) = 0 (неэлектролит); е) +2 = +2 (катион).
Задача 722.
Определить степень окисленности комплексообразователя в следующих комплексных ионах: а) [Fe(CN)6] 4- , б) [Ni(NH3)5Cl] + , в) [Co(NH3)2(NO2)4] — , г) [Co(H2O)4Br2] + , д) [AuCl4] — , е) [Hg(CN)4] 2- , ж) [Cd(CN)4] 2- .
Решение:
а) Определение степени окисленности комплексообразователя в [Fe(CN)6] 4– .
Определяем степень окисленности железа, учитывая, что сумма зарядов частиц равна -4. Заряд CN равен -1. Тогда получим: х + 6(-1) = -4; х = -4 + 6; х = +2.
б) Определение степени окисленности комплексообразователя в [Ni(NH 3 ) 5 Cl] +
Определяем степень окисленности никеля, учитывая, что сумма зарядов частиц равна +1. Заряд NH3 равен 0, а Cl равен -1.
Тогда получим: х + 5(0) + (-1) = +1; х = +1 + 1; х = +2.
в) Определение степени окисленности комплексообразователя в [Co(NH 3 ) 2 (NO 2 ) 4 ] —
Заряд Со равен (х), NH3 – (0), NO2 – (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд кобальта: х + 4(-1) + 2(0) = -1; х = +3. Степень окисленности равна +3.
г) Определение степени окисленности комплексообразователя в [Co(H 2 O) 4 Br 2 ] +
Заряд Сr равен (х), H2O – (0), Br – (-1). Отсюда, учитывая, что сумма зарядов частиц равна (+1), найдём заряд хрома: х + 4(0) + 2(-1) = +1; х = +3. Степень окисленности равна +3.
д) Определение степени окисленности комплексообразователя в [AuCl 4 ] — . Заряд Au равен (х), Cl — (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд золота: х + 4(-1) = -1; х = +3. Степень окисленности равна +3.
е) Определение степени окисленности комплексообразователя в [Hg(CN) 4 ] 2-
Заряд Hg равен (х), CN — (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд ртути: х + 4(-1) = -2; х = +2. Степень окисленности ртути равна +2.
ж)Определение степени окисленности комплексообразователя в [Cd(CN) 4 ] 2-
Заряд Сd равен (х), CN — (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд кадмия: х + 4(-1) = -2; х = +2. Степень окисленности кадмия равна +2.
http://himia.my-dict.ru/q/208204_feso4-k3-fecn6-k2so4-fefecn6-pomogite/
http://buzani.ru/zadachi/khimiya-glinka/1246-obmennye-reaktsii-kompleksnykh-soedinenij-zadachi-719-722