Общая характеристика металлов

Наиболее типичные металлы расположены в начале периодов (начиная со второго), далее слева направо металлические свойства ослабевают. В группе сверху вниз металлические свойства усиливаются, т.к увеличивается радиус атомов (за счет увеличения числа энергетических уровней). Это приводит к уменьшению электроотрицательности (способности притягивать электроны) элементов и усилению восстановительных свойств (способность отдавать электроны другим атомам в химических реакциях).
Типичными металлами являются s-элементы (элементы ИА-группы от Li до Fr. элементы ПА-группы от Мг до Ра). Общая электронная формула их атомов ns 1-2 . Для них характерны степени окисления + I и +II соответственно.
Небольшое число электронов (1-2) на внешнем энергетическом уровне атомов типичных металлов предполагает легкую потерю этих электронов и проявление сильных восстановительных свойств, что отражают низкие значения электроотрицательности. Отсюда вытекает ограниченность химических свойств и способов получения типичных металлов.
Характерной особенностью типичных металлов является стремление их атомов образовывать катионы и ионные химические связи с атомами неметаллов. Соединения типичных металлов с неметаллами — это ионные кристаллы «катион металлаанион неметалла», например К + Вг — , Сa 2+ О 2-. Катионы типичных металлов входят также в состав соединений со сложными анионами — гидроксидов и солей, например Мg 2+ (OН — ) 2 , (Li + )2СO 3 2-.
Металлы А-групп, образующие диагональ амфотерности в Периодической системе Ве-Аи-Ге-Сб-Ро, а также примыкающие к ним металлы (Га, In, Ти, Sn, Рб, Ви) не проявляют типично металлических свойств. Общая электронная формула их атомов ns 2 np 0-4 предполагает большее разнообразие степеней окисления, большую способность удерживать собственные электроны, постепенное понижение их восстановительной способности и появление окислительной способности, особенно в высоких степенях окисления (характерные примеры — соединения Тl III , Рb IV , Вi v ). Подобное химическое поведение характерно и для большинства (d-элементов, т. е. элементов Б-групп Периодической системы (типичные примеры — амфотерные элементы Сr и Zn).
Это проявление двойственности (амфотерности) свойств, одновременно металлических (основных) и неметаллических, обусловлено характером химической связи. В твердом состоянии соединения нетипичных металлов с неметаллами содержат преимущественно ковалентные связи (но менее прочные, чем связи между неметаллами). В растворе эти связи легко разрываются, а соединения диссоциируют на ионы (полностью или частично). Например, металл галлий состоит из молекул Ga 2 , в твердом состоянии хлориды алюминия и ртути (II) АиСи 3 и НgСl 2 содержат сильно ковалентные связи, но в растворе АиСи 3 диссоциирует почти полностью, а НгСи 2 — в очень малой степени (да и то на ионы НгСи + и Сl — ).
Общие физические свойства металлов
Благодаря наличию свободных электронов («электронного газа») в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность — способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность . Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение «электронного газа».
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность — у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий — литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются «легкими металлами».
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
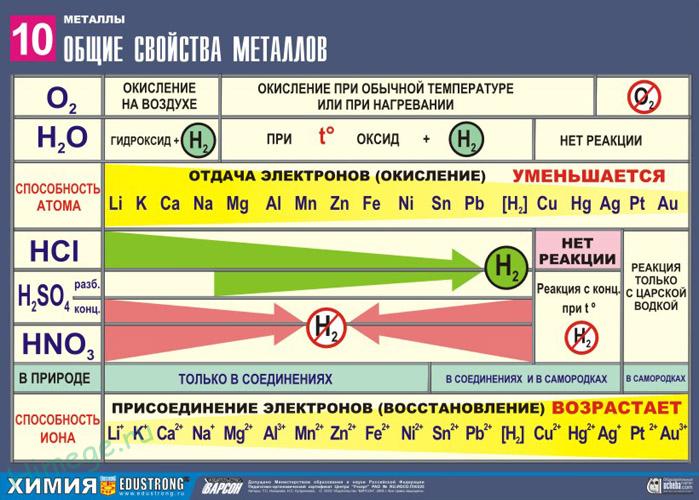
Сильные восстановители: Me 0 – nē → Me n +
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
I. Реакции металлов с неметаллами
1) С кислородом:
2Mg + O 2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl 2 – t° → NiCl 2
5) С фосфором:
3Ca + 2P – t° → Ca 3 P 2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H 2 → 2LiH
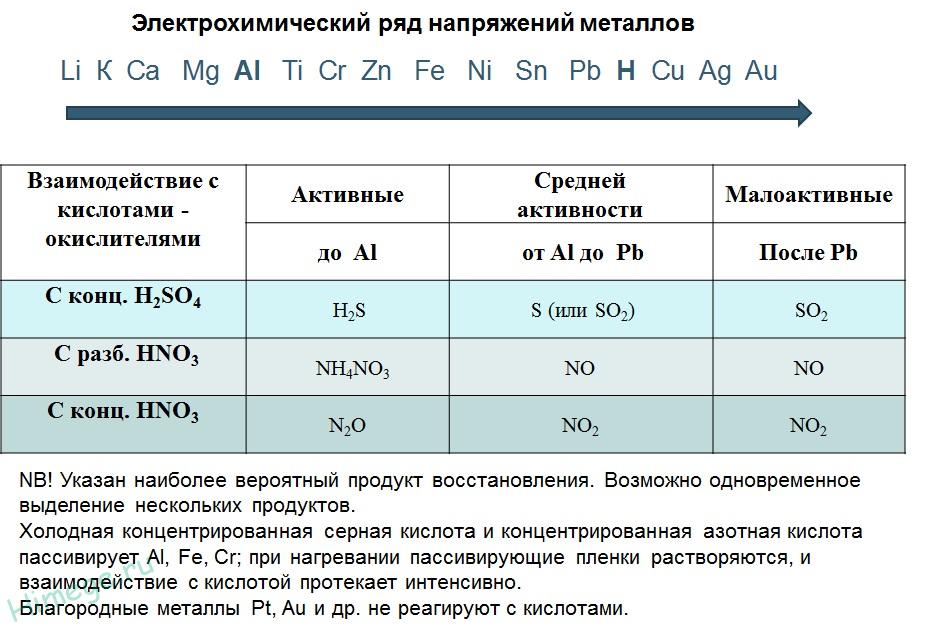
II. Реакции металлов с кислотами
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется! 
III. Взаимодействие металлов с водой
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2Na + 2H 2 O → 2NaOH + H 2
2) Металлы средней активности окисляются водой при нагревании до оксида:
3) Неактивные (Au, Ag, Pt) — не реагируют.
IV. Вытеснение более активными металлами менее активных металлов из растворов их солей:
В промышленности часто используют не чистые металлы, а их смеси — сплавы , в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком ( латунь ) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем — дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) — это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой , в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка (ржавчина ), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией . Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Ви, Со, Фе, Мг и Nb, а в концентрированной азотной кислоте — металлы А1, Ве, Ви, Со, Сг, Фе, Nb, Ni, РЬ, Тх и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (На + , Са 2+ ,А1 3+ ,Fе 2+ и Fе 3+ )
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg — только серной (концентрированной) и азотной кислотами, а Рt и Аи — «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия , т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО 2 и SО 2 ; создается кислотная среда, и катионы Н + вытесняются активными металлами в виде водорода Н 2 ( водородная коррозия ).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов ( контактная коррозия). Между одним металлом, например Фе, и другим металлом, например Sn или Су, помещенными в воду, возникает гальваническая пара. Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Су), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении ; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром ( нержавеющая сталь ), имеют высокую коррозионную стойкость.
Общие способы получения металлов в промышленности:
• электрометаллургия , т. е. получение металлов электролизом расплавов (для наиболее активных металлов) или растворов солей;
• пирометаллургия , т. е. восстановление металлов из руд при высокой температуре (например, получение железа в доменном процессе);
• гидрометаллургия , т. е. выделение металлов из растворов их солей более активными металлами (например, получение меди из раствора СuSO 4 действием цинка, железа или алюминия).
В природе иногда встречаются самородные металлы (характерные примеры — Аg, Аu, Рt, Нg), но чаще металлы находятся в виде соединений ( металлические руды ). По распространенности в земной коре металлы различны: от наиболее распространенных — Аи, На, Са, Фе, Мг, К, Ти) до самых редких — Ви, In, Аг, Ау, Рт, Ре.
Общие физические и химические свойства металлов
Общие физические свойства металлов
Благодаря наличию свободных электронов (“электронного газа”) в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность – способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение “электронного газа”.
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий – литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются “легкими металлами”.
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me 0 – nē → Me n +
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
1. Реакции металлов с неметаллами
1) С кислородом:
2Mg + O2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl2 – t° → NiCl2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH
2. Реакции металлов с кислотами
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
3. Взаимодействие металлов с водой
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2) Металлы средней активности окисляются водой при нагревании до оксида:
3) Неактивные (Au, Ag, Pt) – не реагируют.
4. Вытеснение более активными металлами менее активных металлов из растворов их солей:
В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте – металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа + , Са 2+ ,А1 3+ ,Fе 2+ и Fе 3+ )
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg – только серной (концентрированной) и азотной кислотами, а Рt и Аи – «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО2 и SО2; создается кислотная среда, и катионы Н + вытесняются активными металлами в виде водорода Н2 (водородная коррозия).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия). Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара. Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь), имеют высокую коррозионную стойкость.
Общие свойства металлов
Содержание:
Металлы (от лат. metallum — шахта, рудник) — группа химических элементов, обладающих в виде простых веществ при нормальных условиях характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Общие свойства металлов
Среди металлов традиционно выделяют несколько групп. Входящие в их состав представители характеризуются отличной от других металлов химической активностью. Такими группами являются:
- благородные металлы (серебро, золото, платина);
- щелочные металлы (металлы, образованные элементами IА группы периодической системы);
- щелочноземельныеметаллы (кальций, стронций, барий, радий).
Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
- 6 элементов в группе щелочных металлов,
- 6 в группе щёлочноземельных металлов,
- 38 в группе переходных металлов,
- 11 в группе лёгких металлов,
- 7 в группе полуметаллов,
- 14 в группе лантаноиды + лантан,
- 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний, вне определённых групп бериллий и магний.
Таким образом, к металлам, возможно, относится 96 элементов из всех открытых.
Положение металлов в периодической системе элементов Д. И. Менделеева
Если в периодической системе элементов Д. И. Менделеева (см. первый форзац книги) провести диагональ от бериллия к астату, то справа вверх от диагонали будут находиться элементы-неметаллы (исключая элементы побочных подгрупп), а слева внизу — элементы-металлы (к ним же относятся элементы побочных подгрупп). Элементы, расположенные вблизи диагонали (например, Be, Al, Ti, Ge, Nb, Sb и др.), обладают двойственным характером.
Руководствуясь делением элементов на семейства (§ 2.8), можно сказать, что к элементам-металлам относятся s-элементы I и II групп, все d— и f-элементы, а также p-элементы главных подгрупп: III (кроме бора), IV (Ge, Sn, Pb), V (Sb, Bi) и VI (Po). Как видно, наиболее типичные элементы-металлы расположены в начале периодов (начиная со второго).
Таким образом, из 107 элементов 85 являются металлами. В этой книге более подробно рассматриваются металлы главных подгрупп — Na, К, Са, Аl — и побочных подгрупп — Cr, Fe. Даются также общие характеристики подгрупп, в которые входят эти элементы.
Порядок заполнения электронами уровней и подуровней атомов элементов малых и больших периодов см. в § 2.7. Этот параграф следует еще раз внимательно прочитать, обратив особое внимание на строение электронных оболочек атомов элементов-металлов.
Физическое свойства металлов
Механическое воздействие на кристалл с ковалентной связью вызывает смещение отдельных слоев атомов, в результате связи разрываются и кристалл разрушается (рис. 12.1, а). Такое же воздействие на кристалл с металлической связью также вызывает смещение слоев атомов, однако благодаря перемещению электронов по всему кристаллу разрыв связей не происходит (рис. 12.1, б). Для металлов характерна высокая пластичность. Она уменьшается в ряду Au, Ag, Сu, Sn, Pb, Zn, Fe. Золото, например, можно прокатывать в листы толщиной не более 0,003 мм, которые используются для позолоты различных предметов.
Рис. 12.1. Смещение слоев в кристаллах с решетками: а — атомной; б — металлической
Для всех металлов характерен металлический блеск, обычно серый цвет и непрозрачность, что связано с наличием свободных электронов.
Тот факт, что металлы обладают хорошей электрической проводимостью, объясняется присутствием в них свободных электронов, которые под влиянием даже небольшой разности потенциалов приобретают направленное движение от отрицательного полюса к положительному.
С повышением температуры усиливаются колебания атомов (ионов), что затрудняет направленное движение электронов и тем самым приводит к уменьшению электрической проводимости. При низких же температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость резко возрастает. Наибольшей электрической проводимостью обладают серебро и медь. За ними следуют золото, алюминий, железо. Наряду с медными изготовляются и алюминиевые электрические провода.
Кстати отметим, что у неметаллов, обладающих проводимостью, с повышением температуры электрическая проводимость возрастает, что обусловлено ростом числа свободных электронов за счет разрыва ковалентных связей. При низких же температурах неметаллы ток не проводят из-за отсутствия свободных электронов. В этом главное различие между физическими свойствами металлов и неметаллов.
В большинстве случаев при обычных условиях теплопроводность металлов изменяется в такой же последовательности, как их электрическая проводимость. Теплопроводность обусловливается высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры в массе металла. Наибольшая теплопроводность — у серебра и меди, наименьшая — у висмута и ртути.
Различна плотность металлов. Она тем меньше, чем меньше атомная масса элемента-металла и чем больше радиус его атома. Самый легкий из металлов — литий (плотность 0,53 г/см 3 ), самый тяжелый — осмий (плотность 22,6 г/см 3 ). Как уже отмечалось, металлы с плотностью меньше 5 г/см 3 называются легкими, остальные — тяжелыми.
Разнообразны температуры плавления и кипения металлов. Самый легкоплавкий металл — ртуть, ее температура плавления — 38,9°С, цезий и галлий плавятся соответственно при 29 и 29,8°С. Вольфрам — самый тугоплавкий металл, температура его плавления 3390°С. Он применяется для изготовления нитей электроламп. Металлы, плавящиеся при температуре выше 1000°С, называют тугоплавкими, ниже — легкоплавкими.
Рис. 12.2. Кривые температур плавленая и кипения металлов VI периода
Сильное различие в температурах плавления и кипения следует объяснить различием прочности химической связи между атомами в металлах. Исследования показали, что в чистом виде металлическая связь характерна лишь для щелочных и щелочноземельных металлов. Однако у других металлов, и особенно переходных, часть валентных электронов локализована, т. е. осуществляет ковалентные связи между соседними атомами. А поскольку ковалентная связь прочнее металлической, то у переходных металлов температуры плавления и кипения, как это видно из рис. 12.2, намного выше, чем у щелочных и щелочноземельных.
Металлы отличаются по твердости. Самый твердый металл — хром (режет стекло), а самые мягкие — калий, рубидий и цезии. Они легко режутся ножом.
Металлы имеют кристаллическое строение. Большинство из них кристаллизуется в кубической решетке (см. рис. 3.18).
Химические свойства металлов
Атомы металлов сравнительно легко отдают валентные электроны и переходят в положительно заряженные ноны. Поэтому металлы являются восстановителями. В этом, собственно, и состоит их главное и наиболее общее химическое свойство.
Очевидно, металлы как восстановители будут вступать в реакции с различными окислителями, среди которых могут быть простые вещества, кислоты, соли менее активных металлов и некоторые другие соединения. Соединения металлов с галогенами называются галогенидами, с серой — сульфидами, с азотом — нитридами, с фосфором — фосфидами, с углеродом — карбидами, с кремнием — силицидами, с бором — боридами, с водородом — гидридами и т. д. Многие из этих соединений нашли важное применение в новой технике. Например, бориды металлов используются в радиоэлектронике, а также в ядерной технике в качестве материалов для регулирования нейтронного излучения и защиты от него.
Взаимодействие металлов с кислотами есть окислительно-восстановительный процесс. Окислителем является ион водорода, который принимает электрон от металла:
Взаимодействие металлов с водными растворами солей менее активных металлов можно иллюстрировать примером:
В этом случае происходит отрыв электронов от атомов более активного металла (Ni) и присоединение их ионами менее активного (Сu 2+ ).
Активные металлы взаимодействуют с водой, которая выступает в роли окислителя. Например:
Металлы, гидроксиды которых амфотерны, как правило, взаимодействуют с растворами и кислот, и щелочей. Например:
Таким образом, отношение металлов к неметаллам, кислотам, растворам солей менее активных металлов, к воде и щелочам подтверждает их главное химическое свойство — восстановительную способность.
Металлы могут образовывать химические соединения между собой. Они имеют общее название — интерметаллические соединения или интерметаллиды. Примером могут служить соединения некоторых металлов с сурьмой: Na2Sb, Ca3Sb2, NiSb, Ni4Sb, FeSbx (x= 0,72—0,92). В них чаще всего не соблюдаются степени окисления, характерные в соединениях с неметаллами. Обычно это бертоллиды.
Химическая связь в интерметаллидах преимущественно металлическая. По внешнему виду они похожи на металлы. Твердость интерметаллидов, как правило, выше, а пластичность намного ниже, чем у образующих их металлов. Многие интерметаллиды нашли практическое применение. Например, сурьма-алюминий AlSb, сурьма-индий InSb и другие широко используются как полупроводники.
Металлы и сплавы в технике
Сплавами называются системы, состоящие из двух или более металлов, а также металлов и неметаллов. Свойства сплавов самые разнообразные и отличаются от исходных компонентов. Так, например, сплав из 40% кадмия (т. пл. 321°С) и 60% висмута (т. пл. 271°С) плавится при температуре 144°С. Сплав золота с серебром характеризуется большой твердостью, в то время как сами эти металлы сравнительно мягкие.
Таблица 12.1. Ряд стандартных электродных потенциалов металлов
Химическая связь в сплавах металлическая. Поэтому они обладают металлическим блеском, электрической проводимостью и другими свойствами металлов.
Сплавы получают смешиванием металлов в расплавленном состоянии, они затвердевают при последующем охлаждении. При этом возможны следующие типичные случаи.
1. Расплавленные металлы смешиваются между собой в любых соотношениях, неограниченно растворяясь друг в друге. Сюда относятся металлы, кристаллизующиеся в однотипных решетках и имеющие близкие по размерам атомы, например Ag—Сu, Сu—Ni, Ag—Аu и др. При охлаждении таких расплавов получаются твердые растворы. Кристаллы последних содержат атомы обоих металлов, чем обусловливается их полная однородность. По сравнению с чистыми металлами твердые растворы характеризуются более высокой прочностью, твердостью и химической стойкостью; они пластичны и хорошо проводят электрический ток.
2. Расплавленные металлы смешиваются между собой в любых отношениях, однако при охлаждении твердый раствор не образуется. При затвердевании таких сплавов получается масса, состоящая из мельчайших кристалликов каждого из металлов. Это характерно для сплавов Pb—Sn, Bi—Cd, Ag—Pb и др.
3. Расплавленные металлы при смешивании взаимодействуют друг с другом, образуя химическое соединение — интерметаллиды. Например, соединения образуют медь и цинк (CuZn, CuZn3, Cu3Zn2), кальций и сурьма (Ca3Sb2), натрий и свинец (Na2Pb, Na2Pb5, Na4Pb) и др. Некоторые сплавы рассматриваются как смеси исходных металлов с продуктами их взаимодействия — интерметаллидами.
В настоящее время некоторые сплавы готовят методом порошковой металлургии. Берется смесь металлов в виде порошков, прессуется под большим давлением и спекается при высокой температуре в восстановительной среде. Таким путем получают сверхтвердые сплавы.
Большой вклад в изучение сплавов внес Н. С. Курнаков (1860— 1941). Он разработал новый метод исследования сплавов — так называемый физико-химический анализ. С помощью этого метода установлены зависимости между составом и свойствами многих сплавов, открылась возможность получать сплавы с заранее заданными свойствами: кислотоупорные, жаропрочные, сверхтвердые и др.
Огромное значение имеют сплавы на основе алюминия и железа. В состав некоторых сплавов входят неметаллы, например углерод, кремний, бор и др.
Ряд стандартных электродных потенциалов
В средней школе вы изучаете электрохимический ряд напряжений металлов. Более точное название его — ряд стандартных электродных потенциалов металлов. Для некоторых металлов он приведен в табл. 12.1. Как же составляется такой ряд? Почему, например, натрий стоит в нем после кальция? Как этим рядом пользоваться?
Ответ на первый вопрос можно дать на основе известных вам сведений. При погружении любого металла в раствор электролита на границе раздела металл /раствор возникает разность потенциалов, называемая электродным потенциалом или потенциалом электрода. Потенциал каждого электрода зависит от природы металла, концентрации его ионов в растворе и температуры.
Рис. 12.3. Стандартный водородный электрод
Непосредственно измерить потенциал отдельного электрода не представляется возможным. Поэтому электродные потенциалы измеряют относительно стандартного водородного электрода, потенциал которого условно принимают за нуль при всех значениях температуры. Водородный электрод состоит из платиновой пластинки, покрытой платиновой чернью (электролитически осажденной платиной), которая погружена в раствор серной кислоты с концентрацией ионов водорода, равной 1 моль/л, и омывается струей газообразного водорода йод давлением в 101,325 кПа при 25°С (рис. 12.3).
Молекулярный водород, проходя через раствор, растворяется и подходит к поверхности платины. На поверхности платины происходит распад молекул водорода на атомы и их адсорбция (закрепление на поверхности). Адсорбированные атомы водорода Надс ионизируются:
а ионы водорода, принимая электроны, переходят в адсорбированное состояние:
Более полно равновесие в водородном электроде выражается схемой
Среднюю часть этого равновесия обычно опускают, хотя следует иметь в виду, какую большую роль в установлении такого равновесного состояния играет платина.
Если теперь пластинку любого металла, погруженную в раствор его соли с концентрацией ионов металла 1 моль/л, соединять со стандартным водородным электродом, как показано на рис. 12.4, то получится гальванический элемент (электрохимическая цепь), электродвижущую силу (сокращенно ЭДС) которого легко измерить. Эта ЭДС и называется стандартным электродным потенциалом данного электрода (обычно обозначается E°). Таким образом,
электродным потенциалом называют ЭДС гальванического элемента (электрохимической цепи), которая составлена из исследуемого электрода и стандартного водородного электрода.
Рис. 12.4. Гальваническая цепь для измерения стандартного электродного потенциала металла: 1 — определяемый электрод; 2 — потенциометр; 3 — стандартный водородный электрод; 4 — раствор хлорида калия
Такая цепь изображена на рис. 12.4. Электродный потенциал называют также окислительно-восстановительным потенциалом.
При обозначении электродных потенциалов E и стандартных электродных потенциалов E° принято у знаков ставить индекс, соответствующий системе, к которой относится данный потенциал. Так, стандартный электродный потенциал системы 



Располагая металлы в порядке возрастания алгебраической величины их стандартных электродных потенциалов, получают ряд, представленный в табл. 12.1. В него могут быть включены и другие окислительно-восстановительные системы (в том числе неметаллические) в соответствии со значениями их E°, например 
Большинство стандартных электродных потенциалов можно определить экспериментально. Однако для щелочных и щелочноземельных металлов значения Е° рассчитывают только теоретически, так как эти металлы взаимодействуют с водой.
Ряд стандартных электродных потенциалов характеризует химические свойства металлов. Его применяют для выяснения, в какой последовательности восстанавливаются ионы при электролизе (§ 7.7), а также при описании других свойств металлов (§ 10.9 и 12.5).
Чем меньше алгебраическая величина потенциала, тем выше восстановительная способность этого металла и тем ниже окислительная способность его ионов.
Как следует из этого ряда, металлический литий — самый сильный восстановитель, а золото — самый слабый. И, наоборот, ион золота Аu 3+ — самый сильный окислитель, а ион лития Li + — самый слабый (в табл. 12.1 возрастание этих свойств указано стрелками).
Каждый металл в ряду стандартных электродных потенциалов обладает способностью вытеснять все следующие за ним металлы из растворов их солей. Однако это не означает, что вытеснение будет обязательно происходить во всех случаях. Так, например, алюминий вытесняет медь из раствора хлорида меди (II) СuСl2, но практически не вытесняет ее из раствора сульфата меди (II) CuSO4. Это объясняется тем, что хлорид-ионы Сl — намного быстрее разрушают защитную поверхностную пленку на алюминии по сравнению с сульфат-ионами
Очень часто на основе ряда стандартных электродных потенциалов пишут уравнения реакций вытеснения металлов из растворов их солей более активными щелочными и щелочноземельными металлами и, естественно, ошибаются. В этом случае вытеснения металлов не происходит, так как щелочные и щелочноземельные металлы сами реагируют с водой.
Все металлы, имеющие отрицательные значения стандартных электродных потенциалов, т. е. стоящие в ряду до водорода, вытесняют водород из разбавленных кислот (типа НСl или H2SO4) и при этом растворяются в них. Однако свинец в разбавленных растворах серной кислоты практически не растворяется. Происходит это потому, что на поверхности свинца сразу образуется защитный слой из малорастворимой соли сульфата свинца PbSO4, который нарушает контакт раствора с металлом. Металлы, стоящие в ряду после водорода, не вытесняют его из кислот.
Из приведенных примеров можно сделать вывод, что рядом стандартных электродных потенциалов следует пользоваться с учетом особенностей рассматриваемых процессов. Самое же главное — это надо иметь в виду, что ряд стандартных электродных потенциалов применим только к водным растворам и характеризует химическую активность металлов лишь в окислительно-восстановительных реакциях, протекающих в водной среде.
Натрий в ряду стандартных электродных потенциалов расположен после кальция Са: у него больше алгебраическая величина стандартного электродного потенциала.
ЭДС любого гальванического элемента можно вычислить по разности стандартных электродных потенциалов E°. При этом следует иметь в виду, что ЭДС—всегда положительная величина. Поэтому из потенциала электрода, имеющего большую алгебраическую величину, надо вычитать потенциал электрода, алгебраическая величина которого меньше. Например, ЭДС медно-цинкового элемента в стандартных условиях составит 0,34 — (—0,76) = 1,1 В.
Основные способы получения металлов
Металлы встречаются в природе как в свободном состоянии (самородные металлы), так и, главным образом, в виде химических соединений.
В виде самородных металлов находятся наименее активные металлы. Типичными их представителями являются золото и платина. Серебро, медь, ртуть, олово могут находиться в природе как в самородном состоянии, так и в виде соединений, все остальные металлы (стоящие в ряду стандартных электродных потенциалов до олова) — только в виде соединений с другими элементами.
Минералы и горные породы, содержащие металлы или их соединения и пригодные для промышленного получения металлов, называются рудами. Важнейшими рудами металлов являются их оксиды и соли (сульфиды, карбонаты и др.). Если руды содержат соединения двух или нескольких металлов, то они называются полиметаллическими (например, медно-цинковые, свинцово-серебряные и др.).
Получение металлов из руд — задача металлургии.
Металлургия — это наука о промышленных способах получения металлов из природного сырья. Металлургией также называют металлургическую промышленность.
Современная металлургия получает более 75 металлов и многочисленные сплавы на их основе. В зависимости от способов получения металлов различают пиро-, гидро- и электрометаллургию.
Пирометаллургия занимает ведущее место в металлургии. Она охватывает способы получения металлов из руд с помощью реакций восстановления, проводимых при высоких температурах. В качестве восстановителей применяют уголь, активные металлы, оксид углерода (II), водород, метан. Так, например, уголь и оксид углерода (II) восстанавливают медь из красной медной руды (куприта) Cu2O:
Аналогичным примером служит получение чугуна и стали из железных руд (см. § 14.9).
В тех случаях, когда руда является сульфидом металла, ее предварительно переводят в оксид путем окислительного обжига (обжиг с доступом воздуха). Например:
Затем оксид металла восстанавливают углем:
Восстановление углем (коксом) проводят обычно тогда, когда получаемые металлы совсем не образуют карбидов или образуют непрочные карбиды (соединения с углеродом); таковы железо и многие цветные металлы — медь, цинк, кадмий, германий, олово, свинец и др.
Восстановление металлов из их соединений другими металлами, химически более активными, называется металлотермией. Эти процессы протекают также при высоких температурах. В качестве восстановителей применяют алюминий, магний, кальций, натрий, а также кремний. Если восстановителем является алюминий, то процесс называется алюминотермией, если магний — магнийтермией. Например:
Металлотермией обычно получают те металлы (и их сплавы), которые при восстановлении оксидов углем образуют карбиды. Это — марганец, хром, титан, молибден, вольфрам и др.
Иногда металлы восстанавливают из оксидов водородом (водородотермия). Например:
При этом получаются металлы большой чистоты.
Гидрометаллургия охватывает способы получения металлов из растворов их солей. При этом металл, входящий в состав руды, сначала переводят в раствор с помощью подходящих реагентов, а затем извлекают из этого раствора. Так, например, при обработке разбавленной серной кислотой медной руды, содержащей оксид меди (II) СuО, медь переходит в раствор в виде сульфата:
Затем медь извлекают из раствора либо электролизом, либо вытеснением с помощью порошка железа:
В настоящее время гидрометаллургическим методом получают до 25% всей добываемой меди. Он имеет большое будущее, так как позволяет получать металлы, не извлекая руду на поверхность.
Этим же методом добывают золото, серебро, цинк, кадмий, молибден, уран и др. Руду, содержащую самородное золото, после измельчения обрабатывают раствором цианида калия KCN. Все золото переходит в раствор. Из раствора его извлекают электролизом или вытеснением металлическим цинком.
Электрометаллургия охватывает способы получения металлов с помощью электролиза. Этим способом получают главным образом легкие металлы — алюминий (см. § 13.11), натрий (см. § 13.2) и др.— из их расплавленных оксидов или хлоридов.
Электролиз используют также для очистки некоторых металлов. Из очищаемого металла изготавливают анод. При электролизе анод растворяется, ионы металла переходят в раствор, а на катоде они осаждаются. Так получаются электролитически чистые металлы: медь, серебро, железо, никель, свинец и многие другие.
Современной полупроводниковой и атомной технике необходимы металлы весьма высокой чистоты (содержание примесей порядка 10-8% и менее). Важнейшими методами глубокой очистки металлов являются зонная плавка, разложение летучих соединений металлов на нагретой поверхности, переплавка металлов в вакууме и др.
Итак, в основе всех способов получения металлов из их соединений лежат окислительно-восстановительные процессы.
Коррозия металлов
Металлы подвергаются коррозии. Под коррозией понимают разрушение металла под воздействием окружающей среды. Это самопроизвольный окислительно-восстановительный процесс. По механизму протекания разрушения различают два типа коррозии: химическую и электрохимическую.
Химической коррозией называется разрушение металла окислением его в окружающей среде без возникновения электрического тока в системе.
В этом случае происходит взаимодействие металла с составными частями среды — с газами и неэлектролитами.
Большой вред приносит разновидность химической коррозии — так называемая газовая коррозия, т. е. соединение металлов с кислородом воздуха. Скорость окисления многих металлов сильно возрастает при повышении температуры. Так, на железе уже при 250—300°С появляется видимая пленка оксидов. При 600°С и выше поверхность металла покрывается слоем окалины, состоящей из оксидов железа различной степени окисления: FeO, Fe3O4, Fe2O3. Окалина не защищает железо от дальнейшего окисления, так как содержит трещины и поры, которые облегчают доступ кислорода к металлу. Поэтому при нагревании железа свыше 800°С скорость окисления его очень быстро растет.
Примером химической коррозии в неэлектролитах может служить разрушение цилиндров двигателей внутреннего сгорания. В топливе содержатся примеси — сера и ее соединения, которые при сгорании превращаются в оксиды серы (IV) и (VI) — коррозионно-активные вещества. Они разрушают детали реактивных двигателей — сопла и др.
Наибольший вред приносит электрохимическая коррозия.
Электрохимической коррозией называется разрушение металла в среде электролита с возникновением внутри системы электрического тока.
В этом случае наряду с химическими процессами (отдача электронов) протекают и электрические (перенос электронов от одного участка к другому).
В качестве примера электрохимической коррозии можно привести коррозию железа в контакте с медью в растворе электролита — соляной кислоты (т. е. при высокой концентрации ионов водорода Н + ). Пои таком контакте возникает гальванический элемент (см. §7.1 и рис. 12.5).
Как показано на рис. 12.5, более активный металл — железо (анод) окисляется, посылая электроны атомам меди, и переходит в раствор в виде ионов Fe 2+ , образуя с хлорид-ионами среды хлорид железа (II) FeCl2.
Рис. 12.5. Схема действия гальванической
Ионы же водорода движутся к меди (катоду), где, принимая электроны, разряжаются. В ионной форме эти реакции могут быть выражены суммарным уравнением:
На катодах вместо разряда ионов водорода (или молекул воды) может протекать процесс восстановления кислорода, растворенного в электролите:
т. е. связывание электронов на поверхности катода осуществляется молекулами кислорода. Это так называемая кислородная деполяризация катода. Какой процесс будет протекать, зависит от условий: в кислой среде выделяется водород (происходит водородная деполяризация катода: 
Гидроксид железа (II) в присутствии воды и кислорода воздуха переходит в гидроксид железа (III):
Гидроксид железа (III) можно представить как 
Электрохимическую коррозию вызывают главным образом примеси других металлов и неметаллических веществ или неоднородность поверхности. Согласно теории электрохимической коррозии в этих случаях при соприкосновении металла с электролитом (электролитом может быть влага, адсорбируемая из воздуха) на его поверхности возникают гальванические микроэлементы. При этом металл с более отрицательным потенциалом разрушается — ионы его переходят в раствор, а электроны переходят к менее активному металлу, на котором происходит восстановление ионов водорода (водородная деполяризация) или восстановление растворенного в воде кислорода (кислородная деполяризация).
Таким образом, при электрохимической коррозии (как в случае контакта разнородных металлов, так и случае образования микрогальванических элементов на поверхности одного металла) поток электронов направлен от более активного металла к менее активному (проводнику), и более активный металл корродирует. Скорость коррозии тем больше, чем дальше расположены друг от друга в ряду стандартных электродных потенциалов те металлы, из которых образовался гальванический элемент (гальваническая пара).
На скорость коррозии влияет и характер раствора электролита. Чем выше его кислотность (т. е. меньше рН), а также чем больше содержание в нем окислителей, тем быстрее протекает коррозия. Значительно возрастает коррозия с ростом температуры.
Некоторые металлы при соприкосновении с кислородом воздуха или в агрессивной среде переходят в пассивное состояние, при котором резко замедляется коррозия. Например, концентрированная азотная кислота легко делает пассивным железо, и оно практически не реагирует с концентрированной азотной кислотой. В таких случаях на поверхности металла образуется плотная защитная оксидная пленка, которая препятствует контакту металла со средой.
Защитная пленка всегда имеется на поверхности алюминия (см. § 13.11). Подобные пленки в сухом воздухе образуются также на Be, Сr, Zn, Та, Ni, Сu и других металлах. Кислород является наиболее распространенным пассиватором.
Пассивированием объясняется коррозионная стойкость нержавеющих сталей и сплавов.
Защита от коррозии
Коррозия металлов протекает непрерывно и причиняет огромные убытки. Подсчитано, что прямые потери железа от коррозии составляют около 10% его ежегодной выплавки. В результате коррозии металлические изделия теряют свои ценные технические свойства. Поэтому имеют очень большое значение методы защиты металлов и сплавов от коррозии. Они весьма разнообразны. Назовем некоторые из них.
Защитные поверхностные покрытия металлов. Они бывают металлические (покрытие цинком, оловом, свинцом, никелем, хромом и другими металлами) и неметаллические (покрытие лаком, краской, эмалью н другими веществами). Эти покрытия изолируют металл от внешней среды. Так, кровельное железо покрывают цинком: из оцинкованного железа изготовляют многие изделия бытового и промышленного значения. Слой цинка предохраняет железо от коррозии, так как хотя цинк и является более активным металлом, чем железо (см. ряд стандартных электродных потенциалов металлов, табл. 12.1), он покрыт оксидной пленкой. При повреждениях защитного слоя (царапины, пробои крыш и т. д.) в присутствии влаги возникает гальваническая пара Zn|Fe. Катодом (положительным полюсом) является железо, анодом (отрицательным полюсом) — цинк (рис. 12.6). Электроны переходят от цинка к железу, где связываются молекулами кислорода (кислородная деполяризация), цинк растворяется, но железо остается защищенным до тех пор, пока не разрушится весь слой цинка, на что требуется довольно много времени. Покрытие железных изделий никелем, хромом, помимо защиты от коррозии, придает им красивый внешний вид.
Рис. 12.6. Коррозионное разрушение цинка в гальванической паре Zn|Fe
Создание сплавов с антикоррозионными свойствами. Введением в состав стали до 12% хрома получают нержавеющую сталь, устойчивую к коррозии. Добавки никеля, кобальта и меди усиливают антикоррозионные свойства стали, так как повышается склонность сплавов к пассивации. Создание сплавов с антикоррозионными свойствами— одно из важных направлений борьбы с коррозионными потерями.
Протекторная защита и электрозащита. Протекторная защита применяется в тех случаях, когда защищается конструкция (подземный трубопровод, корпус судна), находящаяся в среде электролита (морская вода, подземные, почвенные воды и т. д.). Сущность такой защиты заключается в том, что конструкцию соединяют с протектором — более активным металлом, чем металл защищаемой конструкции. В качестве протектора при защите стальных изделий обычно используют магний, алюминий, цинк и их сплавы. В процессе коррозии протектор служит анодом и разрушается, тем самым предохраняя от разрушения конструкцию (рис. 12.7). По мере разрушения протекторов их заменяют новыми.
На этом принципе основана и электрозащита. Конструкция, находящаяся в среде электролита, также соединяется с другим металлом (обычно куском железа, рельсом и т. п.), но через внешний источник тока. При этом защищаемую конструкцию присоединяют к катоду, а металл — к аноду источника тока. Электроны отнимаются от анода источником тока, анод (защищающий металл) разрушается, а на катоде происходит восстановление окислителя.
Электрозащита имеет преимущество перед протекторной защитой: радиус действия первой около 2000 м, второй — около 50 м.
Изменение состава среды. Для замедления коррозии металлических изделий в электролит вводят вещества (чаще всего органические), называемые замедлителями коррозии или ингибиторами. Они применяются в тех случаях, когда металл следует защищать от разъедания кислотами. Советские ученые создали ряд ингибиторов (препараты марок ЧМ, ПБ и др.), которые, будучи добавлены к кислоте, в сотни раз замедляют растворение (коррозию) металлов.
Рис. 12.7. Схема протекторной защиты подземного трубопровода:
1 — протектор (цинк, он корродирует); 2 — проводник тока; 3 — трубопровод (защищен за счет электронов цинка)
В последние годы разработаны летучие (или атмосферные) ингибиторы. Ими пропитывают бумагу, которой обертывают металлические изделия. Пары ингибиторов адсорбируются на поверхности металла и образуют на ней защитную пленку.
Ингибиторы широко применяются при химической очистке от накипи паровых котлов, снятии окалины с обработанных изделий, а также при хранении и перевозке соляной кислоты в стальной таре. К числу неорганических ингибиторов относятся нитриты, хроматы, фосфаты, силикаты. Механизм действия ингибиторов является предметом исследования многих химиков.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://www.yoursystemeducation.com/obshhie-fizicheskie-i-ximicheskie-svojstva-metallov/
http://natalibrilenova.ru/obschie-svojstva-metallov/