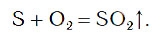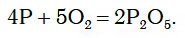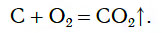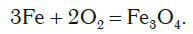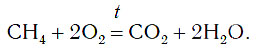Кислород: химия кислорода
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Кислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -183 о С.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
- Разложение некоторых кислородосодержащих веществ:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
Основные степени окисления кислород +2, +1, 0, -1 и -2.
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя (с большинством химических элементов) и свойства восстановителя (только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами , и с неметаллами . Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
Железо , в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды . При этом образуются оксиды:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения ( сероводород, аммиак, метан, силан гидриды . При этом также образуются оксиды:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора ( сероуглерод, сульфид фосфора и др.):
CS2 + 3O2→ CO2 + 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления ( оксид углерода (II), оксид железа (II) и др.):
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например , кислород окисляет гидроксид железа (II):
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Урок 18. Физические и химические свойства кислорода
В уроке 18 «Физические и химические свойства кислорода» из курса «Химия для чайников» выясним, какие физические и химические свойства имеет кислород и узнаем о реакциях горения.
Как у любого химического вещества, у кислорода есть свой набор физических и химических свойств, по которым его можно отличить от других веществ.
Физические свойства
По своим физическим свойствам простое вещество кислород относится к неметаллам. При нормальных условиях он находится в газообразном агрегатном состоянии. Кислород не имеет цвета, запаха и вкуса. Масса кислорода объемом 1 дм 3 при н. у. равна примерно 1,43 г.
При температуре ниже −183 °С кислород превращается в голубую жидкость, а при −219 °С эта жидкость переходит в твердое вещество. Это означает, что температура кипения кислорода равна: t кип.= −183 °С, а температура плавления составляет: t пл.= −219 °С. Кислород плохо растворяется в воде.
Химические свойства
Кислород является химически активным веществом. Он способен вступать в реакции с множеством других веществ, однако для протекания большинства этих реакций необходима более высокая, чем комнатная, температура. При нагревании кислород реагирует с неметаллами и металлами.
Если стеклянную колбу наполнить кислородом и внести в нее ложечку с горящей серой, то сера вспыхивает с образованием яркого пламени и быстро сгорает (рис. 80).
Химическую реакцию, протекающую в этом случае, можно описать следующим уравнением:
В результате реакции образуется вещество SO2, которое называется сернистым газом. Сернистый газ имеет резкий запах, который вы ощущаете при зажигании обычной спички. Это говорит о том, что в состав головки спички входит сера, при горении которой и образуется сернистый газ.
Подожженный красный фосфор в колбе с кислородом вспыхивает еще ярче и быстро сгорает, образуя густой белый дым (рис. 81).
При этом протекает химическая реакция:
Белый дым состоит из маленьких твердых частиц продукта реакции — P2O5.
Если в колбу с кислородом внести тлеющий уголек, состоящий в основном из углерода, то он также вспыхивает и сгорает ярким пламенем (рис. 82).
Протекающую химическую реакцию можно представить следующим уравнением:
Продуктом реакции является CO2, или углекислый газ, с которым вы уже знакомы. Доказать образование углекислого газа можно, добавив в колбу немного известковой воды. Помутнение свидетельствует о присутствии CO2 в колбе.
Возгорание уголька можно использовать для отличия кислорода от других газов. Если в сосуд (колбу, пробирку) с газом внести тлеющий уголек и он вспыхнет, то это указывает на наличие в сосуде кислорода.
Кроме неметаллов, с кислородом реагируют и многие металлы. Внесем в колбу с кислородом раскаленную стальную проволоку, состоящую в основном из железа. Проволока начинает ярко светиться и разбрасывать в разные стороны раскаленные искры, как при горении бенгальского огня (рис. 83).
При этом протекает следующая химическая реакция:
В результате реакции образуется вещество Fe3O4 (железная окалина). В состав формульной единицы этого вещества входят три атома железа, причем один из них имеет валентность II, а два других атома имеют валентность III. Поэтому формулу этого вещества можно представить в виде FeO * Fe2O3.
На заметку: Реакцию железа с кислородом используют для резки стальных изделий. Для этого определенный участок детали сначала нагревают с помощью кислородногазовой горелки. Затем направляют на нагретое место струю чистого кислорода, для чего перекрывают кран поступления горючего газа в горелку. Нагретое до высокой температуры железо вступает в химическую реакцию с кислородом и превращается в окалину. Так можно разрезать очень толстые железные детали.
Реакции горения
Общим для рассмотренных нами реакций является то, что при их протекании выделяется много света и теплоты. Очень многие вещества именно так взаимодействуют между собой.
Рассмотренные выше реакции простых веществ серы, фосфора, углерода и железа с кислородом являются реакциями горения.
Реакциями горения называются химические реакции, протекающие с выделением большого количества теплоты и света.
Кроме простых веществ, в кислороде горят и многие сложные вещества, например метан CH4. При горении метана образуются углекислый газ и вода:
В результате этой реакции выделяется очень много теплоты. Вот почему ко многим домам подведен природный газ, основным компонентом которого является метан. Теплота, выделяющаяся при горении метана, используется для приготовления пищи и других целей.
На заметку: Некоторые химические реакции протекают очень быстро. Такие реакции называют взрывными или просто взрывами. Например, взаимодействие кислорода с водородом может протекать в форме взрыва.
Горение может протекать не только в кислороде, но и в других газах. Об этих процессах вы узнаете при дальнейшем изучении химии.
Горение веществ на воздухе и в кислороде
Вы уже знаете, что в состав окружающего нас воздуха входит кислород. Поэтому многие вещества горят не только в чистом кислороде, но и на воздухе.
Горение на воздухе протекает чаще всего гораздо медленнее, чем в чистом кислороде. Происходит это потому, что в воздухе лишь одна пятая часть по объему приходится на кислород. Если уменьшить доступ воздуха к горящему предмету (а следовательно, уменьшить доступ кислорода), горение замедляется или прекращается. Отсюда понятно, почему для тушения загоревшегося предмета на него следует набросить, например, одеяло или плотную тряпку.
На заметку : При пожарах для тушения горящих предметов часто используют пену (рис. 84). Она обволакивает горящий предмет и прекращает доступ к нему кислорода. Горение сначала замедляется, а затем прекращается совсем.
Некоторые вещества, быстро сгорающие в кислороде, на воздухе не горят вообще. Так, если нагреть железную проволоку на воздухе даже до белого каления, она все равно не станет гореть, тогда как в чистом кислороде быстро сгорает с образованием раскаленных искр.
Краткие выводы урока:
- При обычных условиях кислород — газ, не имеющий цвета, запаха и вкуса, плохо растворимый в воде.
- Кислород обладает высокой химической активностью. Он вступает в химические реакции со многими простыми и сложными веществами.
- Химические реакции, протекающие с выделением большого количества теплоты и света, называют реакциями горения.
- В чистом кислороде вещества горят намного быстрее, чем на воздухе.
Надеюсь урок 18 «Физические и химические свойства кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Кислород — химические и физические свойства, получение, распространение
Содержание:
Кислород распространён в природе в виде изотопов 16О, 17О, 18О, которые имеют следующее процентное содержание на Земле – 99,76%, 0,048%, 0,192% соответственно. В свободном состоянии кислород находится в виде трёх алло-тропных модификаций: атомарного кислорода — Оо , дикислорода – О2 и озона – О3.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Кислород — распространение кислорода в природе и получение
Кислород – элемент (О), кислород – простое вещество (
В виде простого вещества кислород входит в состав воздуха, что впервые установил в 1770 г. шведский химик К. Шееле. Объемное содержание кислорода в воздухе 21%. Эта
величина (округлена до 20%) часто используется при решении задач. В земной коре в составе химических соединений содержится около 49% кислорода. Это видно из формул
следующих природных соединений: 



В Периодической таблице Д. И. Менделеева кислород находится на 8-м месте, химический знак – O (oxygenium). Относительная атомная масса – 16. Кислород в соединениях проявляет валентность II.
Строение атома кислорода:
В воздухе содержится, кроме кислорода, азот – 78%; примерно 1% составляют инертные газы (гелий, неон, аргон и др.), что было установлено учеными в конце ХIX века. Это постоянные компоненты воздуха. Есть и переменные компоненты – загрязняющие газы, состав которых зависит от местных условий (≈ 1%). К ним относятся углекислый газ и водяные пары. Таким образом, воздух является смесью газов.
Массовая доля кислорода в воздухе – 23%. Запас кислорода в воздухе 

Количество кислорода в воздухе все время уменьшается под влиянием различных техногенных факторов, которые зависят от хозяйственной ориентации каждого конкретного региона. В то же время содержание кислорода в воздухе пополняется за счет процесса фотосинтеза, который идет непрерывно, поэтому состав воздуха остается примерно постоянным (рис. 28).
Экологическая обстановка в нашей республике, в первую очередь в промышленных городах, ухудшается из года в год (Усть-Каменогорск, Павлодар, Тараз, Шымкент, Караганда, Текели и т. д.). Усиливает этот процесс и увеличение количества автомобилей.
До некоторого предела переменные компоненты воздуха не влияют на окружающую среду. Это количество называется предельно допустимой концентрацией (ПДК). Если содержание вредных примесей превышает ПДК, появляется опасность отравления и т. п. Организм человека чувствует снижение концентрации кислорода более чем на 1%.
Ученые всего мира упорно работают над созданием новейших экологически чистых технологий, ведь воздух определяет саму возможность жизни на Земле.
Вам уже знакомы реакции окисления – процессы взаимодействия простых и сложных веществ с кислородом.
Как химический элемент кислород образует два простых вещества: 

Из курса биологии вы уже знаете, что в процессе фотосинтеза растения поглощают углекислый газ и выделяют кислород, которым мы дышим. Растения являются «легкими» планеты. Поэтому не случайно в народе говорят: «Каждый должен вырастить хотя бы одно дерево». В последние годы в Казахстане по программе «Жасыл ел» ежегодно высаживают несколько сотен тысяч саженцев. Например, Астана окружена несколькими «зелеными
поясами». Их площадь достигла 78 тыс. гектаров. Эти меры способствуют улучшению состава воздуха.
Физические свойства
Кислород 
Получение кислорода
Промышленный способ получения кислорода заключается в сжижении воздуха при низких температурах и его перегонке. Вначале из жидкого воздуха отгоняют газообразный азот (его температура кипения ниже, чем у кислорода). В жидком состоянии остается почти чистый кислород. Его хранят в баллонах голубого цвета, так как жидкий кислород имеет светло-голубой цвет (рис. 29).
Лабораторные способы получения кислорода основаны на реакциях разложения некоторых богатых кислородом веществ.
1. Разложение перманганата калия.
В сухую пробирку насыпаем немного вещества и, закрыв пробирку пробкой с газоотводной трубкой, осторожно нагреваем. При этом протекает химическая реакция:
2. Каталитическое разложение пероксида водорода (рис. 30).
Тлеющей лучинкой проверяем наполненность пробирки кислородом. Если ее поднести к отверстию трубки, она вспыхнет.
3. Каталитическое разложение хлората калия.
Для ускорения этой реакции добавляем к хлорату немного оксида марганца (IV) и нагреваем. Вещества, ускоряющие реакцию и при этом не расходующиеся, называются катализаторами.
Выделившийся кислород можно собрать двумя способами:
1) вытеснением воздуха, так как кислород тяжелее (рис. 31, а):
2) вытеснением воды, т. к. он плохо растворяется в воде (рис. 31, б).
В 1774 г. английский ученый Д. Пристли получил кислород разложением оксида ртути (II):
Для хранения газов в лабораториях используют газометр (рис. 32). Газометр состоит из сосуда и большой воронки, конец которой немного не доходит до дна сосуда.
Воронка, снабженная краном, вставляется в сосуд на шлифе, обеспечивающем герметичность прибора. Перед наполнением газометра газом воздух из него вытесняют водой. Для этого
открывают краны 1 и 2. Через воронку 3 вливают воду и доверху заполняют ею газометр. Затем закрывают оба крана, вынимают пробку из тубуса 4 и вводят в газометр конец газоотводной трубки от прибора для получения газа. Газ поступает в газометр, вытесняя из него воду, которая выливается в стеклянную ванну или раковину. После наполнения
газометра газом закрывают нижнее отверстие 4 пробкой и наливают воду в воронку 3. Для выпуска газа из газометра открывают кран 1 и слегка – кран 2. При этом вода из воронки поступает в сосуд и вытесняет из него газ, который выходит через газоотводную трубку и может быть направлен в сосуд-приемник.
В газометре можно хранить газы, малорастворимые в воде и не взаимодействующие с ней. Взрывоопасные газы нельзя хранить в газометре.
Демонстрация №4
Разложение пероксида водорода
Опыт проводит учитель, учащиеся наблюдают, делают выводы.
Цель: Уметь получать кислород и собирать двумя способами.
1. Закрепите вертикально в зажиме штатива термостойкую пробирку.
2. В пробирку наберите немного раствора пероксида водорода и всыпьте в пробирку заранее приготовленного порошка диоксида марганца.
3. Опустите в пробирку тлеющую лучинку. Затем пробирку закройте пробкой с газоотводной трубкой. Опыт можно провести в термостойком стакане (рис. 33).
Химические свойства кислорода
Химические свойства. При нагревании кислород взаимодействует со
многими веществами.
Этот процесс называется горением и сопровождается выделением тепла
и света.
Взаимодействие с простыми веществами
Если бросить кусочек тлеющего
угля в пробирку с кислородом, то он раскаляется и сгорает (рис. 34, а).
В кислороде также горят сера, фосфор и другие неметаллы (рис. 34, б, в).
Фосфор горит очень интенсивно (рис. 35). За считанные секунды колба
наполняется белым дымом, на стенках колбы оседает оксид фосфора (V).
Некоторые металлы также взаимодействуют с кислородом с образованием оксидов. Держа щипцами зажженную ленту магния, поместим ее в сосуд с кислородом. Магний горит светящимся пламенем. (Нельзя долго смотреть на горящий магний, это вредно для глаз.)
Раскаленный уголек поместим на кончике железной проволоки, прикрепленной к лучинке, и опустим в пробирку с кислородом. При этом загорятся и лучинка, и уголь, и даже железо (рис. 36):
Горение железа сопровождается треском и «фейерверком» искр – расплавленных капель железной окалины.
При взаимодействии простых веществ – металлов и неметаллов – с кислородом образуются оксиды.
Оксидами называются сложные вещества, состоящие из атомов двух элементов, один из которых кислород. Химические реакции между кислородом и другими веществами называются реакциями окисления.
Названия оксидов образуются с помощью слова «оксид» и соответствующего названия элемента с указанием в скобках переменной валентности. Например, 




Взаимодействие со сложными веществами
Некоторые сложные вещества также взаимодействуют с кислородом с образованием оксидов. Например, при горении пропана, который входит в состав природного газа, протекает следующая реакция:
При автогенной сварке и резке металлов горит ацетилен:
В металлургии в обжиговых печах протекают реакции окисления обогащенных руд:
Реакции взаимодействия простых и сложных веществ с кислородом называются реакциями окисления.
- 1. Кислород — самый распространенный в природе элемент. Он встречается в виде двух аллотропных модификаций: кислород (О.,) и озон (О3).
- 2. С участием кислорода идут процессы медленного окисления, горения, гниения, брожения.
- 3. Явление образования нескольких простых веществ одним элементом называется аллотропией.
- 4. Кислород вступает в реакцию с металлами, неметаллами и сложными веществами.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://himi4ka.ru/arhiv-urokov/urok-18-fizicheskie-i-himicheskie-svojstva-kisloroda.html
http://natalibrilenova.ru/kislorod-himicheskie-i-fizicheskie-svojstva-poluchenie-rasprostranenie/