Кинетика выщелачивания золота
Скорость перехода в раствор золота, серебра, и примесей зависит от диффузии цианида и кислорода, которая должна быть не только быстрой, но и пропорциональной: избыток одного из реагентов не ускоряет нужных реакций и расходуется непроизводительно.
Попытки выщелачивания под давлением кислорода или с добавлением в раствор иных окислителей при соответствующем увеличении концентрации NaCN потерпели неудачу из-за повышенного растворения примесей, высокого расхода цианида и трудностей последующего осаждения благородных металлов.
Если все же допустить, что в отдельных случаях возможен и кинетический контроль скорости цианирования, в общем виде применения закона действующих масс следует записать:
Из-за высокого показателя степени преобладающее значение имеет активность aCN-.
Путь кислорода воздуха к поверхности золотин труднее, чем у цианида: он должен преодолеть два межфазных раздела — воздух — раствор и раствор — твердое. Поверхность первого удается в известных пределах увеличивать диспергированием воздуха; однако это требует дополнительных затрат. Увеличение поверхности золотин возможно в малых пределах — только путем их большего раскрытия — устранением окружающих веществ. При мелком золоте это особенно трудно и дорого. Измельчение требует высоких расходов, кроме того мелкий материал плохо отделяется от раствора сгущением и фильтрацией. Нагревание как средство ускорения диффузии, помимо дополнительных расходов, нерационально из-за понижения растворимости кислорода и необходимости повышения щелочности, подавляющей более активный гидролиз.
Многолетняя практика цианирования во многом подтверждает справедливость термодинамических расчетов и условий, определяющих скорость выщелачивания.
На производстве теперь пользуются преимущественно циа нистым натрием, а применявшийся ранее цианид кальция признан менее выгодным. Концентрация крепких растворов NaCN 0,03—0,06%, слабых 0,003—0,01%. Первая цифра соответствует 0,3—0,6 г/л, она в 3—6 раз выше теоретически получаемой соответствия растворимости кислорода, а последняя в жесткой местной воде часто в 3 раза ниже теоретической. Главный побочный расход NaCN, без участия кислорода связан с образованием SCN — из дисперсной элементарной серы. Роданидные комплексы золота (I) и примесей сравнительно нестойки при избытке CN — поэтому роданид — бесполезный балласт. Окисление его до (CNS )2 маловероятно и он накапливается в растворе: элементарная сера всегда есть в руде, лежавшей на воздухе, и возникает от разложения сульфидов, по этим причинам затраты цианида могут быть высокими. Помимо того, цианид идет на образование комплексов при взаимодействии с пирротином, сульфидами меди, купритом, гидроокисями цинка, железа (II) и кераргиритом.
Кинетика бактериального окисления и выщелачивания сульфидных минералов
1. Общие сведения о бактериальном чановом выщелачивании.
2. Скорость выщелачивания металлов из минералов.
3. Кинетика бактериально-химического окисления сульфидных минералов.
Дать общие сведения о процессах бактериального выщелачивания и их стадии, скорости выщелачивания металлов из минералов а также о кинетике бактериального окисления и выщелачивания сульфидных минералов.
операция, подготовка, выделение, регенерация, гетерогенный, диффузия, интенсификация, оптимизация, фаза, культура, соотношение, схема, крупность, вскрытия,
1. Бактериальное чановое выщелачивание предназначено главным образом для использования в комбинированных схемах обогащения, в которых наряду с общепринятыми операциями, основанными на физическом разделении свободных минералов, применяются химические (гидрометаллургические) и чисто микробиологические операции, позволяющие решать задачи обработки сложных руд и упорных промежуточных продуктов. В процессе бактериального выщелачивания можно выделить следующие стадии:
Рекомендуемые файлы
1. Подготовка рудного материала к выщелачиванию. К этим
операциям относятся механическая обработка рудного мате-
риала (дробление, измельчение), гравитационное и флотационное обогащение и другие способы концентрирования полезных минералов.
2. Бактериальное выщелачивание — перевод металла из рудного материала или продукта, полученного в результате подготовительных операций, в водный раствор.
3. Разделение твердой и жидкой фаз (сгущение, фильтрация
и промывка).
4. Подготовка растворов к выделению из них чистых соединений или металлов. Это операции очистки растворов от примесей различными методами (осаждение малорастворимых соединений, удаление примесей сорбцией с помощью ионообменных смол, экстракция), концентрирование раствора по извлекаемому компоненту выпаркой, ионным обменом, экстракцией, кристаллизацией.
5. Выделение из растворов чистых соединений или металлов
методами кристаллизации или осаждения малорастворимых
соединений восстановления газообразными реагентами, цементацией или электролизом.
6. Регенерация оборотных растворов с сохранением в них
активной бактериальной культуры или выращивание бактериальной культуры в отдельном узле схемы.
Переработка упорных промпродуктов и некондиционных концентратов отличается от переработки кондиционных концентратов составом сырья и продукции. Для некондиционных продуктов характерно меньшее содержание основного ценного компонента и, как правило, сложность минерального состава, из-за чего переработка их принятыми для кондиционного сырья методами технически или экономически неприемлема. Продуктом переработки некондиционного сырья может быть химический концентрат или несколько селективных продуктов, подлежащих дальнейшей переработке подобно кондиционным концентратам механического обогащения.
При разработке практических схем извлечения металлов необходимо в отличие от всех других методов комбинирования объединить в одном процессе живую и неживую материи и создать оптимальные условия для протекания как химических (электрохимических) реакций, так и микробиологических ферментативных реакций.
Бактериальное выщелачивание с использованием биокатализа является классическим примером исследований на стыке биологии и металлургии. В основе любого процесса лежит рассмотрение двух основных аспектов: термодинамические характеристики процесса, позволяющие определить условия, при которых возможно его осуществление, кинетика и механизм процесса, позволяющие научно обосновать режимы проведения технологических операций, правильно выбрать типы аппаратов и провести их расчет.
2. Выщелачивание представляет собой сложный гетерогенный процесс взаимодействия растворенных реагентов с твердым веществом. Скорость выщелачивания, т. е. количество вещества, переходящее в раствор в единицу времени (или расходуемое в единицу времени количество реагента), зависит от многих факторов: концентрации реагентов, температуры, скорости перемешивания, поверхности твердой фазы и других, и, как правило, непрерывно изменяется в ходе процесса.
Скорость выщелачивания металлов из минералов и других твердых веществ в большинстве случаев определяется не скоростью химических реакций, происходящих на границе твердой и жидкой фаз, а скоростью диффузионных процессов. Это определяется тем, что в таких случаях константа скорости химического взаимодействия минерала с реагентом значительно больше, чем константа скорости диффузии, и поэтому процесс лимитируется подводом реагента к поверхности раздела фаз или отводом продукта реакции, т. е. протекает в диффузионной области. Различают внешнюю и внутреннюю диффузии. Массопередача первой из них лимитируется скоростью диффузии вещества через слой жидкости: у поверхности растворяемого вещества образуется слой раствора концентрацией, почти равной концентрации насыщения, и через него происходит диффузия реагента и растворенных веществ, определяющая скорость процесса выщелачивания в целом.
Механизмы диффузии реагента из толщи раствора к поверхности твердого тела и диффузии через оболочку твердого продукта (внутренняя диффузия), а также состояние диффузионного слоя рассматривает физико-химическая гидродинамика.
Процесс выщелачивания включает три основные стадии: транспорт реагирующих веществ из раствора к поверхности реакции, химическая реакция и транспорт растворимых продуктов реакции от поверхности в объем раствору. Каждая из этих стадий может состоять из нескольких ступеней. Например, стадии транспорта могут включать диффузию через прилегающий к поверхности твердой фазы слой раствора и диффузию через оболочку твердых продуктов реакции или через пористый остаточный слой невыщелачиваемого материала. Реакция между

I-слой раствора, примыкающий к поверхности минерала толщиной, δ1; II — слой твердого продукта реакции с толщиной δ2; III-непрореагировавшая часть выщелачиваемого вещества; Со и Со’ — концентрация соответственно реагента и продукта реакции в растворе; C1 и C1` — концентрация реагента и продукта реакции на границе между минералом и раствором; C2 и C2 — концентрация реагента и продукта реакции на поверхности непрореагировавшей части минерала
жидкостью и твердым веществом развивается от поверхности частиц к их центру, причем до полного завершения выщелачивания в центре остается непрореагировавшей ядро, а на периферии твердый продукт. Модель процесса выщелачивания приведена на рис. 8.1.
В диффузионном слое, непосредственно у растворяемого кристалла, концентрация растворенного вещества приближается к концентрации насыщенного раствора Сн и может быть принята ей равной. Если в толще выщелачивающего раствора концентрация растворенного вещества будет С, скорость диффузии этого вещества будет тем больше, чем больше разница в концентрациях Сн – Со.
Количественно скорость растворения выражается уравнением А. Н. Щукарева:
где dC/dτ — количество вещества, растворяющегося в единицу времени; S — площадь растворяемой поверхности; к — коэффициент, который прямо пропорционален коэффициенту диффузии D растворяемого вещества и обратно пропорционален толщине диффузионного слоя δ,
Таким образом, скорость растворения пропорциональна коэффициенту диффузии растворяемого вещества, поверхности минерала и разности концентраций растворенного вещества у этой поверхности и в толще выщелачивающего раствора.
Скорость выщелачивания имеет наибольшую величину в самом начале процесса и становится равной нулю при Сн= Со, т. е. в насыщенном растворе. При прочих равных условиях скорость растворения прямо пропорциональна поверхности частиц минерала и обратно пропорциональна толщине диффузионного слоя б, которая в значительной мере зависит от физических условий растворения, в частности от условий перемешивания пульпы.
При выщелачивании тонкоизмельченной руды скорость перемешивания имеет меньшее значение, так как зерна руды легко увлекаются вихревым потоком жидкости, и скорость обновления поверхности твердой фазы мало изменяется с увеличением интенсивности перемешивания. Во многих случаях именно скорость диффузии лимитирует скорость растворения.
При выщелачивании с участием газообразного реагента (кислорода воздуха) газ пропускают в виде пузырьков через слой жидкости, причем пузырьки образуются из газовых струек, создаваемых специальными диспергирующими устройствами. Крупность образующихся, газовых пузырьков оказывает большое влияние на скорость растворения газа. От крупности пузырьков в первую очередь зависит суммарная поверхность контакта газ-жидкость. И если скорость выщелачивания ограничена растворением газа, она будет возрастать при увеличении давления газа, скорости его подачи, высоты аппарата и уменьшении крупности пузырьков:
где р — давление газа; р =/KГСН; КГ — константа Генри; Сн — концентрация газа в насыщенном им растворе; q — количество подаваемого газа в единицу времени; Н — высота подъема пузырьков; r— радиус пузырьков газа.
Скорость выщелачивания, в том числе и бактериального, зависит от многих технологических параметров. Целью экспериментального изучения кинетики выщелачивания является отыскание оптимальных условий проведения процесса.
До начала эксперимента лимитирующая стадия неизвестна, поэтому скорость процесса описывают формально-кинетическим уравнением, которое для необратимой химической реакции имеет вид
где — dS/dτ — скорость уменьшения выщелачиваемого материала в твердой фазе; к — константа скорости реакции; Р-концентрация реагента в растворе в момент времени τ; п — порядок реакции по реагенту; ψ(S)-функция, учитывающая величину поверхности и изменение скорости, обусловленное уменьшением поверхности, нарастанием твердой оболочки и т. д.
При изучении кинетики экспериментально определяют зависимость степени выщелачивания от продолжительности процесса при различных условиях, определяют основные кинетические параметры (порядок реакции, константу скорости, лимитирующую стадию). Полученное уравнение скорости процесса затем можно использовать при выборе аппаратурного оформления и для оптимизации технологии.
Сложность описания процесса бактериального выщелачивания состоит в том, что необходимо увязать закономерности протекания химических гетерогенных реакций с кинетическими закономерностями ферментативного катализа.
3. Бактериально — химическое окисление и выщелачивание сульфидных минералов представляет собой гетерогенный процесс взаимодействия растворенных реагентов (экзометаболитов бактерий) и самих бактерий с твердым веществом – сульфидным минералом. Оно включает стадии транспорта реагирующих веществ к поверхности минералов и продуктов реакции от них, а также стадию биохимических реакций, протекающую при участии многочисленных клеток на поверхности и внутри их ферментов. Если кинетика первой стадии подчиняется законам диффузии, то вторая — законам ферментативной кинетики. Имеющиеся в настоящее время данные позволяют предположить, что процесс бактериального окисления сульфидных минералов, проводимый в аппаратах интенсивного перемешивания, протекает в кинетической области. Во-первых, процесс характеризуется отсутствием признаков, обязательных для внешней и внутренней диффузии, и скорость бактериального окисления не зависит от условий перемешивания пульпы. Во-вторых, скорость окисления железа, серы и сульфидных минералов сильно зависит от температуры. Значение температурного коэффициента Q10 при бактериальном окислении сульфидов в реакторах с механическим перемешиванием, равно 2-3, что по правилу Вант-Гоффа характерно для реакций, протекающих в кинетической области.
Определенную трудность при исследовании ферментативной кинетики окисления сульфидных минералов представляет выбор субстрата – минерала, по которому будут рассчитываться основные кинетические константы. В каждом отдельном случае на основе предварительных опытов и термодинамических расчетов определяется наименее устойчивый минерал в ряду селективности при бактериальном окислении этих минералов. При окислении мышьяковистых концентратов основной и наиболее легко окисляемый субстрат представлен арсенопиритом FeAsS. Для упрощения расчетов за концентрацию субстрата S принимается масса сульфидного мышьяка в твердой фазе в пересчете на объем раствора. При выщелачивании, например, медно-цинковых концентратов расчет осуществлялся по меди и цинку.
Результаты расчета порядка реакции по субстрату при окислении мышьяксодержащих концентратов бактериями А.ferrooxidans при концентрации биомассы в пульпе 2,5 г/л по сухой массе клеток по начальным скоростям реакции при различных концентрациях выщелачиваемого субстрата показали, что для реакции n –ного порядка в начальный момент времени скорость окисления равна:



Порядок реакции определяется по уравнению, полученному после логарифмирования уравнения:

Для описания кинетики ферментативных реакций обычно используется уравнение ферментативного катализа Михаэлиса- Ментен:
V = Vmax· S / (S + km), 
Где V – скорость ферментативной реакции,
S – концентрация субстрата,
km – константа Михаэлиса – Ментен.
Уравнением Михаэлиса – Ментен удобно пользоваться при изучении сравнительно простых ферментативных реакций методом начальных скоростей, например, при бактериальном окислении закисного железа. Однако полные кинетические кривые, когда учитывается накопление продуктов окисления и уменьшение концентрации субстрата, содержат гораздо больше информации, чем в значении скорости, экстраполированной к начальному моменту времени. Для получения точных значений кинетических параметров должно соблюдаться основное условие – общая концентрация субстрата не должно меняться в течение опыта, т.е. не должно происходить заметного изменения плотности популяции клеток, что достигается при большой их концентрации.
Вопросы для повторения:
1. Перечислите на какие стадии делится процесс бактериального
2. От каких факторов зависит скорость выщелачивания?
3. Как определяется скорость выщелачивания металлов из минералов?
4. Перечислите три основные стадии процесса выщелачивания?
5. Опишите схематическую модель процесса выщелачивания?
6. Каким уравнением выражается скорость растворения вещества?
7. С какой целью изучается кинетика выщелачивания экспериментально?
8. Объясните закон ферментативной кинетики ?
9. Опишите уравнение Михаэлиса – Ментена для ферментативного катализа?
Предмет: «Биотехнологические процессы в металлургии»
Преподаватель: доц. Абдурахманов Э.
Количество студентов и курс: 48 студентов, 4 курс
Продолжительность занятия: 80 минут
Кинетика бактериального окисления и Выщелачивания сульфидных минералов
Цель: Дать общие сведения о процессах бактериального выщелачивания и их стадии, скорости выщелачивания металлов из минералов а также о кинетике бактериального окисления и выщелачивания сульфидных минералов.
— — Развить интерес студентов к данной теме, формирование знаний и навыков по теме и их расширение.
— — Контроль степени освоения темы с помощью групповой полемики и полемики каждого участника группы, дискуссии на основании, «Смысл понятие» оценка их знаний.
Содержание учебного процесса
Общие сведения о бактериальном чановом выщелачивании. Скорость выщелачивания металлов из минералов. Кинетика бактериально-химического окисления сульфидных минералов
Применяемая в учебном процессе технология.
Метод: Устное обсуждение, технология “Знакомство”, “Смысл понятие”.
Форма: Лекция — дискуссия, работа среди групп и с каждым участником.
Средство: Объяснение устно, «Мозговой штурм»,Устное общение и дискуссия
Контроль: Устный контроль, вопрос-ответ, наблюдение, самостоятельный котнроль друг за другом.
Оценка: Стимуляция интереса, рейтинговая оценка на основании технологии “Блиц-опрос”.
Преподаватель: Стимулирует интерес студентов к данной теме, повышает активность студентов. Увеличиваеи заинтересованность присутствующих на занятии студентов. Производится оценка знаний всех студентов на занятии. Достигают целей, поставленных самими себе. Достигается развитие таких свойств характера, как независимая работа, творческое мышление, обсуждение идей.
Студент: Освоение новых знаний. Укрепляет теоретические знания. Изучает работу в группах и одиночно. Развивает авторитетность и способность демонстрировать. Развивает самостоятельный контроль.
Планы на будущее (анализ, изменения)
Преподаватель: Примененение и совершенствование подходящих к теме учебного занятия новых педагогических технологий. Работа над собой. Проработка темы, а также применение опыта зарубежных стран на основании сведений из Интернета. Увеличение педагогического мастерства.
Студент: Формирование навыков самостоятельной работы, своевременное и правильное использование сведений из Интернета. Укрепление своих способностей и таланта в достаточно полной мере при творческом подходе к теме.
Технология «Смысл понятие»
Вместе с этой лекцией читают «Шкалы измерения».
Формально кинетическое уравнение скорости выщелачивания
Изучение кинетики выщелачивания концентрата данбурита минеральными кислотами
Мирсаидов Ульмас Мирсаидович,
доктор химических наук, профессор, научный руководитель,
Маматов Эргаш Джумаевич,
кандидат технических наук, докторант,
Ашуров Наимджон Амонкулович,
кандидат технических наук.
Институт химии им. В.И.Никитина АН Республики Таджикистан.
Представлены результаты изучение кинетики выщелачивания данбуритового концентрата минеральными кислотами.
Завод генераторов, склад, монтаж
бездепозитный бонус за регистрацию
Проблема переработки производственных отходов, в том числе выбросов, является одной из актуальных задач промышленности. На производственном предприятии АООТ «Таджикхимпром» при электролизе поваренной соли попутно выделяется абгазная соляная кислота, а для сушки газообразного хлора применяют серную кислоту. Отработанная серная и попутно получаемая соляная кислота низкой концентрации в дальнейшем не находят применения, их нейтрализуют известняком и выбрасывают в шламонакопители. В последнее время отмечается тенденция использования отходов производства взамен более дорогостоящих материалов в технологических процессах 3. В процессе выщелачивания концентрата данбурита используемые минеральные кислоты являются отходом данного производства. В этом плане представляло интерес исследование процесса выщелачивания концентрата данбурита.
Кинетику выщелачивания концентрата данбурита проводили в термостатированном реакторе с мешалкой при соотношении Т:Ж =1:10 при концентрации минеральных кислот: 20%-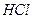
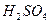
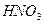
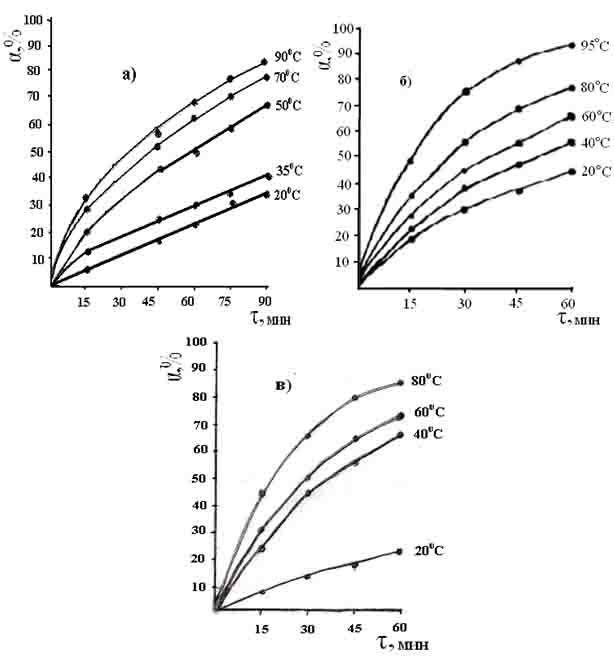
Результаты экспериментальных данных кинетики извлечения оксида бора из обожженного данбуритового концентрата для серно-, азотно- и солянокислотного выщелачивания приведены на рис. 1 и 2.
В первом приближении кинетические кривые выщелачивания концентрата данбурита минеральными кислотами удовлетворительно описываются уравнением:
где: α- степень извлечения оксида бора; τ — время (мин); К — константа скорости реакции разложения концентрата данбурита для каждого процесса выщелачивания, мин -1 [6].
Между энергией активации (Е), температурой (Т) и константой скорости реакции (К) существует зависимость, выражаемая уравнением Аррениуса:
К = Ко· е -Е/RT = 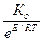
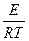
где: е — основание натуральных логарифмов, Ко— предэкспоненциальный коэффициент, R – универсальная газовая постоянная, КДж/моль, град; Т – абсолютная температура, °К.
Для различных интервалов температуры были рассчитаны значения констант скорости (К) и найдены их средние значения (Кср).
Зависимость кинетических кривых сернокислотного разложения данбурита показывает, что высокий выход продукта, прямо пропорционален концентрации серной кислоты, температуры и, до определенного предела концентрации [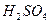
Экспериментальные данные кинетики извлечения оксида бора из состава концентрата данбурита при сернокислотном разложении получены в интервале температур 20-90 0 С и продолжительности процесса от 15 до 90 мин (рис. 1.а.).
Из характера кинетических кривых разложения концентрата данбурита серной кислотой видно, что целесообразно проводить процесс в течение 90 мин и температуре 90 0 С, где переход оксида бора в раствор составляет 83.9%.
При построении графика зависимости lg1/(1-α) от времени все экспериментальные точки при различных температурах и процессах выщелачивания удовлетворительно укладываются на прямую линию и имеют отрицательный наклон.
Данные кинетики извлечения оксида бора из состава обожженного данбуритового концентрата при азотнокислотном разложении получены в интервале температур 20-95ºС и продолжительности процесса от 15 до 60 мин (рис. 1.б.).
Характер кинетических кривых разложения указывает на то, что в течение 60 мин при температуре 95ºС достигается 92.9%-ное извлечение оксида бора.
) 290 до 120миню из состава е Кинетические кривые свидетельствуют о том, что при повышении температуры извлечение оксида бора из состава обожженного концентрата данбурита значительно возрастает.
Экспериментальные данные зависимости извлечения оксида бора для солянокислотного разложения, изучены при температурах 20-80 0 С и продолжительности процесса от 15 до 60 мин (рис. 1.в.). Как видно, с повышением температуры извлечение оксида бора из состава концентрата данбурита постепенно увеличивается от 24.1 до 86.8%.
Рис. 1. Кинетические кривые выщелачивания концентрата данбурита серной (а), азотной (б), и соляной (в) кислотами.
Для выявления механизма реакции взаимодействия концентрата данбурита с минеральными кислотами была предпринята попытка определения лимитирующей стадии скорости процесса выщелачивания. Процесс взаимодействия зёрен (частиц) концентрата данбурита с раствором минеральных кислот, можно разделить на несколько последовательных стадий, основными из которых являются:
— перенос ионов водорода через слой пленки окружающей зерна концентрата данбурита к его поверхности (фазовая или внешняя диффузия);
— перенос ионов водорода внутри зерен концентрата к точке обмена фиксированных ионов (внутренняя диффузия);
— взаимодействие ионов водорода с зернами концентрата данбурита, т.е. ионообменный процесс.
Кроме внешней и внутренней диффузии, а также диффузионного переноса ионов водорода, на скорость разложения может оказывать решающее влияние и диффузия вытесняющего иона кислоты из объема раствора к зерну концентрата данбурита, окруженному неподвижной пленкой раствора.
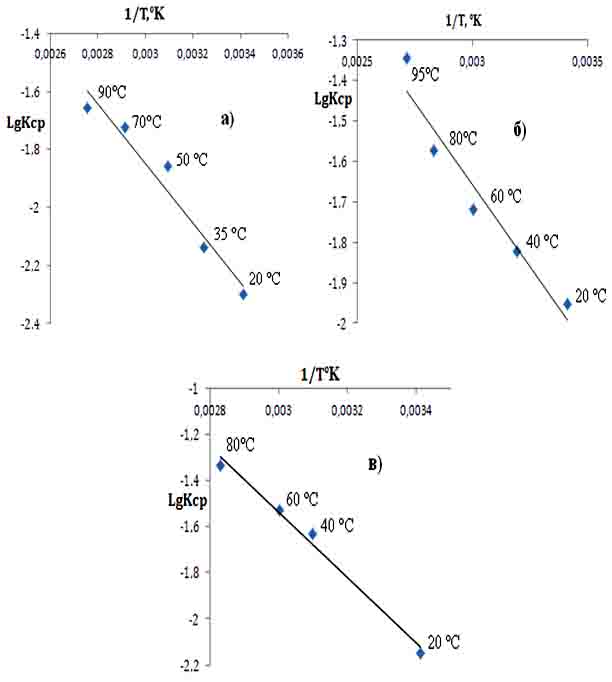
С целью определения стадии лимитирующей скорость процесса разложения, была проведена соответствующая обработка кинетических кривых, результаты которой приведены на рис. 2.
Доказательством того, что лимитирующей стадией процесса разложения является внешняя диффузия (поверхность соприкосновения фаз, концентрация кислоты и соотношение Ж:Т), служит прямолинейная зависимость в координатах LgKср – 1/Т и их взаимодействие контролируется именно диффузионным процессом как функция от времени.
Зависимость LgКср от обратного значения абсолютной температуры для процесса сернокислотного разложения подчиняется корреляционному уравнению LgKср = -1420,1*(1/Т) + 2,7219 при значении коэффициента корреляции R 2 = 0,9869 (рис. 2.а.). Как видно, полученные экспериментальные точки при различных температурах удовлетворительно укладываются на прямую линию Аррениуса, по наклону которой вычислена величина кажущейся энергии активации для процесса сернокислотного разложения концентрата данбурита.
Рис. 2. Зависимость LgKср – 1/Т для процесса выщелачивания концентрата данбурита серной (а), азотой (б) и соляной (в) кислотами.
Рассчитано также значение энергии активации для процесса азотнокислотного разложения данбуритового концентрата и установлено, что зависимость LgKср – 1/Т подчиняется корреляционному уравнению LgKср = -813,89*(1/Т) +0,7855 при значении коэффициента корреляции R² = 0,9333 (рис. 2.б.) . Экспериментальные точки, полученные при температурах от 20 до 95°С удовлетворительно укладываются на прямую Аррениуса. Для определения энергии активации строили график зависимости lgk от 1/Т, при этом получена прямая линия, по наклону которой вычислена величина кажущейся энергии активации процесса азотнокислотного разложения.
Данные эксперимента процесса солянокислотного разложения данбуритового концентрата при температурах 20-80°С и зависимость LgKср – 1/Т подчиняется корреляционному уравнению LgKср = -1025,4 *(1/Т) + 1,2285 при значении коэффициента корреляции R² = 0,9498 .
Изменение константы скорости разложения концентрата данбурита соляной кислотой от температуры процесса подчиняется закону Аррениуса, что подтверждается прямолинейной зависимостью lgК от 1/Т, по наклону которой вычислена величина кажущейся энергии активации (рис. 2.в.).
Численные значения величины энергии активации для процессов выщелачивания концентрата данбурита равны (кДж/моль): для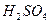
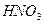
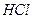
Таким образом, скорость разложения концентрата данбурита минеральными кислотами при всех изученных температурах осуществляется в смешанно-диффузионном режиме близко к кинетической, т.е. разложения контролируется одновременно диффузией ионов водорода в растворе и диффузией в зерне (зависить от размера частиц) концентрата данбурита.
1. Рузиев Д.Р., Азизов Б.С., Сафиев Х.С., Раджабов Ф. Магнитная сепарация углерод-криолитного отсева отходов производства алюминия // Доклады АН РТ – Душанбе. — 1996. — Т.39. – № 1-2. -С.47-51.
2. Рузиев Д.Р., Азизов Б.С., Сафиев Х.С., Раджабов Ф. Сушка криолит-глиноземсодержащего концентрата, полученного из отходов алюминиевого производства // Доклады АН РТ – Душанбе. — 1996.-Т.39. — №11-12. -С.58-63.
3. Зинченко З.А., Соколов Е.С., Рузиев Д.Р., Азизов Б.С, Раджабов Ф. Получение криолит-глиноземной смеси из углерод-, фторсодержащих отходов производства алюминия. Деп. В НПИ Центре. 1998 г. .№48(1192). – Душанбе. -8с.
4. Зинченко З.А., Соколов Е.С., Рузиев Д.Р., Азизов Б.С. Получение криолит-глиноземной смеси из отсева свалки твердых отходов (СТО) Деп. В НПИ Центре. 1998 г. .№49(1193). – Душанбе. -10с.
5. Алимарин М.П., Ромм М.И. Методика определения бора в силикатных минералах и борных породах. – М.-Л.: Гостехиздат, 1932.
6. Эммануэль Н.М., Кнорре Д.Г. Курс химической кинетики. – М.: Высшая школа, 1974. — 400 с.
http://studizba.com/lectures/129-inzhenerija/1827-biotehnologicheskie-processy-v-metallurgii/35860-9-kinetika-bakterialnogo-okislenija-i-vyschelachivanija-sulfidnyh-mineralov.html
http://jurnal.org/articles/2012/chem13.html