Урок 14. Расчеты по уравнениям химических реакций
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
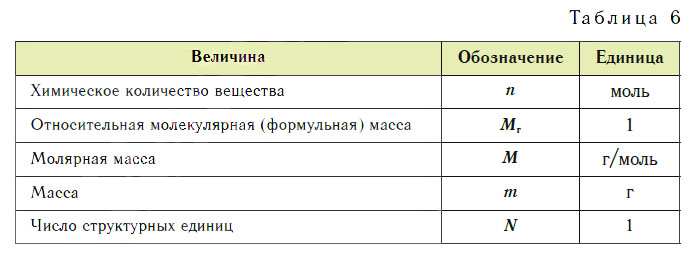
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо масс о й 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
Формулы расчеты по химическим уравнениям
Урок посвящен закреплению умений производить расчеты по уравнению реакции с учетом количественных соотношений участников реакции.
I. Алгоритмы решения задач по уравнению химических реакций
Внимательно изучите алгоритмы и запишите в тетрадь, решите самостоятельно предложенные задачи
- Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4Al +3O2=2Al2O3).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода (4Na+O2=2Na2O).
Алгоритм №1
Вычисление количества вещества по известному количеству вещества, участвующего в реакции
Пример. Вычислите количество вещества кислорода, выделившегося в результате разложения воды количеством вещества 6 моль.
Последовательность выполнения действий
1. Записать условие задачи
2. Вычислить молярные массы веществ,
о которых, идёт речь в задаче
3. Запишем уравнение реакции
и расставим коэффициенты
4. Над формулами веществ запишем
количества веществ из условия задачи,
а под формулами –
стехиометрические коэффициенты,
отображаемые уравнением реакции
5. Для вычисления искомого количества вещества,
6. Записываем ответ
- Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2=SO2).
2. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2Li+Cl2=2LiCl).
Алгоритм №2
Вычисление массы вещества по известному количеству другого вещества, участвующего в реакции
Пример: Вычислите массу алюминия, необходимого для получения оксида алюминия количеством вещества 8 моль.
Последовательность выполнения действий
Оформление решения задачи
1. Записать условие задачи
2. Вычислить молярные массы веществ,
о которых, идёт речь в задаче
3. Запишем уравнение реакции
и расставим коэффициенты
4. Над формулами веществ запишем
количества веществ из условия задачи,
а под формулами –стехиометрические коэффициенты, отображаемые уравнением реакции
5. Вычислим количества вещества, массу которого требуется найти. Для этого составим соотношение.
6. Вычисляем массу вещества, которую требуется найти
7. Записываем ответ
- Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2Na+S=Na2S).
2. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г (CuO + H2 = Cu + H2O).
Алгоритм №3
Вычисление количества вещества по известной массе другого вещества, участвующего в реакции
Пример. Вычислите количество вещества оксида меди (I), если в реакцию с кислородом вступает медь массой 19,2г.
Последовательность выполнения действий
1. Записать условие задачи
2. Вычислить молярные массы веществ, о которых, идёт речь в задаче
3. Найдём количество вещества, масса которого дана в условии задачи
4. Запишем уравнение реакции
и расставим коэффициенты
5. Над формулами веществ запишем
количества веществ из условия задачи, а под формулами –стехиометрические коэффициенты, отображаемые уравнением реакции
6. Для вычисления искомого количества вещества, составим соотношение
7. Запишем ответ
- Используя алгоритм, решите самостоятельно задачу:
1. Вычислите массу кислорода, необходимую для реакции с железом массой 112 г (3Fe + 4O2=Fe3O4).
Алгоритм №4
Пример. Вычислите массу кислорода, необходимую для сгорания фосфора, массой 0,31г.
Последовательность выполнения действий
1. Записать условие задачи
2. Вычислить молярные массы веществ,
о которых, идёт реь в задаче
3. Найдём количество вещества, масса которого дана в условии задачи
4. Запишем уравнение реакции и расставим коэффициенты
5. Над формулами веществ запишем
количества веществ из условия задачи, а под формулами –стехиометрические коэффициенты, отображаемые уравнением реакции
6. Вычислим количества вещества, массу которого необходимо найти
7. Найдем массу вещeства, которую требуется вычислить
8. Запишем ответ
II. Задачи для самостоятельного решения
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4Al +3O2=2Al2O3).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода (4Na+O2=2Na2O).
3. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2=SO2).
4. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2Li+Cl2=2LiCl).
5. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2Na+S=Na2S).
6. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г (CuO + H2 = Cu + H2O).
Практические занятия № 1,2. Расчеты по химическим формулам и уравнениям
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Практические занятия № 1,2.
Расчеты по химическим формулам и уравнениям
Цель работы: закрепление знаний по основным химическим понятиям и законам.
Оборудование: Периодическая система химических элементов Д.И.Менделеева.
1.1. Определение молярной массы вещества:
б) оксида кальция (СаО)
в) гидроксида железа( III )( Fe ( OH ) 3 )
г) кремниевой кислоты ( H 2 SiO 3 )
д) фосфата натрия ( Na 3 PO 4 ).
1.2. Определение количества вещества по его массе:
а) азота ( N 2 ), масса которого 7 г
б) оксида натрия ( Na 2 O ), масса которого 3,1г
в) гидроксида кальция ( Ca ( OH ) 2 ), масса которого 3,7 г
г) серной кислоты ( H 2 SO 4 ), масса которой 4,9 г
д) нитрата серебра ( AgNO 3 ), масса которого 0,85 г
1.3. Определение количества вещества по его объему:
а) кислорода ( O 2 ), объем которого 2, 24 л
б) аммиака (Н 3 N ), объем которого 448 л
в) диоксида углерода (СО 2 ), объем которого 6,72л
г) метана (СН 4 ), объем которого 4,48 л
д) сероводорода (Н 2 S ), объем которого 3,36 л.
1.4. Определение относительной плотности одного газа по другому:
a ) диоксида серы ( S О 2 ) по водороду (Н 2 );
6) аммиака ( NH 3 ) по кислороду (О 2 );
в) метана (СН 4 ) по азоту ( N 2 );
г) этана ( С 2 Н 4 ) по воздуху ( M(возд.) = 29 г/моль );
д) ацетилена (С 2 Н 2 ) по хлору (M(Cl 2 )=71 г/моль).
1.5. Вычислите массовую долю элементов (%) в веществе: в гидроксиде натрия ( NaOH ).
2.1 . Определите массу нитрата серебра (AgNO 3 ), необходимого для получения осадка массой 28,7 г хлорида серебра (AgCl) при взаимодействии с избытком хлороводородной (соляной) кислоты (HCl).
2.2. Какой объем газа (Н 2 ) выделится (при н.у.) при взаимодействии 5,4 г алюминия ( Al ) с избытком раствора серной кислоты ( H 2 SO 4 ).
Основные формулы и уравнения реакций:
1.1.Определение молярной массы: а) кислорода (О 2 ): M (О 2 ) = 2 A ( O ) = 2 
б) оксида натрия ( Na 2 O ): M ( Na 2 O ) = 2 

в ) серной кислоты ( Н 2 SO 4 ): M(H 2 SO 4 )= 2 


г) гидроксида бария (Ва(ОН) 2 ): M (Ва(ОН) 2 ) = A ( Ba ) + 2 

1.2. Определите количество вещества: а) иодида натрия( NaI ),масса которого равна 90 г: 1) М ( NaI ) = A ( Na ) + A ( I ) = 23 + 127 = 150 г/моль,
2) ν ( NaI ) = 

б) серы( S ), масса которой 1,6 г: 1) М ( S ) = A ( S ) = 32 г/моль,
2) ν (S) = 

1.3. Определите количество вещества : а) водорода (Н2), объем которого 44,8 л: ν (Н2) = 

б) хлороводорода (Н Cl ), объем которого 3,36 л: ν (Н Cl ) = 

1.4. Определение относительной плотности одного газа по другому:
а) водороду : M (С 2 Н 6 ) = 2 



M ( H 2 ) =2 

D H 2 (С 2 Н 6 ) = 

б) кислороду : M (О 2 ) = 2 

D О2 (С 2 Н 6 ) = 

в) азоту : M ( N 2 ) = 2 

D N 2 (С 2 Н 6 ) = 

1) определяем молярную массу вещества: M ( X a Y b Z c )= aA ( X )+ bA ( Y )+ cA ( Z );
2) определение массовой доли элемента X в веществе ( X a Y b Z c ):
W(X) = 

3) определение массовой доли элемента Y в веществе ( X a Y b Z c ):
W(Y) = 

4) определение массовой доли элемента Z в веществе ( X a Y b Z c ):
W ( Z ) = 
2.1. Определение массы продукта реакции (исходного вещества) по массе исходного вещества (продукта реакции):
ν : 1 моль 1 моль
M : . г/моль . г/моль
2.2. Определение объема продукта реакции по массе исходного вещества:
M : . г/моль V m . л/моль
Практические занятия № 1,2.
Расчеты по химическим формулам и уравнениям.
Цель работы: закрепление знаний по основным химическим понятиям и законам.
Оборудование: Периодическая система химических элементов Д.И.Менделеева.
1.1. Определение молярной массы вещества:
б ) оксида магн ия ( Mg О)
в) гидроксида алюминия ( Al ( OH ) 3 )
г) угольной кислоты ( H 2 CO 3 )
д) нитрата железа ( III ) ( Fe ( NO 3 ) 3 ).
1.2. Определение количества вещества по его массе:
а) брома ( Br 2 ), масса которого 20 г
б) сероводорода (Н 2 S ), масса которого 3,4 г
в) гидроксида бария ( Ba ( OH ) 2 ), масса которого 1,71 г
г) азотной кислоты ( HNO 3 ), масса которой 1,26 г
д) сульфита калия (К 2 S О 3 ), масса которого 7,9 г
1.3. Определение количества вещества по его объему:
а) азота ( N 2 ), объем которого 33,6 л
б) водяного пара (Н 2 О), объем которого 16,8 л
в) диоксида серы ( SO 2 ), объем которого 1,12 л
г) ацетилена (С 2 Н 2 ), объем которого 168 л
д) метаналя ( CH 2 O ), объем которого 5,6 л.
1.4. Определение относительной плотности одного газа по другому:
а) оксида углерода ( II ) ( СО) по водороду (Н 2 );
б) диоксида азота ( N 0 2 ) по кислороду (О 2 );
г) этаналя ( С 2 Н 4 O ) по воздуху ( M(возд.) = 29 г/моль );
д) триоксида серы (SO 3 ) по хлору (M(Cl 2 )=71 г/моль).
1.5. Вычислите массовую долю элементов (%) в веществе: в гидроксиде лития ( LiOH ).
2.1. Какая масса хлорида бария требуется для превращения 19,6 г серной кислоты в сульфат бария?
2.2. Какой объем оксида серы (IV) выделится (при н.у.) при взаимодействии 25,2 г сульфита натрия с избытком хлороводородной (соляной) кислоты?
Основные формулы и уравнения реакций:
1.1.Определение молярной массы: а) кислорода (О 2 ): M (О 2 ) = 2 

б) оксида натрия ( Na 2 O ): M ( Na 2 O ) = 2 

в ) серной кислоты ( Н 2 SO 4 ): M(H 2 SO 4 )= 2 



г) гидроксида бария (Ва(ОН) 2 ): M (Ва(ОН) 2 ) = A ( Ba ) + 2 

1.2. Определите количество вещества: а) иодида натрия( NaI ),масса которого равна 90 г: 1) М ( NaI ) = A ( Na ) + A ( I ) = 23 + 127 = 150 г/моль,
2) ν ( NaI ) = 

б) серы( S ), масса которой 1,6 г: 1) М ( S ) = A ( S ) = 32 г/моль,
2) ν (S) = 

1.3. Определите количество вещества : а) водорода (Н2), объем которого 44,8 л: ν (Н2) = 

б) хлороводорода (Н Cl ), объем которого 3,36 л: ν (Н Cl ) = 

1.4. Определение относительной плотности одного газа по другому:
а) водороду : M (С 2 Н 6 )=2 



M ( H 2 ) =2 

D H 2 (С 2 Н 6 ) = 

б) кислороду : M (О 2 ) = 2 

D О2 (С 2 Н 6 ) = 

в) азоту : M ( N 2 ) = 2 

D N 2 (С 2 Н 6 ) = 

1) определяем молярную массу вещества: M ( X a Y b Z c )= aA ( X )+ bA ( Y )+ cA ( Z );
2) определение массовой доли элемента X в веществе ( X a Y b Z c ):
W(X) = 

3) определение массовой доли элемента Y в веществе ( X a Y b Z c ):
W(Y) = 

4) определение массовой доли элемента Z в веществе ( X a Y b Z c ):
W ( Z ) = 
2.1. Определение массы продукта реакции (исходного вещества) по массе исходного вещества (продукта реакции): Х г 19,6 г
ν: 1 моль 1 моль
M : . г/моль . г/моль
2.2. Определение объема продукта реакции по массе исходного вещества:
M : . г/моль V m . л/моль
Ответы на задания 1 — го варианта:
1. 1 а) M (Н 2 ) = 2 

б) M ( CaO ) = А( Ca ) + A ( O ) = 40 + 16 = 56 г/моль;
в) M ( Fe ( OH ) 3 ) = А( Fe ) + 3 

г) M ( H 2 SiO 3 ) = 2 



д ) M (Na 3 PO 4 ) = 3 



1.2. а) M ( N 2 ) = 2 

ν ( N 2 ) = 

б) M ( Na 2 O ) = 2 

ν ( Na 2 O ) = 

в) M ( C а(ОН) 2 ) = A ( Ca ) + 2 

ν ( Ca ( OH ) 2 ) = 

г ) M(H 2 SO 4 )= 2 



ν ( H 2 SO 4 ) = 

д ) M(AgNO 3 ) = A(Ag) + A(N) + 3 

ν ( AgNO 3 ) = 

1.3. а) ν ( O 2 ) = 

б) ν ( NH 3 ) = 

в) ν ( CO 2 ) = 

г) ν ( CH 4 ) = 

д) ν ( H 2 S ) = 

1.4. а ) D H2 (SO 2 ) = 

б ) D O2 (H 3 N) = 

в) D N 2 ( CH 4 ) = 

г) D возд ( C 2 H 4 ) = 

д ) D Cl2 (C 2 H 2 ) = 

1.5. M(N аОН ) = A(Na) + A (O) + A(H) = 23 + 16 +1 = 40 г / моль .,
W(Na) = 



W(O) = 



W(H) = 100 % — (W(Na) + W(O)) = 100 % — (57,5 %+ 40 %) = 2,5 %.
Ответ : W(Na) = 57,5 %; W(O) = 40 %; W(H) = 2,5 %.
ν : 1 моль 1 моль
M : 170 г/моль 143,5г/моль
m : 170 г 143,5 г
х = m ( AgNO 3 ) = 170 
ν : 2 моль 3 моль
M : 27 г/моль V m 22,4 л/моль
m : 54 г V 67,2 л
Х = V ( H 2) = 5,4 
Ответы на задания 2 — го варианта:
1.1 а) M ( N 2 ) = 2 

б) M ( MgO ) = А( Mg ) + A ( O ) = 24 + 16 = 40 г/моль;
в) M ( Al ( OH ) 3 ) = А( Al ) + 3 

г) M ( H 2 CO 3 ) = 2 



д ) M (Fe(NO 3 ) 3 ) = A(Fe) + 3 



1.2. а) M ( Br 2 ) = 2 

ν ( Br 2 ) = 

б ) M (H 2 S) = 2 

ν ( H 2 S ) = 

в ) M(B а ( ОН ) 2 ) = A(Ba) + 2 

ν (Ba(OH) 2 ) = 

г ) M(HNO 3 )= A(H) +A(N)+3 

ν ( HNO 3 ) = 

д ) M(K 2 SO 3 ) = 2 



ν ( K 2 SO 3 ) = 

1.3. а) ν ( N 2 ) = 

б) ν ( H 2 O ) = 

в) ν ( SO 2 ) = 

г) ν ( C 2 H 2 ) = 

д) ν ( CH 2 O ) = 

1.4. а) D H 2 (С O ) = 

б ) D O2 (NO 2 ) = 

в) D N 2 ( C 2 H 6 ) = 

г) D возд ( C 2 H 4 O ) = 

д ) D Cl2 (SO 3 ) = 

1.5. M(Li ОН ) = A(Li) + A (O) + A(H) = 7 + 16 +1 = 24 г / моль .,
W(Li) = 



W(O) = 



W(H) = 100 % — (W(Na) + W(O)) = 100 % — (29,17 %+ 66,67 %) = 3,63 %.
Ответ : W(Na) = 29,17 %; W(O) = 66,67%; W(H) = 3,63 %.
ν : 1 моль 1 моль
M : 208 г/моль 98 г/моль
Х = m ( BaCl 2 ) = 208 
ν : 1 моль 1 моль
M : 126г/моль V m .22,4 л/моль
m : 126. г V 22,4 л
Х = V ( SO 2 ) = 25,2 
http://kardaeva.ru/88-dlya-uchenika/8-klass/126-8klass-2-5-6
http://infourok.ru/prakticheskie-zanyatiya-rascheti-po-himicheskim-formulam-i-uravneniyam-683079.html