Структура фосфата кальция (Ca3 (PO4) 2), свойства, образование и использование
фосфат кальция неорганическая и третичная соль, химическая формула которой Ca3(РО4)2. Формула утверждает, что состав этой соли составляет 3: 2 для кальция и фосфата, соответственно. Это можно увидеть непосредственно на нижнем изображении, где показан катион Ca 2+ и анион ПО4 3- . На каждые три КА 2+ Есть два ПО4 3- взаимодействуя с ними.
С другой стороны, фосфат кальция относится к ряду солей, которые варьируются в зависимости от соотношения Ca / P, а также от степени гидратации и pH. На самом деле существует много типов фосфатов кальция, которые существуют и могут быть синтезированы. Однако, буквально следуя номенклатуре, фосфат кальция относится только к трикальцию, упомянутому выше..
Все фосфаты кальция, включая Са3(РО4)2, Они однотонные с легкими сероватыми тонами. Они могут быть зернистыми, мелкими, кристаллическими и иметь размеры частиц около микрометров; и даже были получены наночастицы этих фосфатов, с помощью которых были разработаны биосовместимые материалы для костей..
Эта биосовместимость связана с тем, что эти соли находятся в зубах и, короче, в костных тканях млекопитающих. Например, гидроксиапатит представляет собой кристаллический фосфат кальция, который, в свою очередь, взаимодействует с аморфной фазой той же соли.
Это означает, что существуют аморфные и кристаллические фосфаты кальция. По этой причине разнообразие и множество вариантов не удивительны при синтезе материалов на основе фосфатов кальция; материалы, свойства которых исследователи интересуются каждый день во всем мире, чтобы сосредоточиться на восстановлении костей.
- 1 Структура фосфата кальция
- 1.1 Аморфный фосфат кальция
- 1.2 Остальная часть семьи
- 2 Физические и химические свойства
- 2.1 Имена
- 2.2 Молекулярный вес
- 2.3 Физическое описание
- 2.4 Вкус
- 2.5 Точка плавления
- 2.6 Растворимость
- 2.7 Плотность
- 2.8 Показатель преломления
- 2.9 Стандартная энтальпия тренировки
- 2.10 Температура хранения
- 2,11 рН
- 3 Обучение
- 3.1 Нитрат кальция и гидрофосфат аммония
- 3.2 Гидроксид кальция и фосфорная кислота
- 4 использования
- 4.1 В костной ткани
- 4.2 Биокерамические цементы
- 4.3 Врачи
- 4.4 Другое
- 5 ссылок
Структура фосфата кальция
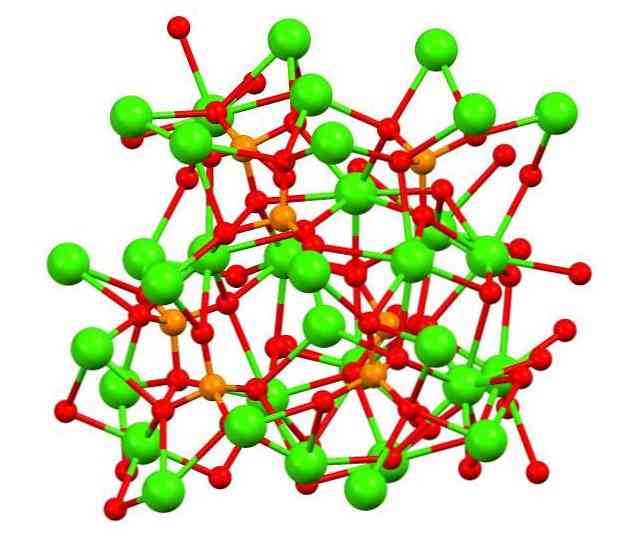
Верхнее изображение показывает структуру трехосновного каликофосфата в странном минерале whitlockite, который может содержать магний и железо в качестве примесей.
Хотя на первый взгляд это может показаться сложным, необходимо уточнить, что модель предполагает ковалентное взаимодействие между атомами кислорода фосфатов и металлическими центрами кальция.
В порядке представления это действительно, однако, взаимодействия являются электростатическими; катионы Са 2+ привлекаются к анионам ПО4 3- (Са 2+ — O-PO3 3- ). Имея это в виду, понятно, почему на изображении кальций (зеленые сферы) окружен отрицательно заряженными атомами кислорода (красные сферы).
Когда есть так много ионов, это не оставляет симметричное расположение или образец видимым. Ca3(РО4)2 Принимает при низких температурах (Т — и HPO4 2- в АШП. Эти ионы образуются при гидролизе одного из фосфатов:
В результате истинная структура АШП становится более сложной, состав ее ионов которой представлен формулой: Ca9(РО4)6-х(HPO4)х(ОН)х. «Х» указывает на степень гидратации, так как если х = 1, то формула будет такой: Ca9(РО4)5(HPO4) (ОН).
Различные структуры, которые могут иметь PCA, зависят от молярных отношений Ca / P; то есть относительного количества кальция и фосфата, которые изменяют весь их результирующий состав.
Остальная часть семьи
На самом деле фосфаты кальция представляют собой семейство неорганических соединений, которые, в свою очередь, могут взаимодействовать с органической матрицей..
Другие фосфаты получают «просто» путем замены анионов, которые сопровождают кальций (ПО4 3- , HPO4 2- , H2ПО4 — , Огайо — ), а также тип примесей в твердом теле. Таким образом, до одиннадцати или более фосфатов кальция, каждый со своей структурой и свойствами, могут возникать естественным или искусственным путем..
Ниже приведены некоторые фосфаты и их соответствующие структуры и химические формулы:
-Водород кальций фосфат дигидрат, CaHPO4H 2H2O: моноклинный.
-Кальция дигидрофосфат моногидрат, Ca (H)2ПО4)2∙ H2O: триклиника.
-Безводный кислый фосфат, Ca (H)2ПО4)2: триклиника.
-Ocalcium гидрофосфат (OCP), Ca8H2(РО4)6: триклиника Является предшественником в синтезе гидроксиапатита.
Фосфат кальция: свойства, применение, виды, формула и реакции
Фосфат кальция – это однородный кристаллический порошок белого цвета с низкой степенью растворимости в воде. В пищевой промышленности данная пищевая добавка известна под индексом Е341. Добавка считается прекрасным консервантом со свойствами антиоксиданта. В продуктах питания она часто выполняет роль разрыхлителя.
В других отраслях промышленности фосфат кальция также заработал высокую популярность – он используется в качестве эмульгатора и уплотнителя. Кроме того, добавка выполняет роль стабилизатора, регулятора кислотности и фиксатора.
Фосфат кальция – это вещество, принадлежащее к классу неорганических соединений. Его получают посредством обработки минералов: апатита, фосфорита и гидроксилапатита. Камни подвергают обжигу в специальных печах, после чего добавляют к начальному сырью полугидратную фосфорную кислоту. На финальном этапе своего производства добавка принимает вид белого однородного порошка с высокой степенью растворимости в кислотах и низкой степенью растворимости в воде.
Выделяют 3 основные разновидности фосфата кальция: каждая из них занимает важное место в разных сферах жизнедеятельности человека. Так, фосфат кальция обладает высокой степенью устойчивости к влиянию внеклеточной жидкости. Естественная разновидность фосфата кальция в небольших количествах содержится в молоке и продуктах на его основе, встретить рассматриваемую соль можно также в составе костной ткани.
Основные сведения о фосфатах кальция
Фосфат кальция – это неорганическое соединение, получают которое, как правило, на специализированных предприятиях. Существует и натуральная разновидность фосфата кальция – обнаружить ее можно в составе коровьего молока и продуктов из него, а также в костной ткани.
Внешне фосфат кальция представляет собой светлый мелкокристаллический порошок без запаха. Добавка прекрасно растворяется в кислотах, но в воде сохраняет свою структуру.
Фосфат кальция может существовать в двух основных разновидностях:
- Моноклинная сингония.
- Гексагональная сингония.
Фосфат кальция широко применяется в разных отраслях промышленности: так, его часто используют в производстве продуктов питания (в составе соединение указывают под индексом Е341), также соль можно обнаружить в фармацевтической промышленности. Благодаря своим физико-химическим свойствам фосфат кальция считается идеальным компонентом длинного перечня лекарственных препаратов.
Формула и основные физические свойства фосфата кальция и его разновидности
Химическая формула фосфата кальция:
Выделяют две основные разновидности фосфата кальция – α и β. Они различаются между собой физическими свойствами (в частности, плотностью и температурой плавления). α –разновидность имеет моноклинную сингонию, тогда как β-разновидность обладает гексагональной сингонией.
Обе разновидности фосфата кальция плохо растворяются в воде, причем степень растворимости становится ниже с ростом температуры жидкости. Также фосфат кальция не способен к растворению в жидком аммиаке, ацетоне, этаноле, диэтиловом эфире и прочих органических соединениях.
Молекула фосфата кальция
В пищевой промышленности известны 3 основные разновидности фосфатов кальция, различающиеся между собой по степени замещения атомов водорода. Выделяют такие добавки фосфата кальция:
- пищевая добавка Е341(i) – это ортофосфат кальция 1-замещенный, формула соединения Ca(Н2PO4)2;
- пищевая добавка Е341(ii) – ортофосфат кальция 2-замещенный, формула соединения CaНPO4;
- пищевая добавка Е341(iii) – ортофосфат кальция 3-замещенный, формула соединения Ca3(PO4)2.
Фосфат кальция не имеет ни запаха, ни вкуса.
Агрегатное состояние соединения твердое.
Плотность разновидности соединения составляет 2810 кг/м 3 . Для -разновидности аналогичный показатель составляет 3067 кг/м 3 .
Температура плавления -разновидности – 1200 ˚С, -разновидности – 1670 ˚С.
Молярная масса фосфата калия – 310,18 г/моль.
Получение фосфата кальция
Вещество добывается промышленным путем, но встретить ее можно и в природе – она входит в состав некоторых минералов. Обнаружить фосфат кальция можно также в натуральном коровьем молоке и в составе костной ткани человека.
Так, основным сырьем для получения фосфата кальция, как уже было сказано выше, являются минералы, однако они являются не единственным сырьем для получения вещества в лабораторных условиях.
Фосфат кальция получают в ходе следующих реакций:
- Взаимодействие оксида кальция с ортофосфорной кислотой с выделением фосфата кальция и 3 молекул воды:
3CaO + 2H3PO4 → Ca3(PO4)2 + 3H2O - Взаимодействие гидроксида кальция с ортофосфорной кислотой с образованием фосфата кальция и 6 молекул воды:
3Ca(OH)2 + 2H3PO4 → Ca3(PO4)2 + 6H2O - Взаимодействие фосфата лития с хлоридом кальция с образованием фосфата кальция и 6 молекул хлорида лития:
2Li3PO4 + 3CaCl2 → 6LiCl + Ca3(PO4)2 - Взаимодействие фосфата натрия с хлоридом кальция с образованием фосфата кальция и 6 молекул натриевой соли:
2Na3PO4 + 3CaCl2 → Ca3(PO4)2 + 6NaCl - Разложение гидроортофосфата кальция с образованием фосфата кальция и ортофосфорной кислоты:
3CaHPO4 → Ca3(PO4)2 + H3PO4
Основные реакции, химические свойства фосфата кальция
Химические свойства фосфата кальция схожи со свойствами металлов. Соответственно, для него характерны следующие реакции:
- Взаимодействие фосфата кальция с углеродом (для протекания реакции важно поддержание температуры в диапазоне от 900 до 1200 градусов):
Ca3(PO4)2 + 8C → Ca3P2 + 8CO
В результате образуются фосфид кальция и окись углерода. - Взаимодействие фосфата кальция с углеродом и оксидом кремния:
Ca3(PO4)2 + 5C + 3SiO2 → 2P + 5CO + 3CaSiO3
По завершении реакции образуются фосфор, окись углерода и силикат кальция. Для создания правильных условий применяют специальные электропечи, температуру в которых поддерживают на отметке 1500 градусов. Данную реакцию часто применяют для промышленного производства фосфора. - Взаимодействие фосфата кальция с алюминием:
3Ca3(PO4)2 + 16Al → 3Ca3P2 + 8Al2O3
В итоге образуются фосфид кальция и оксид алюминия. Для правильного протекания реакции важно удерживать температуру на отметке 500 градусов. - Взаимодействие фосфата кальция с оксидом азота и водой:
Ca3(PO4)2 + 3NO2 + H2O → Ca(NO3)2 + 2CaHPO4 + NO
По завершении реакции образуются нитрат кальция, гидрофосфат кальция и оксид азота. - Взаимодействие фосфата кальция с ортофосфорной кислотой с образованием гидроортофосфата кальция:
Ca3(PO4)2 + H3PO4 → 3CaHPO4 - Реакция термического разложения соединения при температуре 2000 градусов на оксид кальция и оксид фосфора:
Ca3(PO4)2 → 3CaO + P2O5
Допустимые нормы употребления фосфата кальция
Пищевая добавка Е341 широко применяется в производстве продуктов питания: она выполняет роль регулятора кислотности, стабилизатора и влагоудерживающего агента.
Обнаружить её можно в составе молока и молочных продуктов, различных масел, кондитерской продукции, некоторых овощей и фруктов, а также хлебобулочных изделий.
Использовать фосфаты разрешается даже в составе детского питания – вещества считаются полностью безопасными для состояния человеческого здоровья.
Максимально допустимый объем фосфата кальция, который можно использовать в 1 килограмме/литре продукции составляет 20000 мг. Употребление 100 грамм такого продукта полностью удовлетворяет суточную потребность человека в фосфатах.
Сферы применения фосфата кальция
Фосфат кальция широко применяется в самых разных сферах человеческой жизни. Так, его часто можно обнаружить в составе кормов для домашних животных и птиц – им он необходим для восполнения дефицита кальция в организме. Также соединение вводят в состав лекарственных препаратов, применяют в процессе производства стекла и абразивов.
Встретить фосфат кальция можно и в пищевой промышленности: его применяют в качестве разрыхлителя, фиксатора цвета готового продукта и стабилизатора. Фосфат кальция в составе продуктов указывают под индексом Е341. Наиболее часто обнаружить его можно в составе молока и молочной продукции, мороженого, выпечки, рыбных и мясных продуктов, а также некоторых алкогольных напитков. Так, например, пищевая добавка Е341 выполняет роль эмульгирующей соли при производстве плавленых сырков. Некоторые производители вводят фосфат кальция в состав спортивного питания, сухих завтраков, рассыпных травяных чаев, разной консервации и очищенных масел. Использование фосфата кальция в пищевой промышленности регулирует СанПиН 2.3.2.1293-03, где пищевая добавка Е341 обозначена как регулятор кислотности, улучшитель муки, применяемой для производства хлеба, отвердитель, стабилизатор, разрыхлитель, добавка, препятствующая слеживанию и образованию комочков.
Популярен фосфат кальция и в сельскохозяйственной сфере – его применяют в качестве минерального удобрения для грунтов с высоким показателем кислотности.
Встретить добавку можно в составе зубных паст и порошков.
Фосфат кальция в пищевой промышленности
В сфере производства продуктов питания фосфат кальция отвечает за следующие задачи:
- стабилизация консистенции;
- ускорение процесса затвердевания;
- разрыхление порошкообразных смесей;
- препятствование образованию комочков в муке и сахарной пудре;
- носитель ароматизаторов в мясных изделиях;
- соль для производства плавленого сыра;
- очищение сахарного сиропа для производства рафинада;
- сохранение влаги в изделиях из мяса и рыбы.
Свойства фосфата кальция, влияние на организм
Исследование добавки и ее влияния на состояние человеческого организма ведутся более 50 лет. Никаких доказательств того, что фосфат кальция способен оказывать негативное воздействие на человека, нет, однако споры о допустимости его применения в пищевой промышленности ведутся до сих пор.
Некоторые убеждены в том, что фосфат кальция обладает канцерогенными свойствами и является причиной скопления в организме излишка холестерина. Его чрезмерное употребление, по словам специалистов, способно провоцировать возникновение нарушений в работе пищеварительной системы.
Несмотря на потенциальный вред, фосфат кальция считается одним из важных компонентов для правильной работы организма – он отвечает за прочность костей и зубов.
Полезные свойства фосфата кальция
В первую очередь стоит отметить пользу, которую фосфат кальция несет для зубов и костей – являясь их строительным материалом, он способен укреплять ткани, улучшать их состояние. В больших количествах фосфат кальция содержится в молочной продукции – именно из нее и советуют получать вещество специалисты. Дело в том, что наравне с фосфатом кальция в молоке и продуктах на его основе содержится большое количество казеина, упрощающего процесс усвоения вещества.
В средствах для ухода за ротовой полостью фосфат кальция выступает в роли мягкого абразива, бережно удаляющего налет с поверхности зубов.
Фосфат кальция легко переносится организмом, поэтому разрешен к применению во многих странах. Более того, его часто используют в качестве БАДа, действие которого направлено на восполнение дефицита фосфора и кальция в организме.
Вред фосфата кальция
Максимально допустимый объем фосфата кальция – 70 мг на килограмм тела в сутки. В случае регулярного превышения рекомендуемой нормы велик риск развития следующих заболеваний:
- отклонения в работе органов ЖКТ;
- почечная недостаточность;
- возникновение фосфатных камней в почках и мочевом пузыре;
- резкий скачок уровня холестерина;
- снижение уровня кальция, повышение хрупкости костей.
Класс опасности фосфата кальция и правила его хранения
Фосфат кальция абсолютно нетоксичен, не может взрываться и воспламеняться. Согласно нормативным документам, он принадлежит к 3 классу опасности – то есть, к веществам, оказывающим умеренное отрицательное воздействие на состояние здоровья человека.
Максимально допустимая концентрация фосфата кальция в воздухе рабочей зоны составляет 6мг/м 3 .
Фосфат кальция фасуют в плотные полиэтиленовые мешки, в них же осуществляют его транспортировку. Для хранения вещества допускается использовать 2-, 3- и 4-слойные бумажные мешки.
Температуру вещества при перевозке, хранении и прочих манипуляциях необходимо удерживать на отметке ниже 55 градусов.
Где можно купить фосфат кальция и сколько он стоит
Проще всего приобрести интересующее вас вещество в интернете или на предприятиях, специализирующихся на его производстве. Стоимость соединения может быть разной – определяющим фактором является чистота продукта и его назначение. Самый дешевый фосфат кальция стоит около 1000 рублей за килограмм, цена самых качественных его разновидностей может достигать 2000 рублей за килограмм.
Заключение
Фосфат кальция – это однородный белый порошок без вкуса и запаха. В составе продуктов питания – в частности, молочной и хлебобулочной продукции – его можно распознать под индексом Е341. Наибольшей популярностью добавка пользуется в пищевой и фармацевтической промышленности, применяют его также в сельском хозяйстве и некоторых других сферах. Фосфат кальция считается безопасным для здоровья человека (его можно давать даже младенцам) при соблюдении правил употребления. В случае регулярного превышения рекомендуемого объема велик риск возникновения отклонений в состоянии здоровья: нарушения работы органов ЖКТ, проблемы с почками и т.д..
Кальция Фосфат
Химическое название
Кальция фосфат, фосфорнокислый Ca.
Химические свойства
Неорганическое соединение, соль, образованная Сa и ортофосфорной кислотой. Формула Фосфата Кальция: Ca3(PO4)2. Обычно – это бесцветный мелкий кристаллический порошок, который плохо растворяется в воде. При воздействии кислот вещество преобразуется в гидрофосфат. Молярная масса соединения = 310,2 грамма на моль.
Получение Фосфата Кальция. Средство широко распространено в виде минералов в природе, находится в фосфорите, гидроксиапатите и апатите. Содержится в больших количествах, буквально составляет основу зубов и костей у позвоночных животных. Из школьного курса химии можно вспомнить реакцию образования Кальция Фосфата из фосфата натрия и хлорида Ca. В результате реакции обмена необходимое вещество выпадает в осадок.
Средство применяют в качестве основного источника кальция для подкормки птиц и скота; добавляют в состав фосфоритной муки для удобрения кислой почвы; используют при производстве абразивов, керамических изделий и стекла; применяют в пищевой промышленности; используют в медицине.
Фармакологическое действие
Фармакодинамика и фармакокинетика
Элемент принимает активное участие в процессах остеогенеза и роста костной ткани, в процессах передачи нервных импульсов, в механизме свертывания крови, способствует нормальной работе сердца и сосудов, опорно-двигательного аппарата. Кальция Фосфат полностью усваивается организмом.
Показания к применению
Препараты, содержащие данное вещество рекомендуют принимать:
- в периоды интенсивного роста и развития скелета в детском возрасте;
- для защиты и укрепления костей, зубов;
- пациентам, которые не переносят молоко и молочные продукты;
- во время лечения остеопороза, остеомиелита, рахита, кариеса, пародонтита, бурсита, вывихов и переломов костей.
Противопоказания
Средство противопоказано к приему:
Побочные действия
Кальция Фосфат пациенты хорошо переносят. Редко может возникнуть аллергия, побочные реакции со стороны пищеварительного тракта.
Инструкция по применению (Способ и дозировка)
Лекарство назначают внутрь в комбинации с некоторыми другими витамина и микроэлементами. Суточная дозировка зависит от лекарственной формы, возраста пациента, тяжести заболевания.
Передозировка
При передозировке может возникнуть гиперкальциемия или гиперкальциурия. Лечение – симптоматическое.
Взаимодействие
Кальция Фосфат может замедлить абсорбцию фторида натрия и антибиотиков тетрациклинового ряда. Рекомендуется соблюдать 3-х часовой интервал между применением этих средств.
Условия продажи
Лекарство можно приобретать без рецепта от врача.
Детям
Вещество часто назначают детям. В зависимости от возраста используют разные лекарственные формы и схемы лечения средством.
Препараты, в которых содержится (Аналоги)
Торговое название лекарства: Кальция гидрофосфата дигидрат. Химическое соединение входит в состав следующих витаминно-минеральных комплексов: Витатресс, Рост-Норма, Компливит, Остеотон, Глутамевит, Кальцинова, Олиговит, Элевит Пронаталь, Стоп Остеопороз, Супрадин.
Отзывы
Отзывы о препаратах, в составе которых содержится Кальция Фосфат положительные. При соблюдении рекомендаций врача, вещество хорошо усваивается, не вызывает аллергических реакций, благоприятно влияет на процессы роста и развития детей, устраняет дефицит Ca у взрослых пациентов. Его назначают, как в качестве профилактического средства, так и в составе комплексного лечения различных заболеваний опорно-двигательного аппарата.
Цена, где купить
Приобрести препарат Компливит, в составе которого находится фосфат Ca можно по примерной цене 200 рублей за 60 таблеток.
Образование: Окончила Ровенский государственный базовый медицинский колледж по специальности «Фармация». Окончила Винницкий государственный медицинский университет им. М.И.Пирогова и интернатуру на его базе.
Опыт работы: С 2003 по 2013 г. – работала на должностях провизора и заведующего аптечным киоском. Награждена грамотами и знаками отличия за многолетний и добросовестный труд. Статьи на медицинскую тематику публиковались в местных изданиях (газеты) и на различных Интернет-порталах.
http://chtoikak.ru/fosfat-kalciya.html
http://medside.ru/kaltsiya-fosfat