Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2bdf6cfc6275b7 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Соли фосфорной кислоты H3PO4
H3PO4 образует три ряда солей:
Как видно из реакций, приведенных выше, та или иная соль получается в зависимости от соотношения молярных масс реагирующих кислот и щелочей.
Средние соли фосфорной кислоты (фосфаты) нерастворимы в воде, за исключением аммония и фосфатов щелочных металлов. Кислые соли, наоборот, хорошо растворяются в воде, лучше всего — дигидрофосфаты.
Отличительной особенностью солей фосфорной кислоты является принципиально разный характер среды, образующейся в водных растворах средних и кислых солей в результате их гидролиза.
Гидролиз фосфата натрия Na3PO4
Основная ступень гидролиза фосфата натрия выражается следующей реакцией:
Na3 PO4 3- + H2O ↔ Na2 HPO4 2- +Na OH —
Образующиеся ионы HPO4 2- очень слабо диссоциируют (см. выше диссоциацию фосфорной кислоты п.3), практически не подкисляя раствор, в таких условиях кислотность раствора определяется только гидроксид-ионами OH — , по этой причине водные растворы средних фосфатов имеют сильно щелочную среду.
Гидролиз гидрофосфата натрия Na2HPO4
Основная ступень гидролиза гидрофосфата натрия выражается следующей реакцией:
Na2 HPO4 2- + H2O ↔ Na H2PO4 — +Na OH —
Образующиеся ионы H2PO4 2- диссоциируют достаточно хорошо (см. выше диссоциацию фосфорной кислоты п.2), нейтрализуя значительную часть гидроксид-ионов OH — , по этой причине водные растворы гидрофосфатов имеют слабощелочную среду.
Гидролиз дигидрофосфата натрия NaH2PO4
В растворах дигидрофосфатов наряду с гидролизом идет процесс диссоциации дигидрофосфат-ионов:
Na H2PO4 — + H2O ↔ H3PO4 +Na OH —
H2PO4 — ↔ H + +HPO4 2-
Примечательно, что второй процесс превалирует над первым, по этой причине, все гидроксид-ионы OH — , являющиеся продуктом гидролиза, полностью нейтрализуются продуктами диссоциации — катионами водорода H + , которых присутствует в растворе в избытке, что и объясняет слабокислый характер среды растворов дигидрофосфатов.
Применение фосфатов
Соли фосфорной кислоты находят широчайшее применение в современной стоматологии и ортопедии, в бытовой химии:
Апатит Ca5(OH)(PO4)3 — важнейший компонент зубов и костей. Зубной кариес является результатом химической реакции фосфата с кислой средой в ротовой полости (кислоты содержатся в пище, а также образуются в результате жизнедеятельности микроорганизмов, находящихся во рту).
Фтор, входящий в состав зубной пасты, способствует образованию на зубах тонкого слоя фторапатита, более устойчивого к негативному действию кислот:
Ca5(OH)(PO4)3+F → Ca5F(PO4)3+OH —
Современные пломбировочные материалы, применяющиеся в стоматологии, содержат труднорастворимые фосфаты алюминия и цинка (AlPO4, Zn3(PO4)2), которые являются очень устойчивыми к действию кислот.
В последнее время соли фосфорной кислоты стали использоваться в ортопедии для восстановления сломанных костей — специальная паста, в состав которой входят дигидрофосфат кальция, фосфат натрия, фосфорит вводится в место перелома кости, формируя в течение нескольких минут сломанный участок — по мере сращения кости искусственная кость замещается естественной костной тканью.
Натриевая соль трифосфорной кислоты нашла применение в моющих средствах, которые используются для смягчения жесткой воды — ионы магния и кальция связываются трифосфорной кислотой, и не взаимодействуют с анионами мыла.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
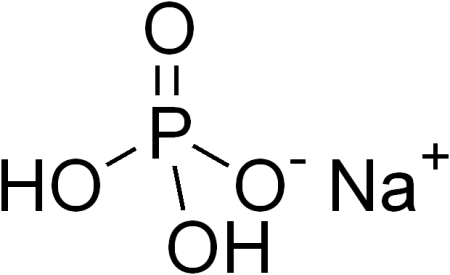
Дигидрофосфат натрия
| Дигидрофосфат натрия | |
|---|---|
 | |
| Систематическое наименование | Дигидрофосфат натрия |
| Традиционные названия | Дигидроортофосфат натрия, фосфорнокислый натрий, однозамещённый |
| Хим. формула | NaH2PO4 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 119,98 г/моль |
| Плотность | гидр. 1,9096 г/см³ |
| Т. плав. | гидр. 60 °C |
| Растворимость в воде | 85,2 20 ; 207,3 80 г/100 мл |
| ГОСТ | ГОСТ 245-76 |
| Рег. номер CAS | 7558-80-7 |
| PubChem | 24204 |
| Рег. номер EINECS | 231-449-2 |
| SMILES | |
| Кодекс Алиментариус | E339(i) |
| ChEBI | 37585 |
| ChemSpider | 22626 |
| Токсичность | Нетоксичен |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Дигидрофосфат натрия — неорганическое соединение, кислая соль щелочного металла натрия и ортофосфорной кислоты с формулой NaH2PO4, бесцветные кристаллы, хорошо растворимые в воде, образует кристаллогидраты.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
Получение
- Нейтрализация концентрированной ортофосфорной кислоты разбавленным раствором едкого натра:
H3PO4 + NaOH → NaH2PO4 + H2O
- Реакция гидрофосфата натрия с фосфорной кислотой:
Na2HPO4 + H3PO4 → 2NaH2PO4
- Растворение белого фосфора в слабощелочном растворе перекиси водорода:
P4 + 10H2O2 + 4NaOH → 4NaH2PO4 + 8H2O
Физические свойства
Дигидрофосфат натрия образует бесцветные кристаллы. Хорошо растворимы в воде, плохо в этаноле.
Образует несколько кристаллогидратов NaH2PO4· n H2O, где n = 1, 2, которые плавятся в кристаллизационной воде при 100, 60 °C соответственно.
Расплавы кристаллогидратов, равно как концентрированные растворы дигидрофосфата натрия представляют собой вязкие мутные опалесцирующие жидкости, легко кристаллизующиеся при понижении температуры в полупрозрачную стекловидную массу.
Химические свойства
- Кристаллогидрат теряет воду при нагревании в вакууме:
NaH2PO4 ⋅ 2H2O → 100oC NaH2PO4 + 2H2O
- При нагревании образует кислый дигидропирофосфат натрия:
2NaH2PO4 → 160oC Na2H2P2O7 + H2O
- или метафосфат натрия:
NaH2PO4 → 220−250oC NaPO3 + H2O
- Реагирует с щелочами:
NaH2PO4 + NaOH → Na2HPO4 + H2O NaH2PO4 + 2NaOH → Na3PO4 + 2H2O
- Вступает в обменные реакции:
3NaH2PO4 + 3AgNO3 → Ag3PO4↓ + 3NaNO3 + 2H3PO4
Применение
Дигидрофосфат натрия является массовым продуктом химической промышленности. Типичная цена составляет порядка 800$/т.
- В фармакологии при изготовлении лекарственных препаратов используются слабительные, буферные и водоудерживающие свойства вещества.
- В пищевой промышленности дигидрофосфат натрия используется в качестве многоцелевой пищевой добавки (код E339) и он выступает в качестве буфера и как стабилизатор окраски продуктов.
- Дигидрофосфат натрия входит в состав стиральных порошков и иных моющих средств, где выступает как умягчитель воды и буфер.
http://prosto-o-slognom.ru/chimia/505_soli_fosfora.html
http://chem.ru/digidrofosfat-natrija.html

