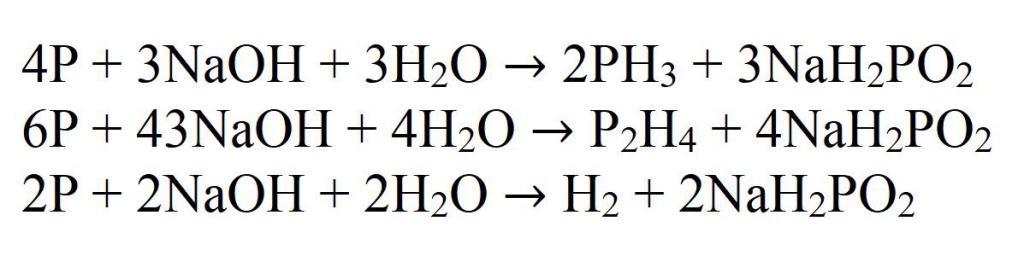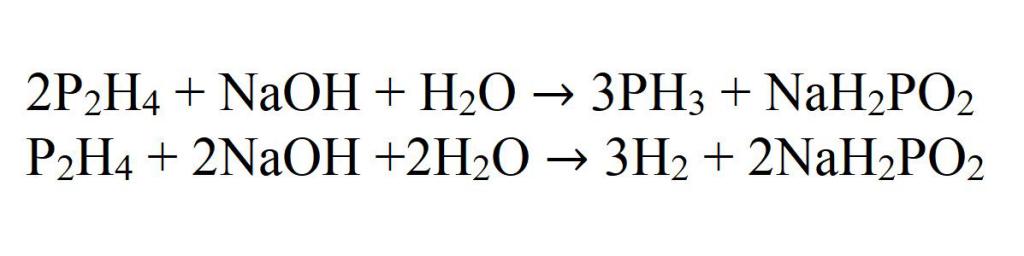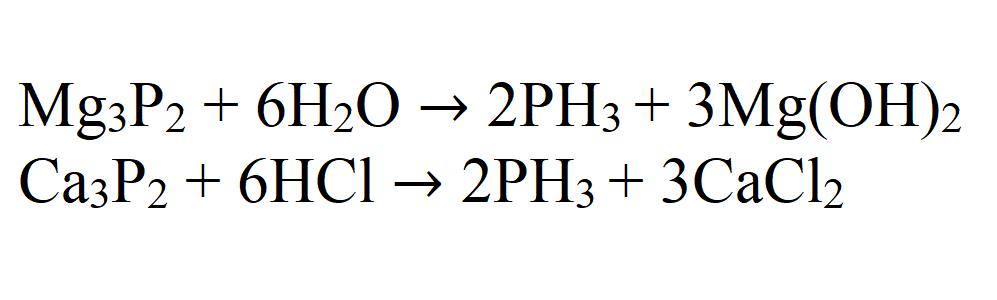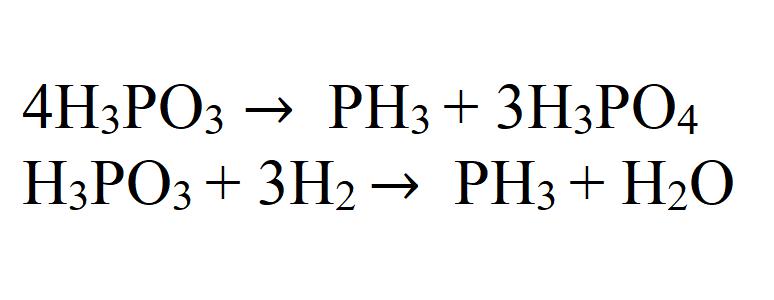Фосфин: получение и химические свойства
Фосфин
Строение молекулы и физические свойства
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы фосфина похожа на структуру аммиака — правильная треугольная пирамида. Но валентный угол H-P-H меньше, чем угол H-N-H в аммиаке и составляет 93,5 о .
У атома фосфора в фосфине на внешнем энергетическом уровне остается неподеленная электронная пара. Эта электронная пара оказывает значительное влияние на свойства фосфина, а также на его структуру. Электронная структура фосфина — тетраэдр , с атомом фосфора в центре.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Фосфин: формула, получение, физические и химические свойства
Фосфин — это ядовитый газ, который в чистом виде не имеет цвета и запаха. С химической точки зрения, является летучим водородным соединениям фосфора. В химии формула фосфина имеет вид — PH3. По своим свойствам имеет некоторые схожести с аммиаком. Вещество очень опасно, так как имеет высокую токсичность и склонность к самовоспламенению.
Получение
Самый хорошо изученный способ получения фосфина — это реакция взаимодействия белого фосфора с раствором сильной щелочи при нагревании. В данном случае фосфор диспропорционирует на метафосфат и фосфин. Побочными продуктами этой реакции является дифосфин (P2H4) и водород, поэтому выход данной реакции небольшой и составляет не более 40 %.
Образующийся дифосфин в реакционной среде вступает во взаимодействие со щелочью, в результате чего образуется фосфин и водород.
А полученный в этих реакциях гипофосфит, при взаимодействии со щелочью, переходит в фосфат с выделением водорода.
После завершения всех реакций, в результате взаимодействия щелочи на фосфор образуется фосфин, водород и фосфат. Данный способ получения можно также провести со щелочными оксидами вместо щелочей. Этот опыт является очень красивым, так как образующийся дифосфин сразу же воспламеняется и сгорает в виде искр, образуя нечто похожее на фейерверк.
При воздействии воды или кислоты на фосфиды металлов также получается фосфин.
При термическом разложении фосфористой кислоты или ее восстановлении водородом в момент выделения также образуется фосфин.
Соли фосфония при разложении или в реакции с некоторыми веществами дают фосфин.
Физические свойства
Фосфин представляет собой бесцветный газ без запаха. Но технический фосфин (с некоторыми примесями) может иметь характерный неприятный запах, который описывают по-разному. Немного тяжелее воздуха, при температуре -87,42 °C сжижается, а при -133,8 °C становится твердым веществом. Такие низкие температуры кипения и плавления обусловлены довольно слабыми водородными связями. Вещество практически нерастворимо в воде, но при определенных условиях образует с водой неустойчивые гидраты. Хорошо растворим в этаноле и диэтиловом эфире. Плотность фосфина при нормальных условиях составляет 0,00153 г/см 3 .
Химические свойства
Как уже было сказано, химическая формула фосфина — PH3. Хоть фосфин и похож на аммиак, он имеет ряд отличий во взаимодействиях с другими веществами. Эти особенности обусловлены тем, что химические связи в фосфине (по формуле это становится ясно) ковалентные слабополярные. Они менее полярные, чем в аммиаке, и поэтому более прочные.
При сильном нагревании (примерно 450 °C) без доступа кислорода фосфин разлагается на простые вещества.
При температуре свыше 100 °C PH3 самовоспламеняется, вступая в реакцию с кислородом воздуха. Температурный порог можно снизить ультрафиолетовым светом. По этой причине, выделяющийся на болотах фосфин, часто самовоспламеняется, вызывая появление так называемых «блуждающих огней».
Но может происходить и простое горение. Тогда образуется фосфорный ангидрид и вода.
Как и аммиак, фосфин может образовывать соли, взаимодействуя с галогеноводородами.
Исходя из формулы фосфина, можно сказать, что фосфор в нем имеет низшую степень окисления. По этой причине он является хорошим восстановителем.
Применение
Ввиду своей высокой токсичности, фосфин нашел применение в фумигации, т. е. уничтожении различного рода вредителей (насекомых, грызунов) при помощи газа. Для этих процедур существуют специальные устройства — машины-фумигаторы, с использованием которых распыляют газ в помещениях. Обычно фосфином или препаратами на его основе обрабатывают склады зерновых культур, готовых пищевых продуктов, мебели, а также библиотеки, заводские помещения, вагоны поездов и другой транспорт. Преимущество такой обработки в том, что фосфин даже в небольших концентрациях легко проникает в труднодоступные места и никак не взаимодействует с металлами, древесиной и тканью.
Помещение обрабатывают фосфином, в герметичном состоянии его держат в течение 5-7 суток. После этого не менее двух суток нужно осуществлять проветривание, иначе находится человеку в нем опасно. После этого фосфин не оставляет никаких следов даже на продуктах, зерне и других товарах.
Еще фосфин используется в синтезе некоторых веществ, особенно органических. Также из него может получаться химически чистый фосфор, с использованием фосфина производят легирование полупроводников.
Токсикология
Фосфин крайне токсичное соединение. Он быстро проходит через дыхательные пути и взаимодействует со слизистыми оболочками организма. Это может вызвать нарушения работы нервной системы, а также обмена веществ в целом. Признаками отравления могут служить головокружение, тошнота, рвота, головная боль, усталость, иногда даже конвульсии. В тяжелых случаях отправления человек может потерять сознание или произойти остановка дыхания и сердцебиения. Предельно допустимая концентрация фосфина в воздухе — 0.1 мг/м 3 . Концентрация 10 мг/м 3 сразу приводит к летальному исходу.
Первое, что необходимо сделать с пострадавшим от отравления фосфина, — вынести на свежий воздух и освободить от загрязненной одежды. Также рекомендуется окатить пострадавшего водой, чтобы быстрее убрать остатки токсичного газа. Стационарное лечение подразумевает использование кислородной маски, контроль сердечного ритма и состояния печени, лечение отека легких. За больным необходимо следить минимум 2-3 суток, даже если видимых признаков отравления уже нет. Некоторые симптомы могут проявляться лишь через несколько суток после контакта с фосфином.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://fb.ru/article/425492/fosfin-formula-poluchenie-fizicheskie-i-himicheskie-svoystva http://acetyl.ru/o/np1h3.php |