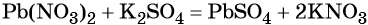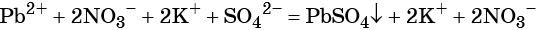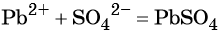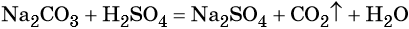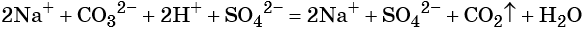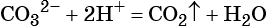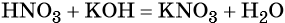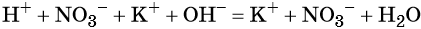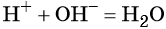Фторид калия и нитрат серебра ионное уравнение
Для выполнения задания используйте следующий перечень веществ: фосфин, нитрат кальция, нитрат серебра, фторид калия, метан. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: фосфин, нитрат кальция, нитрат серебра, фторид калия, метан. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Запишем уравнение реакции:
Составим электронный баланс:
Фосфор в степени окисления −3 является восстановителем, а серебро в степени окисления +1 — окислителем.
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, содержит следующие элементы: — выбраны вещества, и записано уравнение окислительно-восстановительной реакции; Раствор нитрата серебра смешивают с раствором фтористого калия. Если образуется осадок, что это за осадок?Ваш ответрешение вопросаПохожие вопросы
Популярное на сайте: Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах. Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте. Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так. Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью. Реакции ионного обмена и условия их осуществленияРеакциями ионного обмена называют химические реакции, которые протекают между ионами без изменения степеней окисления элементов и приводят к обмену составных частей реагентов. Уравнения обменных реакций записывают в молекулярной форме (с указанием формул всех реагирующих веществ со стехиометрическими коэффициентами); в полной ионной форме (с указанием всех существующих в растворе ионов) и в сокращённой ионной форме (с указанием только тех ионов, которые непосредственно взаимодействуют между собой). При написании уравнений реакций в ионной форме формулы малодиссоциирующих веществ (слабых электролитов) записывают в молекулярной форме. Уравнения реакций обмена в водных растворах электролитов составляют так.
Реакции ионного обмена в растворах электролитов протекают практически необратимо и до конца, если в качестве продуктов образуются осадки (малорастворимые вещества), газы (легколетучие вещества), слабые электролиты (малодиссоциированные соединения) и комплексные ионы. Если при взаимодействии растворов электролитов не образуется ни одно из указанных видов соединений, химическое взаимодействие практически не происходит. Уравнения обменных реакций можно записать в молекулярной форме, полной ионной форме, с указанием всех существующих в растворе ионов и в сокращённой ионной форме, которая, собственно, и выражает взаимодействие ионов. Следует отметить, что при написании уравнений реакций в ионной форме малодиссоциирующие вещества (слабые электролиты) записывают в молекулярной форме. Пример 1. Реакция между нитратом свинца и сульфатом калия. В результате этой реакции образуется нерастворимый сульфат свинца и выделяется растворимый нитрат калия: (полная ионно-молекулярная форма), (сокращённая ионно-молекулярная форма). Пример 2. Взаимодействие карбоната натрия с серной кислотой. При этом выделяется углекислый газ и вода, а в растворе остаются катионы натрия и сульфат-ионы: (полная ионно-молекулярная форма), (сокращённая ионно-молекулярная форма). Пример 3. Реакция между азотной кислотой и едким калием. В результате данной реакции образуется малодиссоциированное соединение — вода и в растворе остаются катионы калия и нитрат-ионы: (полная ионно-молекулярная форма), (сокращённая ионно-молекулярная форма). Тренировочные задания1. Осадок образуется при взаимодействии водных растворов 2. Газ выделяется при взаимодействии водных растворов 3. Краткое ионное уравнение H + + OH – = H2O описывает взаимодействие 1) гидроксида кальция и фосфорной кислоты 4. Краткое ионное уравнение 3Ba 2+ + 2PO4 3– = Ba3(PO4)2↓ описывает взаимодействие 1) карбоната бария и фосфорной кислоты 5. Краткое ионное уравнение Ba 2+ + SO4 2– = BaSO4↓ описывает взаимодействие 1) хлорида бария и сульфата натрия 6. Краткое ионное уравнение Ag + + Cl – = AgCl↓ описывает взаимодействие 1) хлорида кальция и бромида серебра 7. Краткое ионное уравнение H + + OH – = H2O отвечает взаимодействию 1) азотной кислоты и гидроксида железа (III) 8. Краткое ионное уравнение 2Н + + S 2– = Н2S↑ отвечает взаимодействию 1) соляной кислоты и сульфида железа (II) 9. Краткое ионное уравнение 2Н + + CO3 2– = CO2↑ + H2O отвечает взаимодействию 1) соляной кислоты и карбоната кальция 10. Краткое ионное уравнение 2Н + + CaCO3 = Ca 2+ + CO2↑ + H2O отвечает взаимодействию 1) соляной кислоты и карбоната кальция 11. Краткое ионное уравнение Al 3+ + 3OH – = Al(OH)3↓ отвечает взаимодействию 1) сульфата алюминия и гидроксида кальция 12. Краткое и полное ионное уравнения совпадают для реакции 1) соляной кислоты и карбоната калия 13. Одновременно в растворе не могут существовать ионы 1) Ba 2+ , Fe 2+ , PO4 3– , CO3 2– 14. Одновременно в растворе могут существовать ионы 1) Ba 2+ , Fe 2+ , PO4 3– , SO4 2– 15. Образование осадка происходит при взаимодействии водных растворов 16. Образование газа происходит при взаимодействии водных растворов 1) сульфата калия и хлорида бария 17. С выпадением осадка протекает реакция ионного обмена между растворами 1) нитрата натрия и фторида калия 18. С выделением газа протекает реакция ионного обмена между растворами 1) карбоната калия и бромоводородной кислоты 19. С выделением газа протекает реакция ионного обмена между растворами 1) гидроксида бария и азотной кислоты 20. С выделением воды протекает реакция ионного обмена между растворами 1) нитрата меди и хлорида железа источники: http://www.soloby.ru/1481936/%D1%80%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80-%D0%BD%D0%B8%D1%82%D1%80%D0%B0%D1%82%D0%B0-%D1%81%D0%BC%D0%B5%D1%88%D0%B8%D0%B2%D0%B0%D1%8E%D1%82-%D1%80%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80%D0%BE%D0%BC-%D1%84%D1%82%D0%BE%D1%80%D0%B8%D1%81%D1%82%D0%BE%D0%B3%D0%BE-%D0%BE%D0%B1%D1%80%D0%B0%D0%B7%D1%83%D0%B5%D1%82%D1%81%D1%8F http://himi4ka.ru/ogje-2018-po-himii/urok-11-reakcii-ionnogo-obmena-i-uslovija-ih-osushhestvlenija.html |