Гидролиз хлорида кобальта (II)
CoCl2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая стадия (ступень) гидролиза
Молекулярное уравнение
CoCl2 + HOH ⇄ CoOHCl + HCl
Полное ионное уравнение
Co 2+ + 2Cl — + HOH ⇄ CoOH + + Cl — + H + + Cl —
Сокращенное (краткое) ионное уравнение
Co 2+ + HOH ⇄ CoOH + + H +
Вторая стадия (ступень) гидролиза
Молекулярное уравнение
CoOHCl + HOH ⇄ Co(OH)2 + HCl
Полное ионное уравнение
CoOH + + Cl — + HOH ⇄ Co(OH)2 + H + + Cl —
Сокращенное (краткое) ионное уравнение
CoOH + + HOH ⇄ Co(OH)2 + H +
Среда и pH раствора хлорида кобальта (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Железо, кобальт, никель (стр. 6 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 |
Соли кобальта (II) и никеля (II). Так как для кобальта и никеля наиболее характерной валентностью является II, катионы Co2+ и Ni2+ аналогично катиону двухвалентного железа образуют соли практически со всеми кислотными остатками. По своей растворимости соли кобальта и никеля очень похожи на соответствующие соли железа (II): соли от сильных кислот в большинстве легко растворимы в воде, тогда как соли от слабых кислот, как правило, не обладают хорошей растворимостью.
Водные растворы, а также кристаллогидраты солей кобальта (II) при обычной температуре окрашены в розовый или красный цвет, присущий аквакомплексу [Co(H2O)6]2+. При нагревании аквакомплекс кобальта начинает отщеплять воду и вследствие этого меняет окраску на голубую или синюю, характерную для большинства безводных соединений кобальта. Цвет солей никеля в гидратированном состоянии обычно светло-зеленый. Безводные соли кобальта и никеля окрашены в другие, обычно темные цвета: например, сульфиды CoS и NiS – черные.
Обычные способы получения солей кобальта и никеля аналогичны методам синтеза соответствующих солей двухвалентного железа: растворимые соли получают взаимодействием самого металла или его оксида и гидроксида с соответствующими кислотами; нерастворимые – путем ионообменных реакций:
Поскольку кобальту и никелю соответствуют слабые основания, их соли с сильными кислотами подвергаются частичному гидролизу по катиону, вследствие чего в растворе возникает кислая реакция среды.
Каких-либо значительных окислительных или восстановительных свойств соли кобальта и никеля не проявляют. Зато у них отчетливо выражена склонность к комплексообразованию с различными анионами, а также молекулами воды и аммиака:
Комплексные соединения никеля в большинстве случаев значительно прочнее аналогичных веществ, образованных двухвалентным кобальтом.
Также необходимо отметить, что комплексные соединения двухвалентного кобальта очень легко окисляются до комплексов трехвалентного кобальта. Иногда окисление протекает под действием таких слабых окислителей, как кислород воздуха (при комнатной температуре) или вода (при небольшом нагревании):
Соли кобальта (III) и никеля (III). Число известных простых солей кобальта (III) очень невелико. Это, прежде всего, фториды CoF3 и NiF3, а также сульфат Co2(SO4)3, которые характеризуются, во-первых, невысокой стабильностью и, во-вторых, сильными окислительными свойствами. Например, фторид трехвалентного кобальта при нагревании до 300оС распадается на фторид кобальта (II) и газообразный фтор:
В случае сульфата трехвалентного кобальта разложение происходит под действием воды уже при комнатной температуре:
Зато существует огромное количество комплексных соединений трехвалентного кобальта, которые отличаются в большинстве случаев высокой устойчивостью.
Получают комплексные соединения кобальта (III) чаще всего окислением соответствующих соединений кобальта (II):
Поскольку для никеля во всех его соединениях более характерна валентность II, простых солей трехвалентного никеля неизвестно. Были синтезировано небольшое количество комплексных солей никеля(III), например K3[NiF6].
ЖЕЛЕЗО, КОБАЛЬТ, НИКЕЛЬ И ИХ СОЕДИНЕНИЯ
Опыт 1. Взаимодействие железа с кислотами. Налейте в четыре пробирки соответственно раствор соляной кислоты, концентрированный и разбавленный растворы серной кислоты и разбавленный раствор азотной кислоты. В каждую пробирку внесите небольшое количество порошкообразного железа. Если в какой-либо пробирке не наблюдается заметных признаков химической реакции, содержимое пробирки осторожно подогрейте на пламени горелки. Затем добавьте во все пробирки 2-3 капли раствора роданида аммония, который образует с ионами трехвалентного железа интенсивно окрашенное соединение. В тех пробирках, где не произошло окрашивание раствора в красный цвет, образуются соединения двухвалентного железа. Чем объясняется то, что при взаимодействии железа с серной кислотой разной концентрации образуются соли железа различной степени окисления? Напишите уравнения соответствующих реакций.
Опыт 2. Получение гидроксида железа (II) и изучение его свойств. В солях двухвалентного железа вследствие частичного окисления на воздухе всегда присутствуют небольшие количества соединений железа (III). Поэтому для изучения химического поведения железа (II) следует брать кристаллическую соль Мора – гексагидрат двойного сульфата аммония и двухвалентного железа (NH4)2SO4∙FeSO4∙6H2O, и для каждого опыта готовить свежий раствор, растворяя небольшое количество этой соли в 6-10 каплях воды. Соль Мора в растворе полностью диссоциирует на все составляющие ионы, поэтому в уравнениях реакций можно записать лишь формулу сульфата железа (II) FeSO4.
Поместите в пробирку свежеприготовленный раствор соли Мора и добавьте по каплям раствор щелочи до выпадения осадка. Отметьте цвет получившегося гидроксида железа (II). Разделите осадок на две пробирки. В первую пробирку прилейте по каплям раствор соляной кислоты до полного растворения осадка. О каких свойствах гидроксида железа (II) свидетельствует данная реакция? Вторую пробирку оставьте на некоторое время (5-10 минут). Изменился ли цвет осадка?
Напишите уравнения реакций: а) образования гидроксида двухвалентного железа; б) его растворения в соляной кислоте; в) его окисления в гидроксид железа (III) под действием кислорода воздуха и воды.
Опыт 3. Качественные реакции на катионы железа:
А) к свежеприготовленному раствору соли Мора добавьте 1-2 капли раствора гексацианоферрата(III) калия K3[Fe(CN)6]. В результате реакции образуется осадок гексацианоферрата(III) железа(II)-калия (турнбулева синь). Отметьте цвет осадка. Напишите уравнение реакции в молекулярном и ионном виде;
Б) поместите в пробирку 3-4 капли раствора хлорида трехвалентного железа и прилейте 1-2 капли раствора гексацианоферрата(II) калия K4[Fe(CN)6]. В результате реакции выпадает осадок гексацианоферрата(II) железа(III)-калия (берлинская лазурь). Обратите внимание на цвет осадка. Отличается ли он от цвета турнбулевой сини из предыдущего опыта? Напишите уравнение реакции в молекулярном и ионном виде;
В) в пробирку наберите 3-4 капли раствора хлорида железа (III) и добавьте 2-3 капли раствора роданида аммония. Как изменился цвет раствора? Напишите уравнение реакции.
Опыт 4. Восстановительные свойства соединений двухвалентного железа:
А) поместите в пробирку 2-3 капли раствора перманганата калия и 5-6 капель 2 н. раствора серной кислоты, затем добавьте несколько кристалликов соли Мора. Как изменился цвет раствора? Полученный раствор испытайте на присутствие трехвалентного железа, для чего добавьте несколько капель раствора роданида аммония, который в присутствии катионов Fe3+ окрашивается в интенсивный красный цвет. При помощи метода полуреакций (ионно-электронного баланса) составьте уравнение реакции, учитывая, что перманганат в кислой среде восстанавливается до солей двухвалентного марганца;
Б) внесите в пробирку несколько кристалликов соли Мора и добавьте 5-6 капель концентрированной серной кислоты. Полностью растворите соль Мора в серной кислоте, после чего прилейте 3-4 капли концентрированной азотной кислоты и нагрейте содержимое пробирки до кипения. Что наблюдается? Напишите уравнение протекающей реакции;
В) внесите в пробирку 3-4 капли раствора дихромата калия и 4-5 капель разбавленного раствора серной кислоты, затем добавьте несколько кристалликов соли Мора. Содержимое пробирки тщательно перемешайте. Как изменился цвет раствора? При помощи метода полуреакций (ионно-электронного баланса) составьте уравнение реакции, учитывая, что дихромат в кислой среде восстанавливается до солей трехвалентного хрома.
Опыт 5. Получение гидроксида железа (III) и исследование его свойств. В двух пробирках получите осадок гидроксида железа (III), используя 3-4 капли раствора хлорида трехвалентного железа и 3-4 капли разбавленного раствора. Затем в первую пробирку прилейте 3-4 капли концентрированной соляной кислоты, во вторую – избыток концентрированного раствора щелочи. Что наблюдается? Во всех ли пробирках исчез осадок? О каких свойствах гидроксида железа (III) свидетельствуют данные реакции? Составьте уравнения соответствующих реакций.
Опыт 6. Окислительные свойства соединений трехвалентного железа. В три пробирки внесите по 3-4 капли раствора хлорида железа (III). Затем в первую пробирку добавьте такой же объем раствора иодида калия, во вторую – сероводородной воды, в третью пробирку поместите кусочек гранулированного цинка. Что наблюдается? Напишите уравнения реакций, учитывая, что железо восстанавливается до двухвалентного состояния.
Опыт 7. Получение соединений шестивалентного железа – ферратов. В пробирку внесите 5-6 капель раствора хлорида железа (III), 7-8 капель концентрированной щелочи и 3-4 капли бромной воды. Содержимое пробирки осторожно подогрейте до окрашивания раствора в фиолетово-красный цвет, свойственный ферратам. Полученный раствор перелейте в стаканчик с небольшим количеством дистиллированной воды и добавьте туда несколько капель раствора хлорида бария. Какое вещество выпало в осадок? Напишите уравнения реакций.
Опыт 8. Получение гидроксидов кобальта (II) и кобальта (III). В две пробирки внесите по 3-4 капли раствора хлорида двухвалентного кобальта и добавляйте по каплям раствор щелочи. Сначала появляется синий осадок основной соли кобальта, который при действии избытка щелочи и нагревании превращается в гидроксид кобальта (II). Напишите уравнения реакций.
В одной пробирке размешайте осадок стеклянной палочкой для обеспечения лучшего соприкосновения гидроксида с кислородом воздуха, в другую добавьте несколько капель раствора пероксида водорода. В каком случае наблюдается окисление гидроксида кобальта? Составьте уравнения соответствующих реакций.
Опыт 9. Получение аммиачного комплекса двухвалентного кобальта и его окисление. Внесите в пробирку 3-4 капли раствора хлорида двухвалентного кобальта и добавляйте по каплям концентрированный раствор аммиака. Вначале выпадает осадок гидроксида кобальта, затем осадок растворяется вследствие образования комплексного соединения кобальта – гидроксида гексаамминкобальта(II). Обратите внимание на цвет раствора.
Полученный раствор разлейте в две пробирки. В первой пробирке перемешайте раствор стеклянной палочкой и наблюдайте за изменением цвета, вызванного окислением комплексного соединения кобальта (II) в комплексное соединение кобальта (III). Во вторую пробирку прилейте несколько капель раствора пероксида водорода. Как изменилась окраска раствора? Напишите уравнения реакций:
а) образования комплексного соединения кобальта (II);
б) его окисления кислородом воздуха и пероксидом водорода в аммиачный комплекс кобальта (III).
Опыт 10. Получение гидроксидов никеля (II) и никеля (III). Внесите в три пробирки по 3-4 капли раствора сульфата никеля (II) и добавляйте по каплям раствор щелочи до выпадения осадка. Попробуйте окислить полученный осадок различными способами. Для этого в первой пробирке перемешайте осадок стеклянной палочкой для лучшего доступа кислорода воздуха; во вторую – добавьте несколько капель раствора пероксида водорода; в третью – несколько капель бромной воды.
В каком случае наблюдается окисление и связанное с ним изменение цвета осадка? Напишите уравнения реакций.
Опыт 11. Получение аммиачного комплекса никеля (II).
Внесите в пробирку 3-4 капли раствора хлорида или нитрата двухвалентного никеля и добавляйте по каплям концентрированный раствор аммиака. Вначале выпадает осадок гидроксида никеля, затем осадок растворяется вследствие образования комплексного соединения – гидроксида гексаамминникеля (II). Обратите внимание на цвет раствора. Напишите уравнения реакций образования гидроксида никеля и последующего его растворения.
Опыт 12. Образование сульфидов железа, кобальта, никеля. В одну из пробирок внесите 3-4 капли раствора хлорида железа (III), во вторую – такой же объем свежеприготовленного раствора сульфата железа (II) (соли Мора), в третью – хлорида кобальта, в четвертую – сульфата никеля. И в каждую пробирку добавьте несколько капель раствора сульфида аммония. Обратите внимание на цвет выпавших осадков. Составьте уравнения соответствующих реакций.
Опыт 13. Гидролиз солей железа, кобальта, никеля. Используя индикаторы, определите реакцию среды растворов солей железа (III), железа (II), кобальта (II), никеля (II). Какая из выбранных солей подвергается наиболее сильному гидролизу? Почему? Составьте уравнения гидролиза в ионной и молекулярной форме.
* Другие названия: промежуточный оксид или двойной оксид.
* Кристаллического вещества, состав которого строго соответствовал бы формуле Fe(OH)3, не существует.
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: нитрат свинца (II), карбонат калия. Какие значения pH имеют растворы их солей?
Решение:
Нитрат свинца (II) Pb(NO3)2– соль слабого двухкислотного основания и сильной кислоты. Катионы слабого основания Pb 2 + связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону:
Сокращенное ионно-молекулярное уравнение гидролиза:
Pb 2 + + H2O 
полное ионно-молекулярное уравнение:
Pb 2+ + 2NO3 — + H2O 
Pb(NO3)2+ H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 2– связывают ионы водорода из воды, образуя анионы кислой соли HCO3 — . Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
CO3 2– + H2O 
полное ионно-молекулярное уравнение:
2K + + CO3 2– + H2O 
K2CO3 + H2O 
Появление избыточного количества ионов OH – обусловливает щелочную реакцию среды (pH > 7).
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: хлорид цинка, сульфит натрия. Какие значения pH имеют растворы этих солей?
Решение:
Хлорид цинка ZnCl2– соль слабого двукислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли ZnOH + .
Сокращенное ионно-молекулярное уравнение гидролиза:
Zn 2+ + H2O 
полное ионно-молекулярное уравнение:
Zn 2+ + 2Cl — + H2O 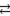
ZnCl2+ 2H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 2– связывают ионы водорода из воды, образуя анионы кислой соли HSO3 — . Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
SO3 2– + H2O 
полное ионно-молекулярное уравнение:
2Na + + SO3 2– + H2O 
Na2SO3 + H2O 
Появление избыточного количества ионов OH – обусловливает щелочную реакцию среды (pH > 7).
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей хлорид кобальта (II), нитрат алюминия. Какие значения pH имеют растворы этих солей?
Решение:
Хлорид кобальта (II) CoCl2– соль слабого двукислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли CoOH + .
Сокращенное ионно-молекулярное уравнение гидролиза:
Co 2+ + H2O 
полное ионно-молекулярное уравнение:
Co 2+ + 2Cl — + H2O 
CoCl2+ 2H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 3+ связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону:
Сокращенное ионно-молекулярное уравнение гидролиза:
Al 3+ + H2O 
полное ионно-молекулярное уравнение:
Al 3+ + 3NO3 — + H2O 
Al(NO3)3+ H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH
http://pandia.ru/text/80/192/33489-6.php
http://poisk-ru.ru/s4411t5.html















