Реферат: Адсорбция и адсорбционные равновесия
| Название: Адсорбция и адсорбционные равновесия Раздел: Рефераты по химии Тип: реферат Добавлен 16:01:44 27 января 2009 Похожие работы Просмотров: 6813 Комментариев: 24 Оценило: 7 человек Средний балл: 4.3 Оценка: 4 Скачать | ||||||||||||||||||||||||||||||||||||||||||
| 1. Изотерма (рис. 8) | 2. Изобара | 3. Изостера |
| А =fT (c) | А =fP (T) | c=fA (T) |
| A=fT (P) | A=fC (T) | P=fA (T) |
Фундаментальное уравнение Гиббса. Определение Гиббсовской адсорбции. Адсорбционное уравнение Гиббса
Считаем V поверхности раздела = 0.
dU = TdS + s dS +
Проинтегрировав, получим: U = TS + sS +
Полный дифференциал от этого уравнения:
dU = TdS + SdT + s dS + 

Подставляя значение dU из (6) в (7) и сократив одинаковые члены правой и левой части, получим:
SdT + Sd s + 
Предположим, что T = const:
Разделив правую и левую часть на поверхность S , получим фундаментальное адсорбционное уравнение Гиббса :



Определение зависимости поверхностного натяжения от адсорбции одного компонента, при постоянстве химических потенциалов других компонентов.

Известно, что 



Активность связана с концентрацией: с = × а . Предположим, что = 1 (при с ® 0). Тогда

Обычно уравнение Гиббса применяют для растворов. Растворителем может быть не только индивидуальное вещество, но и смесь. В разбавленных растворах гиббсовская адсорбция очень мала, а его химический потенциал меняется очень мало с изменением концентрации растворенного вещества, т.е. d m= 0. Поэтому для разбавленного раствора фундаментальное уравнение Гиббса выглядит так:
Из этих уравнений следует, что зная зависимость 

Зная эти производныеуравнения Гиббса, можно рассчитать значение Г , что позволяет построить зависимость Г = f (С) . Уравнение Гиббса показывает, что единица измерения гиббсовской адсорбции не зависит от единицы измерений концентрации, а зависит от размерности величины R . Так как величина R отнесена к молю вещества, а s — к единице площади, то Г = [моль/ единица площади]. Если s выразить в [Дж/м 2 ], то R нужно подставлять: R = 8,314 Дж/моль×К.
Поверхностная активность. Поверхностно-активные и поверхностно-инактивные вещества. Анализ уравнения Гиббса. ПАВ. Эффект Ребиндера. Правило Дюкло-Траубе
В уравнении Гиббса влияние природы вещества на адсорбцию отражается производной

g = [Дж×м/моль] = [Н×м 2 /моль]; [эрг см/моль] = [Гиббс].
Уравнение показывает, что чем сильнее снижается 
Физический смысл поверхностной активности состоит в том, что она представляет силу, удерживающую вещество на поверхности и отнесенную к единице гиббсовской адсорбции .
Поверхностную активность можно представить как отрицательный тангенс угла наклона к касательной, проведенной к кривой Г = f ( C ) в точке пересечения с осью ординат. Поверхностная активность может быть положительной и отрицательной. Значение и знак ее зависят от природы растворенного вещества и растворителя.
1. 
1. 
Экзаменационный билет № 3
Для описания термодинамики поверхностных явлений применяют два метода: метод избыточных величин Гиббса и метод «слоя конечной толщины».

Характеристика величины адсорбции определяющася избытком вещества в поверхностном слое определенной толщины по сравнению с его количеством в таком же объеме фазы, также отнесенным к единице площади поверхности или единице массы адсорбента, называется гиббсовской адсорбцией и обозначается буквой гамма Г (метод избыточных величин Гиббса).
Объединенное уравнение первого и второго начал термодинамики для внутренней энергии поверхности с учетом поверхностной и химической энергии имеет вид (объем поверхностного слоя равен нулю)
Так как внутренняя энергия поверхности пропорциональна экстенсивным величинам, то
и ее полный дифференциал от тех же переменных запишется следующим образом:
Подставляя значение dU, получим:

Разделив полученное уравнение на площадь поверхности, получим:
Данное уравнение называют фундаментальным адсорбционным уравнением Гиббса.
Для адсорбции одного конкретного вещества при постоянных химических потенциалах других веществ полученное уравнение можно записать относительно частной производной для данного компонента:
Принимая во внимание, что
Для гиббсовской адсорбции это выражение принимает вид
Для растворенного вещества это выражение переходит в широко используемые адсорбционные уравнения Гиббса для неэлектролитов  | и для электролитов при их диссоциации в полярной фазе и отсутствии ее в поверхностном слое (при неполярной второй фазе):  |
Общее определение поверхностной активности дается соотношением:
которое справедливо как для неэлектролитов, так и для электролитов.
Поверхностная активность, как и гиббсовская адсорбция, может быть положительной и отрицательной. Абсолютное значение и ее знак зависят от природы как адсорбируемого вещества, так и среды (растворителя). Если с увеличением концентрации вещества поверхностное натяжение на границе раздела фаз понижается, то такое вещество называют поверхностно-активным. Для таких веществ
Вещества, повышающие поверхностное натяжение на границе раздела фаз с увеличением концентрации, называют поверхностно-инактивными. Для них
- Современная теория строения ДЭС (теория Штерна); роль специфической адсорбции, перезарядка поверхности. Примеры образования ДЭС. Строение мицеллы.

Одна часть примыкает непосредственно к межфазной поверхности и образует адсорбционный слои (слой Гельмгсиьца) толщиной δ, которая равна радиусу гидратированных ионов, его составляющих. Другая часть противононов находится в диффузной части — диффузный слой (слой Гуи) с потенциалом φδ, толщина λ которой может быть значительной и зависит от свойств и состава системы. Потенциал в диффузной части двойного электрического слоя не может зависеть линейно от расстояния, так как ионы в нем распределены неравномерно. В соответствии с принятыми представлениями потенциал в слое Гельмгольца при увеличении расстояния от слоя потенциалопределяющих ионов снижается до потенциала диффузного слоя линейно, а затем, как будет показано, по экспоненте. Теория Штерна учитывает также специфическую (некулоновскую, химическую) составляющую адсорбции ионов на поверхности раздела фаз, которая существенным образом может влиять на изменение потенциала.
Пренебрежение размерами ионов приводит к тому, что не принимается во внимание толщина адсорбционною слон, и это, в свою очередь, вызывает большие погрешности при расчете параметров двойного электрического слоя. Кроме того, теория Гуи — Чепмена рассматривая только влияние концентрации и заряда ионов электролитов на изменение потенциала, не объясняет различного действия ионов разной природы, связанного со специфической адсорбцией их на межфазной поверхности.
Штерн предложил рассматривать слой противоионов состоящим из двух частей: внутренней (плотный слой Гельмгольца) и внешней (диффузный слой). Таким образом, теорию Гуи — Чепмена можно использовать для описания только строения внешней части слоя, где можно пренебречь адсорбционными силами и размерами ионов. Внутреннюю (плотную) часть Штерн представил как адсорбционный моноионный слой, в котором противоионы примыкают к поверхности благодаря электростатическим силам и специфическому взаимодействию. Введенный Штерном потенциал φδ часто называют штерновским. В плотной части двойного электрического слоя потенциал уменьшается линейно от φ0 до φδ. Принимая текущими переменными φ и х вместо φδ и δ, получим:
Штерн попытался учесть влияние специфической адсорбции ионов на электрический потенциал, обусловленный действием ковалентных сил дополнительно к электростатическим силам. Так как радиус действия сил такой адсорбции соизмерим с размером ионов, это дает основание учитывать копалентные силы только для ионов, входящих в плотный слой Гельмгольца. Как видно из рисунка, плотность поверхностного заряда противоионов можно разделить на две части: плотность заряда qГ, обусловленного моноионным слоем, представляющим собой слой Гельмгольца, и плотность заряда qδ диффузного слоя Гуи. Общая поверхностная плотность заряда двойного электрического слоя равна сумме поверхностных плотностей зарядов плотного и диффузного слоев с обратным знаком:
По Штерну, заряд слоя Гельмгольца складывается из заряда ионов, адсорбированых как за счет электростатического адсорбционного потенциала Fzφ, так и за счет потенциала
специфической адсорбции Ф. Было предположено, что поверхность имеет определенное число адсорбционных центров, каждый из которых взаимодействует с одним противоионом.
Пример образования ДЭС:

Сильно адсорбирующиеся ионы в плотном слое иногда способны не только полностью скомпенсировать поверхностный потенциал, но и создать избыточный заряд со знаком заряда противоионов. Это явление называется перезарядкой. Перезарядка приводит к смене противоионов в диффузном слое на ионы с зарядом другого знака.
На рисунке видно, что при перезарядке поверхностный потенциал φ0 и потенциал диффузного слоя φδ имеют разные знаки.

В дисперсных системах двойной электрический слой возникает на поверхности частиц. Частицу дисперсной фазы в гетерогенно-дисперсной системе вместе с двойным электрическим слоем называют мицеллой. Строение мицеллы можно показать той же формулой, что и строение двойного электрического слоя. Внутреннюю часть мицеллы составляет агрегат основного вещества. На поверхности агрегата расположены потенциалопре-деляющие ионы. Агрегат вместе с потенциалопределяющими ионами составляет ядро мицеллы. Ядро с противоионами плотной части двойного электрического слоя образуют гранулу. Гранулу окружают противоионы диффузного слоя. Мицелла в отличие от гранулы электронейтральна.
УРАВНЕНИЕ АДСОРБЦИИ ГИББСА
Выше (п. 2.4) мы пришли к выводу, что процесс адсорбции обусловлен снижением поверхностного натяжения. Очевидно, чем в большей степени ПАВ снижает поверхностное натяжение, тем большей должна быть его адсорбция. Напротив, ПИВ должна быть присуща отрицательная адсорбция.
Исходя из второго закона термодинамики американский ученый Дж. Гиббс в 70–х гг. XIX в. вывел важное уравнение, связывающее величину адсорбции со способностью растворенного вещества изменять поверхностное натяжение раствора:

где Гi, – избыточная адсорбция i-го компонента (см. 2.10), ci – его молярная концентрация в растворе, Т – температура, при которой происходит адсорбция, R – газовая постоянная, 
В такой форме уравнение Гиббса применяется для разбавленных растворов. Вы, очевидно, помните, что для концентрированных растворов концентрацию нужно заменить активностью:

Уравнение Гиббса было выведено теоретически. В дальнейшем оно было подтверждено экспериментально Мак–Беном методом среза тонких слоев с последующим их химическим анализом. Аналогичные исследования были проведены Сазаки с использованием метода радиоактивных индикаторов.
Проанализируем уравнение Гиббса.
Если 

Рис. 3.2. Определение избыточной адсорбции
Рис. 3.3. Изотерма адсорбции
Значение избыточной адсорбции для любой концентрации
| сi |  | Zi | Гi | сi |  | Zi | Гi |
| c1 |  1 1 | Z1 | Г1 | c4 |  4 4 | Z4 | Г4 |
| c2 |  2 2 | Z2 | Г2 | … | … | … | … |
| c3 |  3 3 | Z3 | Г3 | … | … | … | … |
ПОВЕРХНОСТНАЯ АКТИВНОСТЬ.
ПРАВИЛО ДЮКЛО-ТРАУБЕ
Из уравнения Гиббса следует, что характеристикой поведения вещества при адсорбции является величина производной 


[g] = Дж–м 3 /м 2 -моль = Дж–м/моль или Н-м 2 /моль.
Чем в большей степени уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше поверхностная активность этого вещества, и тем больше его гиббсовская адсорбция.
Поверхностную активность можно определить графически как отрицательное значение тангенса угла наклона касательной, проведенной к кривой 
Таким образом, для ПАВ: g > 0; 
2. В гомологическом ряду прослеживаются четкие закономерности в изменении поверхностной активности (g): она возрастает по мере увеличения длины углеводородного радикала.
На основании большого экспериментального материала в конце XIX в. Дюкло и Траубе сформулировали правило:
Поверхностная активность предельных жирных кислот в водных растворах возрастает в 3–3,5 раза при удлинении углеводородной цепи на одно звено (группу –CH2).
На рис. 3.4 приведены изотермы поверхностного натяжения для ряда кислот.
Рис.3.4. Изотерма поверхностного натяжения некоторых кислот
1 – СН3СООН – уксусная кислота (nс=1); 2 – СН3СН2СООН – пропионовая кислота (nс =2); 3 – СН3(СН2)2СООН – масляная кислота (nс =3); 4 – СН3(СН2)3СООН – изовалериановая кислота (nс = 4); 5 – СН3(СН2)4СООН – капроновая кислота (nс =5); nс – число атомтов С в углеводородном радикале.
Рис. 3.6 Ориентация молекул ПАВ на поверхности водного раствора
а – при малых концентрациях; б – при умеренных концентрациях; в – в насыщенном адсорбционном слое.
При малых концентрациях углеводородные цепи, вытолкнутые в воздух, «плавают» на поверхности воды, тогда как полярная группа погружена в воду (рис. 3.6а), такое положение возможно из-за гибкости углеродной цепи. С ростом концентрации число молекул в поверхностном слое увеличивается, цепи поднимаются. Какие-то из них принимают вертикальное положение (рис. 3.6б). В насыщенном адсорбционном слое поверхность воды оказывается сплошь покрытой «частоколом» из вертикально ориентированных молекул ПАВ (рис. 3.6в), значение поверхностного натяжения в этом случае приближается к значению, характерному для чистого жидкого ПАВ на границе с воздухом.
Из-за вертикальной ориентации молекул ПАВ в поверхностном слое максимальная адсорбция ( 
Экспериментально найденная величина 
Предельная избыточная адсорбция ПАВ равна:

где 

где Na — число Авогадро.
Подставляя полученное значение S1,2 в уравнение (3.5), получаем


Так было найдено, что поперечный размер So молекул всех жирных кислот равен 20 * 10 -16 см 2 , а предельных спиртов – 25 * 10 -16 см 2 . Из величины предельной адсорбции была найдена также длина молекулы 
Масса 1 см 2 поверхностного слоя равна
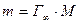
где М – молярная масса ПАВ.
В то же время плотность

так как объем 1 см 3 поверхностного слоя равен 

Экспериментальные данные показали, что длина молекулы ПАВ 

Таким образом, размеры молекул впервые в истории химии были определены коллоидно-химическим методом. В дальнейшем эти результаты были подтверждены другими методами.
УРАВНЕНИЕ ШИШКОВСКОГО
В 1908 г. киевский ученый Б. А. Шишковский эмпирическим путем получил уравнение, связывающее поверхностное натяжение водных растворов ПАВ с их концентрацией:

где 

Для того чтобы выяснить физический смысл постоянной В, обратимся к.уравнению Гиббса:

Разделим переменные и примем, что
Интегрируем это уравнение, принимая во внимание, что . 

где А – постоянная интегрирования.
Уравнение (3.12) получено в результате преобразования уравнения Гиббса для предельной адсорбции. Теперь для этих же условий запишем уравнение Шишковского, принимая во внимание, что максимальная адсорбция может быть достигнута при достаточно больших концентрациях ПАВ.
Тогда с >> 1, Кс >> 1 и 1 + Кс 

Сравнивая уравнения (3.13) и (3.12), видим, что

Теперь становится понятным, почему величина В в уравнении Шишковского остается постоянной в пределах одного гомологического ряда.
Однако смысл удельной капиллярной постоянной К пока остается неясным
ТЕОРИЯ МОНОМОЛЕКУЛЯРНОЙ
АДСОРБЦИИ ЛЕНГМЮРА
Отметим основные положения этой теории.
1. Адсорбция мономолекулярна.
2. При адсорбции устанавливается динамическое равновесие, которое можно рассматривать как квазихимическое. В условиях равновесия скорости процессов адсорбции и десорбции равны.
Константа адсорбционного равновесия

где кадс – константа скорости адсорбции; кдес – константа скорости десорбции.
Исходя из данной теории было выведено уравнение, которое мы приводим без вывода:

где 
Зависимость величины адсорбции от концентрации представлена на рис.3.7.
На кривой четко видны три участка:
I участок – прямая линия, выходящая из начала координат. Действительно, из уравнения Ленгмюра (3.15) при малых концентрациях Кс > 1 и 1 + Кс 
II участок – соответствует криволинейной части графика и описывается полным eравнением Ленгмюра (3.15).
Рис.3.7. Зависимость адсорбции от концентрации ПАВ.
Чтобы найти постоянные в уравнении Ленгмюра, его следует привести к линейной форме. Для этого правую и левую части уравнения надо «перевернуть»:

Умножим обе части уравнения (3.16) на с:

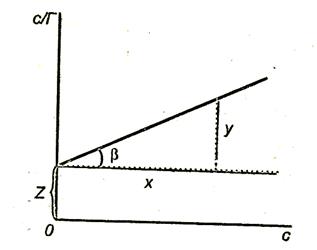
На рис. 3.8. показан график 
Тангенс угла наклона 
Отрезок, отсекаемый прямой на оси ординат,
Рис.3.8. Зависимость величины с/Г от концентрации ПАВ.
Доказано, что К в уравнении Шишковского (удельная капиллярная постоянная) и К в уравнении Ленгмюра (константа адсорбционного равновесия) – это одна и та же величина.
Построив график 

Так как адсорбция рассматривается как псевдохимическая реакция, на основе химической термодинамики можно записать

где Аmах – работа адсорбции.
Шишковский эмпирическим путем установил, что константа К увеличивается в 3–3,5 раза при удлинении цепи на одно звено –СН2.
Напишем выражение для разности работ адсорбции двух соседних членов гомологического ряда.
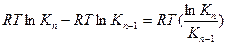

где n – число атомов углерода в углеводородном радикале.
Это означает, что для перевода каждой –СН2–группы из поверхностного слоя в объемную фазу надо затратить 3,2 кДж/моль энергии. Это работа раздвижения диполей воды на величину объема –СН2–группы – величина аддитивная и одинаковая для различных рядов алифатических предельных соединений. Постоянная разность работ адсорбции для двух соседних членов превращается в постоянное отношение (3–3,5), фигурирующее в правиле Дюкло–Траубе. Сущность этого правила, таким образом, заключается в том, что работа адсорбции на каждую –СН2–группу является постоянной, близкой к 3,5 кДж/молъ.
В заключение отметим, что помимо уравнения Гиббса, Шишковского и Ленгмюра существует уравнение Фрумкина, позволяющее рассчитать изменение поверхностного натяжения в результате адсорбции:

ЗАКЛЮЧЕНИЕ
Адсорбция поверхностно-активных веществ (ПАВ) на поверхности «жидкий раствор–газ» – самопроизвольный процесс, обусловленный уменьшением поверхностного натяжения. Для поверхностно-инактивных веществ (ПИВ), повышающих поверхностное натяжение, характерна отрицательная адсорбция.
Основным уравнением адсорбции является уравнение Гиббса, связывающее величину избыточной адсорбции с концентрацией ПАВ и его поверхностной активностью. Кривая, выражающая зависимость поверхностного натяжения от концентрации ПАВ при постоянной температуре, называется изотермой поверхностного натяжения. Тангенс угла наклона к оси абсцисс касательной к изотерме поверхностного натяжения при с 
Поверхностная активность ПАВ, согласно теории Ленгмюра, обусловлена дифильным строением их молекул: полярные группы втягиваются в глубь фазы, а неполярные углеводородные части выталкиваются в неполярную среду (воздух, газ), снижая тем самым поверхностное натяжение. С увеличением углеродной цепи на одну –СН2–группу поверхностная активность увеличивается в 3-3,5 раза (правило Дюкло–Траубе). Исходя из теории Ленгмюра, были впервые рассчитаны площадь, занимаемая одной молекулой, и длина молекулы ПАВ.
Зависимость величины адсорбции ПАВ от концентрации выражается уравнением Ленгмюра, выведенным исходя из представлений о скоростях процессов адсорбции и десорбции. Соответствующий график Г = f(с) называется изотермой Ленгмюра.
Изменение поверхностного натяжения в зависимости от адсорбции рассчитываются по уравнению Фрумкина.
ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОКОНТРОЛЯ
1. Какие вещества называются поверхностно-активными, поверхностно-инактивными?
2. В чем состоят особенности строения молекул ПАВ и ПИВ и их адсорбции?
3. Как зависит поверхностное натяжение от концентрации ПАВ в растворе?
4. Что называется поверхностной активностью? Как ее можно определить графически и аналитически?
5. В чем заключается правило Дюкло–Траубе?
6. Как графически и аналитически можно определить предельную адсорбцию?
7. Как рассчитать площадь, занимаемую молекулой, и толщину поверхностного слоя?
8. Для водных растворов изоамилового спирта константы уравнения Шишковского: В = 21,12 * 1СГ 3 Дж/м 2 ; К = 42,0 м 3 /кмоль. Поверхностное натяжение чистой воды при заданной температуре равно 72,9 * 10 -3 Дж/м 2 :
а) определите поверхностное натяжение растворов концентраций: 0,012; 0,016; … 0,032 кмоль/м 3 ,
б) постройте изотерму поверхностного натяжения,
в) определите графически поверхностную активность спирта,
г) по уравнению Гиббса вычислите адсорбцию спирта для заданных в п. а) концентраций,
д) постройте изотерму адсорбции и определите графи чески предельную адсорбцию,
е) определите площадь, занимаемую одной молекулой спирта в поверхностном слое.
9. Сравните поверхностную активность этанола и н-бутанола в водных растворах одинаковой концентрации.
10 Изотерма адсорбции ПАВ описывается уравнением Ленгмюра Г=Гmах*(Кс/(1 + Кс)). Найдите графическим методом константы Гmах и К.
11. Предельная адсорбция пропионовой кислоты равна 4,18 * 10 -6 моль/м 2 . Рассчитайте значение константы В в уравнении Шишковского, при стандартной температуре.
Закончив изучение главы 3, вы должны
1. понятия «поверхностно–активные» и «поверхностно-инактивные» вещества, «поверхностная активность»;
2. от чего зависит поверхностная активность ПАВ;
3. сущность теории мономолекулярной адсорбции Ленгмюра;
4. уравнения Гиббса, Шишковского, Ленгмюра, Фрумкина, какие зависимости каждое из них выражает;
1. строить изотерму поверхностного натяжения и определять графически поверхностную активность;
2. рассчитывать поверхностную активность по уравнению Гиббса;
3. рассчитывать поверхностное натяжение по уравнению Шишковского;
4. строить изотерму гиббсовской адсорбции и определять предельную адсорбцию ПАВ;
5. исходя из предельной адсорбции рассчитывать поперечный размер So и длину молекул 
http://poisk-ru.ru/s43997t1.html
http://lektsii.org/3-59744.html