Фундаментальное уравнение Гиббса для открытых систем
Фундаментальное уравнение Гиббса для открытых систем — Лекция, раздел Химия, Курс лекций по физической химии 8.1. Дифференциалы Характеристических Функций.
8.1. Дифференциалы характеристических функций
dU = TdS – pdV — dW’
Гиббс ввел в качестве переменной массу, а точнее количество молей компонентов, т.е. для открытых систем нужно учесть химическую работу, которую можно представить как обмен веществом с окружающей средой.
dWхим. = — 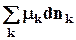
dU = TdS – pdV + 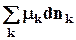
dН = TdS + Vdp + 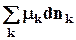
dA = — SdT – pdV + 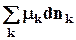
dG = Vdp –SdT +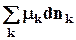
Эта тема принадлежит разделу:
Курс лекций по физической химии
На сайте allrefs.net читайте: «курс лекций по физической химии»
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Фундаментальное уравнение Гиббса для открытых систем
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
Все темы данного раздела:
Предмет, структура и методы физической химии
1.1. Физическая химия изучает общие вопросы химического строения веще-ства, общие количественные закономерности химического равновесия и химических процессов, а также физических явлений, которые их
Термодинамические системы
2.1.1. Термодинамическая система – это часть материального мира, отделенная от окружающей среды реальными или воображаемыми границами и являющаяся объектом исследования. Окр
По составу
Термодинамическая система состоит из компонентов. Компонент — это вещество, которое может быть выделено из системы и существовать вне ее, т.е. компоненты – это независимые в
Определение
Состояние ТДС – это совокупность всех ее измеримых макроскопических свойств, имеющих, следовательно, количественное выражение. Макроскопический характер свойств означает, что и
Равновесие
Классическая термодинамика обычно ограничивается рассмотрением равновесных состояний ТДС. Равновесие — это такое состояние, к которому самопроизвольно приходит ТДС, и в кото
Внутренняя энергия как функция состояния системы
Циклический процесс Нециклический процесс (1→2) p1 V1, T1 p1 V1, T1
Изохорное нагревание
dQv = n CvdT = dUv ê: n Þ dUV = CvdT Þ Cv =
Стехиометрическое уравнение химической реакции и химическая переменная
Обычная запись уравнения химической реакции ênA ê A + ênB êB = nC C + nD D, или в общем виде
Теплоты химических реакций и их связь с изменением термодина-мических функций
4.2.2.1. Теплота при постоянном объеме Теплотой химической реакции называют количество те
Формулировка
Теплота реакции не зависит от пути протекания процесса, т.е. промежуточных химических стадий, через которые он проходит, а только от начального и конечного состояния веществ. З
Расчет изменеия термодинамических функций в химических реакциях
По закону Гесса теплоту реакции можно представить в виде суммы изменения внутренней энергии всех веществ, участвующих в реакции
Первое следствие
4.4.1.1. Понятие стандартной теплоты образования вещества Согласно 1-ому закону термодинамики невозможно измерить абсолютное значение энергии, а только ее изменение. Поэтому нужно выбрать
Экспериментальное определение теплот реакций
4.4.2.1. Калориметрия – метод непосредственного экспериментального измерения теплот химических реакций в приборе, называемом калори-метром. Различают калориметры
Приближенный расчет теплот химических реакций по знергиям связи
4.5.1. Энергия связи – это средняя энергия, необходимая для разрыва связи в 1 моле газообразного вещества до состояния газообразных атомов: HClгаз
Теплота растворения
Раствор – это фаза переменного состава, существующая в определенных пределах термодинамических параметров. Раствор – гомогенная система, состоящая из двух или более компонентов. Свойства раствора з
Энергия молекул как сумма энергий различного вида движения
Внутренняя энергия – это сумма энергии частиц, составляющих термодинамическую систему. В идеальном газе отсутствует энергия взаимодействия молекул, поэтому внутренняя энергия определяется как сумма
Теплоемкость твердых тел
В твердом теле единственным видом движения является колебания элементов кристаллической решетки, ячейки которой повторяются в пространстве. Твердое тело (например, металл) можно представить как наб
Анализ уравнения Кирхгоффа
4.8.5.1. DrСр = 0 DrНT1= DrНT2 . Теплота реакции не зависит
Интегрирование уравнения Кирхгоффа
4.8.6.1. Для пересчета теплоты реакции с одной температуры на другую нужно использовать определенный интеграл
Второй закон термодинамики
Первый закон термодинамики устанавливает эквивалентность различных видов энергии и форм их передачи. 2-ой закон термодинамики говорит скорее об обратном. Теплота и работа в определенном смысле неэк
P,T p,T p,T
nk/ Snk = Nk мольная доля DS = DSa + DS
Статистический смысл энтропии
Термодинамические соотношения не зависят от природы веществ, но термодинамические свойства индивидуальных соединений находят опытным путем. Задача статистической термодинамики – определение характе
Термодинамическая вероятность
5.5.3.1. В равновесии термодинамические параметры системы постоянны , но микрохарактеристики молекул претерпевают непрерывные изменения. Таким образом, макросостояния системы реализуется множеством
Процессы , ведущие к увеличению энтропии
5.5.5.1. Увеличение числа частиц, например, распад молекул, диссоциация. 5.5.5.2. Увеличение объема фазового пространства, т.е. увеличение числа ячеек, или возможных состояний. а)
Формулировки
6.1.1. Тепловая теорема Нернста (1906 г.) При температуре, близкой к абсолютному нулю, многие свойства системы становятся независимыми от температуры, т.е. становятся пост
Остаточная энтропия
Реальные кристаллы могут иметь дефекты – дырки по Шоттки и Френкелю, дислокации, нарушения кристаллической решетки, основной уровень может быть вырожденным. В этих случаях энтропия при абсолютном н
Фундаментальное уравнение Гиббса
Уравнение 2-го закона не очень удобно для использования, так как в нем характеристики системы выражаются через функции процесса. Желательно, чтобы свойства системы выражались через ее параметры. Дл
Критерии направления самопроизвольных процессах в изотермических условиях. Термодинамические потенциалы
Фундаментальные уравнения Гиббса определяют свойства термодинамических систем, когда в качестве независимых переменныых выступают экстенсивные параметры (U, VилиS, V),
Физический смысл
Проинтегрируем фундаментальное уравнение Гиббса при T, p = const dU — TdS + pdV £ — dW’ d(U –TS +PV) £ — dW’ D(U –TS
Характеристические функции
7.3.1. Определение. Характеристические функции — это экстенсивные функции состояния системы, посредством которых, а также производных от них различных порядков по
Полные дифференциалы и частные производные характеристиче-ских функций в закрытых системах (урпанения Массье)
dU = TdS – pdV Эти выражения получились как преобразования dН = TdS – Vdp фундаментального уравнения Гиббса к другим dA = –SdT – pdV
Зависимость энергии Гиббса от температуры и давления
G º U + pV– TS º H – TS(7.21) DG pT º D H -TDS, D rG pT º D rH -TDrS(7.22)
Понятие химического потенциала
mka — химический потенциал всегда является интенсивной характеристикой состояния компонента k в фазе a.
Уравнение Гиббса-Дюгема
Напишем полный дифференциал внутренней энергии из определения (8.7) dU = TdS + SdT – pdV – Vdp +
Выражение химического потенциала компонента идеального газа
8.5.1. Чистое вещество в закрытой системе (n = const) m = G/n = G. dG = — SdT + Vdp
Смесь газов
Рассмотрим процесс смешения: исходное состояние – 2 газа в стандартных условиях, конечное состояние смесь газов при той же температуре и том же общем давлении.
Общее условие химического равновесия в закрытой системе
В химической реакции происходит изменение числа молей компонентов в соответствии со стехиометрическим уравнением 0 =S nkAk. Этим системы с химическими реакция
Гомогенные газовые реакции
Уравнение изотермы химической реакции определяет изменение энергии Гиббса за один пробег (=1) химической реакции при пос
Гетерогенные реакции
Такие реакции протекают на границе раздела фаз. Рассмотрим реакцию FeOтв. + H2газ = Feтв. + H2Oж. n -1 -1 1
Влияние давления на направление реакции
Уравнение изотермы химической реакции позволяет определить, как изменяется направление реакции, если мы изменяем общее давление в системе 3/2 H2 + 1/2N2 = NH
Константа равновесия
DGpT = DGT0+ RT lnP p*knk = DGT0 + RT ln
Идеальный газ при постоянном давлении и температуре
Парциальные давления компонентов газовой смеси можно выразить через их мольные доли и общее давление в системе р*к = робщ.хk, отсюда
Вывод уравнения Вант-Гоффа
Для вывода потребуются 2 уравнения:уравнение Гиббса-Гельмгольца (7.30) и уравнение изотермы химической реакции – DrGTº = RT ln Kp.
Использование уравнения Вант-Гоффа
9.4.3.1. Определение DrHº по температурной зависимости константы равновесия а) две точки в небольшом интервале температур, Dr
Экспериментальное определение констант равновесия
-DrGºT = RT ln Kp. Положительное значение DrGºTне означает, что реакция вообще не может идти, она
Статистические расчеты констант равновесия
Все термодинамические функции выражаются через статистические суммы веществ Q = Si gi exp(-ei/kT)
Фундаментальные уравнения термодинамики. Преобразования Лежандра.
Глава 4. фундаментальные уравнения термодинамики. характеристические функции.
Фундаментальные уравнения термодинамики. Преобразования Лежандра.
Термодинамика как наука о наиболее общих свойствах макроскопических систем, находящихся в состоянии термодинамического равновесия, и о процессах перехода между этими состояниями построена просто – опытным путем установлены два ее основных закона, а применение к ним математического аппарата позволяет получить очень важные термодинамические соотношения.
Основой математического аппарата термодинамики является объединенное уравнение первого и второго законов термодинамики илифундаментальное уравнение Гиббса, которое для обратимых процессов записывается в виде

где все параметры относятся к системе; PdV – механическая работа расширения системы; δW* – полезная работа системы (сумма немеханических видов работы, см. раздел 2.3)
Для простых систем в случае обратимых процессов фундаментальное уравнение записывается в виде
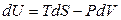
В математике независимыми переменными считаются те, которые стоят под знаком дифференциала. В фундаментальном уравнении (4.1) независимыми переменными являются S, V и все yk. Однако эти независимые параметры неудобны, так как энтропия непосредственно не измеряется, а объем легко определяется только для газов. Поэтому возникает задача перехода к новым независимым переменным.
Преобразование, меняющее ролями зависимые и независимые переменные, носит название преобразования Лежандра.
Рассмотрим функцию нескольких переменных:
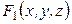
Полный дифференциал этой функции равен
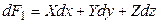
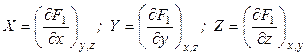
Введем новую функцию
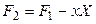
Полный дифференциал этой функции будет равен
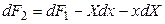
Подставив в равенство (4.5) значение dF1 из (4.3), получим:
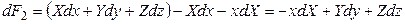
Cледовательно, в результате преобразования осуществлен переход от независимых переменных x, y, z к независимым переменным X, y, z, то есть переменная х стала зависимой, а Х – независимой. Кроме того, получили новую функцию F2. Таким образом, чтобы поменять зависимую переменную на независимую, следует воспользоваться соотношением
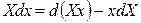
Впервые преобразование Лежандра к термодинамическим функциям применил Ф. Масье в 1869 году. Фундаментальное уравнение темодинамики для простых систем как для обратимых, так и для необратимых процессов запишется в виде:
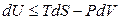
Знак неравенства используется для необратимых процессов, а знак равенства – для обратимых процессов. Применив к произведению PdV соотношение (4.7)
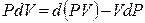
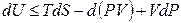
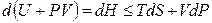
В результате перешли к независимым переменным S и Р и получили под знаком дифференциала в левой части (4.10) новую функцию
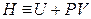
которая называется энтальпией.
Воспользовавшись подстановкой Лежандра для произведения TdS
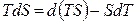
и подставив ее в фундаментальное уравнение (4.8), получим:
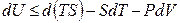
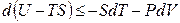
Стоящую под знаком полного дифференциала функцию U – TS обозначают по рекомендациям IUPAC символом Аи называютэнергией Гельмгольца(в некоторых учебниках энергию Гельмгольца до настоящего времени обозначают символом F):
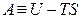
Итак, соотношение (4.14) записывается следующим образом:
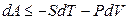
то есть в результате преобразований введена новая функция состояния при независимых переменных Т и V.
Преобразовав по Лежандру сразу оба произведения TdS и PdV в уравнении (4.8), получим:

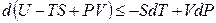
Функция U – TS + PV обозначается символом Gи называется энергией Гиббса. Следовательно, соотношение (4.18) запишется в виде:
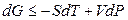
и энергия Гиббса является функцией независимых переменных Т и Р.
Дата добавления: 2015-08-20 ; просмотров: 3139 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Термодинамика открытых систем
Вы будете перенаправлены на Автор24
В термодинамике под открытой понимается такая термодинамическая система, которая обладает способностью к обмену с окружающей средой массой, работой и теплотой. Системами открытого типа считаются живые системы, которые также называют неравновесными.
Живой организм может получать пищу, воду и кислород из внешней среды, при этом он выделяет в нее разные вещества. Теплообмен осуществляется между средой и организмом.
Открытые системы
Рисунок 1. Термодинамика для открытых систем. Автор24 — интернет-биржа студенческих работ
Открытые системы способны производить непосредственный энергообмен с окружающей средой посредством вещества, информации и импульса. Все реальные системы будут считаться при этом открытыми. К самому значимому типу открытых систем относятся химические, в пределах которых осуществляются определенные реакции.
Живые организмы и экосистемы также можно рассматривать как открытые химические системы. Такой подход позволяет проводить важные исследования процессов их жизнедеятельности и активного развития на платформе законов неравновесной термодинамики, физической и химической кинетики. Открытые системы в условиях неорганической природы осуществляют определенный обмен с внешней средой, состоящей из разных систем. Этим системам свойственны вещество и энергия.
Неравновесное состояние в этом случае будет характеризоваться параметрами, аналогичными равновесным:
- определенной температурой;
- химическим потенциалом компонентов системы.
Энтропия в открытых системах также сохранит свою неизменность. Это объясняется тем, что в них осуществляются необратимые процессы, но при этом энтропия накапливаться не будет. Она выводится в окружающую среду.
Готовые работы на аналогичную тему
Свойства открытых систем в термодинамике
В открытых системах наиболее уникальные свойства будут проявляться в условиях нелинейных процессов (когда в них мы наблюдаем вероятность появления термодинамических, устойчивых неравновесных состояний). При этом их характеризует определенная временная (пространственная) упорядоченность. Это диссипативная структура, само существование которой подразумевает наличие факта непрерывного обмена окружающей среды с веществом (энергией).
Автором первого определения открытой системы стал австрийский физик Э. Шредингер. Он сделал акцент на особенности биологических систем, которая должна заключаться в непосредственном энерго-вещественном обмене с окружающей средой. Система, взаимодействующая со средой, не способна сохранять свою замкнутость. Это объясняется тем, что она должна получать новые вещества или энергию. При этом данная система должна одновременно выводить в пространство отработанную энергию (использованное вещество).
При поступлении энергии (или вещества) неравновесность в системе растет. Следствием этого становится процесс разрушения прежних связей элементов системы друг с другом, которые определяют ее структуру. В такой ситуации возникают новые связи между элементами, они способствуют кооперативным процессам.
В качестве примера наглядной демонстрации процессов самоорганизации можно рассмотреть работу лазера. Хаотические колебательные движения, которые совершают частицы кристалла, будут приводиться в движение за счет энергии, поступающей извне. Это провоцирует повышение мощности лазерного излучения. Г. Хакен, исследуя процессы самоорганизации в лазере, охарактеризовал новое направление исследований – синергетическое.
В качестве еще одного примера можно рассматривать самоорганизацию в химических реакциях. Она связана с поступлением извне новых реагентов – веществ. Эти вещества отвечают за обеспечение продолжения реакции и за выведение в окружающую среду ее продуктов.
В формате открытых систем нелинейные процессы изучаются на базе уравнений химической кинетики. Накапливающиеся в открытых системах активные продукты реакции (теплоты) могут спровоцировать автоколебательный режим реакций. Для этого будет нужна реализация в системе обратной связи. Это, в свою очередь, характеризуется ускорением реакции под воздействием или продукта, или теплоты, выделяющейся при реакции.
Что касается открытой химической системы, то в ней (с наличием положительной обратной связи) возникают саморегулирующиеся непрекращающиеся химические реакции. Внешне самоорганизация проявляется с возникновением концентрических волн в жидкой среде. Это особенно заметно в автоколебательных реакциях, открытых Б. Белоусовым.
На основании проводимых Р. Пригожиным экспериментов с периодическими реакциями, ему удалось построить брюсселятор (теоретическую модель, положенную впоследствии в основу нелинейной или неравновесной термодинамики).
Рисунок 2. Энтропия в открытых системах. Автор24 — интернет-биржа студенческих работ
Нелинейность в термодинамике означает задействование в ней нелинейных математических уравнений, где содержатся переменные во второй или выше степени. Открытие самоорганизации системы в условиях простейшей неорганической природы играет существенную роль в научном и мировоззренческом понимании. Это демонстрирует вероятность осуществления процессов в основе материи и рассматривает взаимосвязь органической и неорганической природы.
С позиции самоорганизации весь окружающий мир и Вселенная будут представлять собой комплекс разносторонних и самоорганизующихся процессов, выступающих основанием для любой эволюции.
Энтропия открытых систем в термодинамических процессах
При неравновесном состоянии энтропия открытых систем определяется суммой значений энтропий отдельных малых элементов в системе. Эти элементы пребывают в состоянии локального равновесия (следствие аддитивности энтропии).
Потоки энергии и вещества в системе провоцируются процессом отклонений параметров термодинамики от их равновесных значений. Повышение энтропии системы становится возможным за счет процессов переноса. Энтропия в рамках замкнутых систем будет расти и при этом стремиться к своему максимуму и равновесному значению.
В открытой системе допускается вероятность стационарных состояний с постоянной энтропией (при условии ее постоянного производства). При этом энтропия должна быть отведена от системы. В термодинамике открытых систем стационарному состоянию отводится роль, аналогичная термодинамическому равновесию (термодинамика равновесных процессов в отношении изолированных систем).
http://helpiks.org/4-93290.html
http://spravochnick.ru/koncepciya_sovremennogo_estestvoznaniya/termodinamika_otkrytyh_sistem/