Термодинамика открытых систем
Вы будете перенаправлены на Автор24
В термодинамике под открытой понимается такая термодинамическая система, которая обладает способностью к обмену с окружающей средой массой, работой и теплотой. Системами открытого типа считаются живые системы, которые также называют неравновесными.
Живой организм может получать пищу, воду и кислород из внешней среды, при этом он выделяет в нее разные вещества. Теплообмен осуществляется между средой и организмом.
Открытые системы
Рисунок 1. Термодинамика для открытых систем. Автор24 — интернет-биржа студенческих работ
Открытые системы способны производить непосредственный энергообмен с окружающей средой посредством вещества, информации и импульса. Все реальные системы будут считаться при этом открытыми. К самому значимому типу открытых систем относятся химические, в пределах которых осуществляются определенные реакции.
Живые организмы и экосистемы также можно рассматривать как открытые химические системы. Такой подход позволяет проводить важные исследования процессов их жизнедеятельности и активного развития на платформе законов неравновесной термодинамики, физической и химической кинетики. Открытые системы в условиях неорганической природы осуществляют определенный обмен с внешней средой, состоящей из разных систем. Этим системам свойственны вещество и энергия.
Неравновесное состояние в этом случае будет характеризоваться параметрами, аналогичными равновесным:
- определенной температурой;
- химическим потенциалом компонентов системы.
Энтропия в открытых системах также сохранит свою неизменность. Это объясняется тем, что в них осуществляются необратимые процессы, но при этом энтропия накапливаться не будет. Она выводится в окружающую среду.
Готовые работы на аналогичную тему
Свойства открытых систем в термодинамике
В открытых системах наиболее уникальные свойства будут проявляться в условиях нелинейных процессов (когда в них мы наблюдаем вероятность появления термодинамических, устойчивых неравновесных состояний). При этом их характеризует определенная временная (пространственная) упорядоченность. Это диссипативная структура, само существование которой подразумевает наличие факта непрерывного обмена окружающей среды с веществом (энергией).
Автором первого определения открытой системы стал австрийский физик Э. Шредингер. Он сделал акцент на особенности биологических систем, которая должна заключаться в непосредственном энерго-вещественном обмене с окружающей средой. Система, взаимодействующая со средой, не способна сохранять свою замкнутость. Это объясняется тем, что она должна получать новые вещества или энергию. При этом данная система должна одновременно выводить в пространство отработанную энергию (использованное вещество).
При поступлении энергии (или вещества) неравновесность в системе растет. Следствием этого становится процесс разрушения прежних связей элементов системы друг с другом, которые определяют ее структуру. В такой ситуации возникают новые связи между элементами, они способствуют кооперативным процессам.
В качестве примера наглядной демонстрации процессов самоорганизации можно рассмотреть работу лазера. Хаотические колебательные движения, которые совершают частицы кристалла, будут приводиться в движение за счет энергии, поступающей извне. Это провоцирует повышение мощности лазерного излучения. Г. Хакен, исследуя процессы самоорганизации в лазере, охарактеризовал новое направление исследований – синергетическое.
В качестве еще одного примера можно рассматривать самоорганизацию в химических реакциях. Она связана с поступлением извне новых реагентов – веществ. Эти вещества отвечают за обеспечение продолжения реакции и за выведение в окружающую среду ее продуктов.
В формате открытых систем нелинейные процессы изучаются на базе уравнений химической кинетики. Накапливающиеся в открытых системах активные продукты реакции (теплоты) могут спровоцировать автоколебательный режим реакций. Для этого будет нужна реализация в системе обратной связи. Это, в свою очередь, характеризуется ускорением реакции под воздействием или продукта, или теплоты, выделяющейся при реакции.
Что касается открытой химической системы, то в ней (с наличием положительной обратной связи) возникают саморегулирующиеся непрекращающиеся химические реакции. Внешне самоорганизация проявляется с возникновением концентрических волн в жидкой среде. Это особенно заметно в автоколебательных реакциях, открытых Б. Белоусовым.
На основании проводимых Р. Пригожиным экспериментов с периодическими реакциями, ему удалось построить брюсселятор (теоретическую модель, положенную впоследствии в основу нелинейной или неравновесной термодинамики).
Рисунок 2. Энтропия в открытых системах. Автор24 — интернет-биржа студенческих работ
Нелинейность в термодинамике означает задействование в ней нелинейных математических уравнений, где содержатся переменные во второй или выше степени. Открытие самоорганизации системы в условиях простейшей неорганической природы играет существенную роль в научном и мировоззренческом понимании. Это демонстрирует вероятность осуществления процессов в основе материи и рассматривает взаимосвязь органической и неорганической природы.
С позиции самоорганизации весь окружающий мир и Вселенная будут представлять собой комплекс разносторонних и самоорганизующихся процессов, выступающих основанием для любой эволюции.
Энтропия открытых систем в термодинамических процессах
При неравновесном состоянии энтропия открытых систем определяется суммой значений энтропий отдельных малых элементов в системе. Эти элементы пребывают в состоянии локального равновесия (следствие аддитивности энтропии).
Потоки энергии и вещества в системе провоцируются процессом отклонений параметров термодинамики от их равновесных значений. Повышение энтропии системы становится возможным за счет процессов переноса. Энтропия в рамках замкнутых систем будет расти и при этом стремиться к своему максимуму и равновесному значению.
В открытой системе допускается вероятность стационарных состояний с постоянной энтропией (при условии ее постоянного производства). При этом энтропия должна быть отведена от системы. В термодинамике открытых систем стационарному состоянию отводится роль, аналогичная термодинамическому равновесию (термодинамика равновесных процессов в отношении изолированных систем).
Фундаментальные уравнения термодинамики. Преобразования Лежандра.
Глава 4. фундаментальные уравнения термодинамики. характеристические функции.
Фундаментальные уравнения термодинамики. Преобразования Лежандра.
Термодинамика как наука о наиболее общих свойствах макроскопических систем, находящихся в состоянии термодинамического равновесия, и о процессах перехода между этими состояниями построена просто – опытным путем установлены два ее основных закона, а применение к ним математического аппарата позволяет получить очень важные термодинамические соотношения.
Основой математического аппарата термодинамики является объединенное уравнение первого и второго законов термодинамики илифундаментальное уравнение Гиббса, которое для обратимых процессов записывается в виде

где все параметры относятся к системе; PdV – механическая работа расширения системы; δW* – полезная работа системы (сумма немеханических видов работы, см. раздел 2.3)
Для простых систем в случае обратимых процессов фундаментальное уравнение записывается в виде
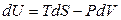
В математике независимыми переменными считаются те, которые стоят под знаком дифференциала. В фундаментальном уравнении (4.1) независимыми переменными являются S, V и все yk. Однако эти независимые параметры неудобны, так как энтропия непосредственно не измеряется, а объем легко определяется только для газов. Поэтому возникает задача перехода к новым независимым переменным.
Преобразование, меняющее ролями зависимые и независимые переменные, носит название преобразования Лежандра.
Рассмотрим функцию нескольких переменных:
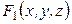
Полный дифференциал этой функции равен
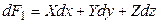
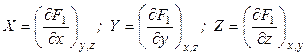
Введем новую функцию
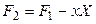
Полный дифференциал этой функции будет равен
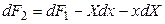
Подставив в равенство (4.5) значение dF1 из (4.3), получим:
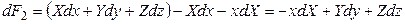
Cледовательно, в результате преобразования осуществлен переход от независимых переменных x, y, z к независимым переменным X, y, z, то есть переменная х стала зависимой, а Х – независимой. Кроме того, получили новую функцию F2. Таким образом, чтобы поменять зависимую переменную на независимую, следует воспользоваться соотношением
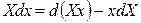
Впервые преобразование Лежандра к термодинамическим функциям применил Ф. Масье в 1869 году. Фундаментальное уравнение темодинамики для простых систем как для обратимых, так и для необратимых процессов запишется в виде:
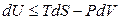
Знак неравенства используется для необратимых процессов, а знак равенства – для обратимых процессов. Применив к произведению PdV соотношение (4.7)
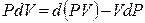
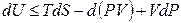
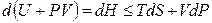
В результате перешли к независимым переменным S и Р и получили под знаком дифференциала в левой части (4.10) новую функцию
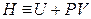
которая называется энтальпией.
Воспользовавшись подстановкой Лежандра для произведения TdS
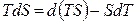
и подставив ее в фундаментальное уравнение (4.8), получим:
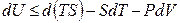
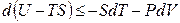
Стоящую под знаком полного дифференциала функцию U – TS обозначают по рекомендациям IUPAC символом Аи называютэнергией Гельмгольца(в некоторых учебниках энергию Гельмгольца до настоящего времени обозначают символом F):
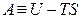
Итак, соотношение (4.14) записывается следующим образом:
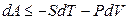
то есть в результате преобразований введена новая функция состояния при независимых переменных Т и V.
Преобразовав по Лежандру сразу оба произведения TdS и PdV в уравнении (4.8), получим:

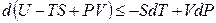
Функция U – TS + PV обозначается символом Gи называется энергией Гиббса. Следовательно, соотношение (4.18) запишется в виде:
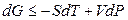
и энергия Гиббса является функцией независимых переменных Т и Р.
Дата добавления: 2015-08-20 ; просмотров: 3138 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Объединенное уравнение первого и второго начала термодинамики для физических и химических процессов
Объединенное уравнение первого и второго начала термодинамики, для равновесного обратимого процесса может быть выражено:
TdS = dU + pdV (4 – 1)
Отсюда следует, что
dU = TdS – pdV (4 – 1)
Введя новые функции состояния
U ≡ U + pV , G ≡ H – TS , F ≡ U — TS
можно получить четыре эквивалентные формы записи:

dF = — pdV – SdT (4 — 2)
Все выражения (4 – 2) справедливы лишь для закрытых систем, в которых не совершаются другие виды работ за исключением механической работы. В этом случае, как уже отмечалось
U = U ( S , V ) H = H ( S , P ) G = G ( P , T ) F = ( V , T ) являются термодинамическими потенциалами и определяют направления самопроизвольного протекания процесса. Но, совершенно очевидно, что эти процессы связаны либо с выделением энергии в форме теплоты, либо с совершением механической работы. Никакие другие процессы здесь не рассматриваются.
Если в системе протекает химическая реакция, она становится аналогом открытой системы, поэтому возникает необходимость учитывать обмен энергией и массой с окружающей средой. Поэтому термодинамические потенциалы будут функцией всех веществ участвующих в реакции и систему уравнений (4 – 2) следует записать:

Все производные по количеству вещества равны между собой и характеризуют приращение соответствующего термодинамического потенциала при измерении данного вещества при фиксированных естественных переменных и неизменных количествах остальных веществ: (4 — 4)
µ i = ( 



Эта новая функция, введенная Гиббсом, получила название химического потенциала. Химический потенциал фактически является движущей силой при массопереносе. Система самопроизвольно переходит в состояние с более низшим потенциалом. Более нагретое тело, с большей температурой, нагревает менее нагретое тело, с меньшей температурой, т.е. температура – потенциал при теплопередачи, т.е. температура выступает здесь движущей силой. Работа расширения совершается аналогично за счет уменьшения давления: давление потенциал в случае механической работы. Все потенциалы, как известно интенсивные переменные, т.е. не зависящие от массы. Любой самопроизвольный процесс – это процесс приводящий к выравниванию потенциалы в результате чего достигается равновесие.
Очевидно, что если в системе совершаются другие виды работ, связанные с переносом массы, то учет ∑μ idni не достаточен.
Уравнения (4 -3) справедливы лишь в том случае, если химическая реакция протекает в гомогенной системе и системе не совершает других видов работ, кроме механической. Очевидно в этом случае:


dH = 
dG = 
dF = 
Для гетерогенной системы эти уравнения должны быть записаны для каждой фазы в отдельности. При этом, равновесие в гетерогенной системе наступает лишь тогда, когда химические потенциалы всех компонентов во всех фазах выравниваются.
Среди рассмотренных термодинамических потенциалов в конкретных термодинамических расчетах наибольшее значение имеют энергия Гельмгольца F и энергия Гиббса G . Их естественные переменные наиболее удобны, поскольку легко реализуемы. Изменение этих функций в каком – либо процессе при постоянстве естественных переменных равно максимальной работе, которая система может совершить в этом процессе при проведении процесса обратимо. Изменение этих термодинамических потенциалов можно найти из термодинамических констант, поэтому они позволяют определить возможность самопроизвольного процесса и глубину его протекания:
∆ GT = ∆ HT — T ∆ ST (4 – 6)
∆ FT = ∆ HT — T ∆ ST (4 – 7)
Если условия протекания процесса не сильно отличаются от стандартных, то в расчете можно использовать термические константы, отнесенные к стандартным условиям. В этом случае расчет ∆ rG ° T может быть осуществлен:
где ∆ rH º T и ∆ rS º T рассчитываются на основе стандартных энтальпий образования и абсолютных энтропий с пересчетом к температуре T .
Изменения энергии Гиббса может быть рассчитано аналогично тепловому эффекту реакции с использованием энергий Гиббса образования:
∆ rG ° T = ∑ υi ∆ fG ° T — ∑ υj ∆ fG ° T (4 – 8)
Рассмотрим равновесия типа:






Равновесие, как известно, характеризуется равенством энергий Гиббса для индивидуального вещества.
Исходя из (4 – 2) для жидкой и паровой фаз мы можем записать:

dG пар = V пар d р — S пар dT (4 – 9)
Если энергии Гиббса отнесены к 1 молю, то условие равновесия может быть записано:
Отсюда следует, что
Из системы (4 – 9) получаем:
V ж dp – S ж dT = V п dp – S п dt
Отсюда следует, что

Уравнение (4 – 10) – это уравнение Клаузиуса – Клайперона, которое показывает, как изменяется давление с ростом температуры при изменении агрегатного состояния вещества.
Уравнение (4 – 10) применимо к любому фазовому переходу I рода. Оно может быть преобразовано с учетом того, что
∆ G ф.п. = ∆ H ф.п . — Т∆ S ф.п. = 0
Для процессов испарений и сублимации V тв/ж ›› V п. Считая, что пар подчиняется закону идеальных газов: V п = RT / P . Уравнение (4 – 10) можно преобразовать:

Уравнения (4 – 10) и (4 – 10 ′ ) позволяют определить энтальпию фазового перехода по температурной зависимости давления паров. В случае плавления требуются дополнительные сведения о больших объемах жидкой и твердой фаз.
Рассмотрим несколько примеров таких расчетов.
Приняв энтальпию плавления льда при 273,15 К равный 333,5 Дж∙2ˉ¹, а удельные объемы жидкой воды и льда равными 1,0002 см³∙2ˉ¹ и 1,0908 см³∙2ˉ¹ соответственно, рассчитать на сколько нужно повысить давление, чтобы температура плавления льда уменьшилась на 1 К.
Из уравнения (4 – 10) следует
Знак «-» указывает, что температура плавления льда уменьшается с ростом давления.
При давлении 1 атм. Бензол кипит при 80,1º С. Какое давление паров бензола при стандартной термодинамической температуре?
На основании уравнения (4 — 10′) получаем

В условии задачи отсутствует ∆Н исп . Её можно найти через энтальпии образования, предположив, что энтальпия испарения слабо зависит от температуры.


Следовательно, ∆ бар Нº(298, С6Н6) = 33,91 кДж∙мольˉ¹
Возможна и другая оценка энтальпии испарения. Для неполярных жидкостей выполняется правило Трутона, согласно которому мольная энтальпия испарения в точке НТК (нормальной температуры кипения) примерно равна 88 Дж∙мольˉ¹ Кˉ¹.
Оценивая для бензола ∆Н исп., получаем ∆Н исп. = 88∙353,3 = 31100 Дж∙мольˉ¹. В этом случае получаем р=0,141 атм.
Какое давление паров бензола при стандартной термодинамической температуре, если стандартные энергии Гиббса образования жидкого и газообразного бензола равны +124,43 кДж∙мольˉ¹ и +129,75 кДж∙мольˉ¹ соответственно.
Если Т = const = 298,15 то
Принимая ∆ V = V пар = получаем, после интегрирования
При каком давлении алмаз и графит находятся в равновесии друг с другом при температуре 298,15 К, если плотность графита и алмаза 2,25 и 3,51 г∙смˉ³ соответственно, а 

∆ fG =2,900 кДж∙мольˉ¹
Поскольку 
По условию равновесие соответствует ∆G2 = 0, следовательно
P 2 – P 1 = ∆G2 —
∆ G 1= — ∆ fG º. Если принять, что стандартные условия отнесены к Р1 = 1 атм. = 101325,1 Па,
то 
При 70ºС давление насыщенных паров CCl 4 621,15 мм рт. ст, а при 80ºС 843,29 мм рт. ст. Чему равна энтальпия испарения СС l .
Из уравнения Клаузиуса – Клайперона



http://helpiks.org/4-93290.html
http://www.trotted.narod.ru/physchem/lec-4.htm


















