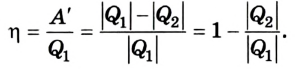
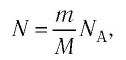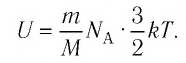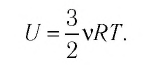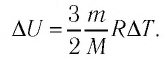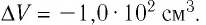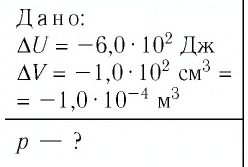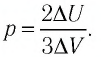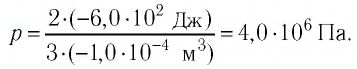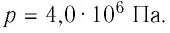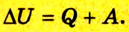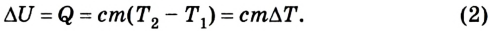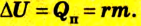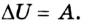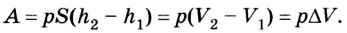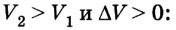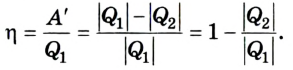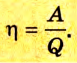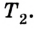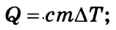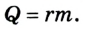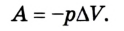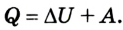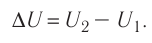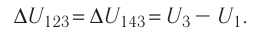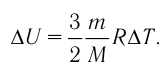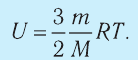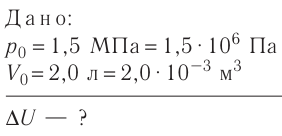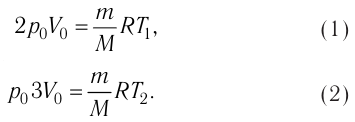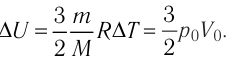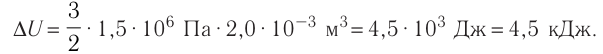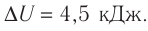Фундаментальные уравнения термодинамики. Преобразования Лежандра.
Глава 4. фундаментальные уравнения термодинамики. характеристические функции.
Фундаментальные уравнения термодинамики. Преобразования Лежандра.
Термодинамика как наука о наиболее общих свойствах макроскопических систем, находящихся в состоянии термодинамического равновесия, и о процессах перехода между этими состояниями построена просто – опытным путем установлены два ее основных закона, а применение к ним математического аппарата позволяет получить очень важные термодинамические соотношения.
Основой математического аппарата термодинамики является объединенное уравнение первого и второго законов термодинамики илифундаментальное уравнение Гиббса, которое для обратимых процессов записывается в виде

где все параметры относятся к системе; PdV – механическая работа расширения системы; δW* – полезная работа системы (сумма немеханических видов работы, см. раздел 2.3)
Для простых систем в случае обратимых процессов фундаментальное уравнение записывается в виде
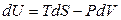
В математике независимыми переменными считаются те, которые стоят под знаком дифференциала. В фундаментальном уравнении (4.1) независимыми переменными являются S, V и все yk. Однако эти независимые параметры неудобны, так как энтропия непосредственно не измеряется, а объем легко определяется только для газов. Поэтому возникает задача перехода к новым независимым переменным.
Преобразование, меняющее ролями зависимые и независимые переменные, носит название преобразования Лежандра.
Рассмотрим функцию нескольких переменных:
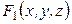
Полный дифференциал этой функции равен
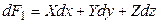
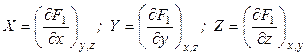
Введем новую функцию
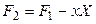
Полный дифференциал этой функции будет равен
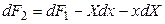
Подставив в равенство (4.5) значение dF1 из (4.3), получим:
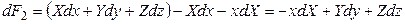
Cледовательно, в результате преобразования осуществлен переход от независимых переменных x, y, z к независимым переменным X, y, z, то есть переменная х стала зависимой, а Х – независимой. Кроме того, получили новую функцию F2. Таким образом, чтобы поменять зависимую переменную на независимую, следует воспользоваться соотношением
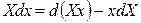
Впервые преобразование Лежандра к термодинамическим функциям применил Ф. Масье в 1869 году. Фундаментальное уравнение темодинамики для простых систем как для обратимых, так и для необратимых процессов запишется в виде:
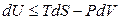
Знак неравенства используется для необратимых процессов, а знак равенства – для обратимых процессов. Применив к произведению PdV соотношение (4.7)
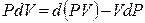
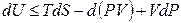
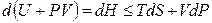
В результате перешли к независимым переменным S и Р и получили под знаком дифференциала в левой части (4.10) новую функцию
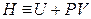
которая называется энтальпией.
Воспользовавшись подстановкой Лежандра для произведения TdS
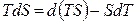
и подставив ее в фундаментальное уравнение (4.8), получим:
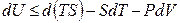
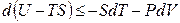
Стоящую под знаком полного дифференциала функцию U – TS обозначают по рекомендациям IUPAC символом Аи называютэнергией Гельмгольца(в некоторых учебниках энергию Гельмгольца до настоящего времени обозначают символом F):
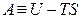
Итак, соотношение (4.14) записывается следующим образом:
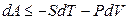
то есть в результате преобразований введена новая функция состояния при независимых переменных Т и V.
Преобразовав по Лежандру сразу оба произведения TdS и PdV в уравнении (4.8), получим:

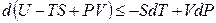
Функция U – TS + PV обозначается символом Gи называется энергией Гиббса. Следовательно, соотношение (4.18) запишется в виде:
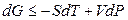
и энергия Гиббса является функцией независимых переменных Т и Р.
Дата добавления: 2015-08-20 ; просмотров: 3136 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
«Термодинамика химического равновесия Лекция 3 Фундаментальные уравнения для закрытых систем (дифференциалы термодинамических . »
Фундаментальные уравнения для
закрытых систем (дифференциалы
• Для закрытой системы постоянного состава, в которой может
совершаться только работа расширения:
• Q = dU + pdV; Q = TdS; TdS = dU + pdV; dU = TdS – pdV
• Это уравнение называют фундаментальным уравнением для
закрытой системы постоянного состава, которая может
совершать только работу расширения.
• Частные производные внутренней энергии:
а) V=const; dV=0; dU=TdS; (U/S)V=T
б) S=const; dS=0; dU=-pdV; (U/V)S= -p
• Полный дифференциал функции U:
dU = (U/S)V·dS + (U/V)S·dV
• Таким образом, внутренняя энергия U является функцией двух переменных – энтропии (S) и объёма (V): U=f(S, V) Энтальпия H = U + pV; dH = dU + pdV + Vdp;
dH = TdS – pdV + pdV + Vdp = TdS + Vdp dH = TdS + Vdp
Частные производные энтальпии:
а) p=const; dp=0; dH=TdS; (H/S)p=T •
б) S=const; dS=0; dH= Vdp; (H/p)S= V •
Полный дифференциал функции H:
• dH = (H/S)p·dS + (H/p)S·dp Энтальпия H является функцией двух • переменных – энтропии (S) и давления (p):
H=f(S, p) Энергия Гельмгольца
• Для нахождения полного дифференциала функции F продифференцируем уравнение F = U – TS:
dF = dU – TdS – SdT (1)
• Q = dU + pdV, Q = TdS; TdS = dU + pdV, dU = TdS – pdV (2)
• После подстановки уравнения (2) в уравнение (1) получим:
• dF = TdS – pdV – TdS – SdT = – SdT – pdV, dF = – SdT – pdV (3)
• Из уравнения (3) находим частные производные (F/T)V = -S; (F/V)T = -p, dF = (F/V)T·dV + (F/T)V·dT
• Энергия Гельмгольца F является функцией двух переменных – объёма (V) и температуры (T): F=f(V, T) Энергия Гиббса
•Для нахождения полного дифференциала функции G продифференцируем уравнение G = H – TS:
dG = dH – TdS – SdT (1) H = U + pV; dH = dU + pdV + Vdp (2)
•После подстановки уравнения (2) в уравнение (1) получим:
dG = dU + pdV + Vdp – TdS – SdT (3)
•Из объединенного уравнения 1-го и 2-го законов термодинамики имеем: dU = TdS – pdV (4)
•После подстановки уравнения (4) в уравнение (3) получим:
dG = TdS – pdV + pdV + Vdp – TdS – SdT, dG = Vdp – SdT (5)
•Из уравнения (5) находим частные производные (G/p)T = V; (G/T)p = — S dG = (G/p)T·dp + (G/T)p·dT
•Энергия Гиббса G является функцией двух переменных – давления (p) и температуры (T): G=f(p, T)
• Следует отметить, что все вышеприведенные соотношения справедливы только для закрытых систем постоянной массы и состава.
Они применимы, например, для процессов фазовых превращений (испарение, плавление, кристаллизация и т.д).
• Для открытых же систем, в которых масса и состав могут изменяться за счёт выведения или добавления вещества, или за счёт протекания химической реакции, внутренняя энергия U, энтальпия H, энергия Гельмгольца F и энергия Гиббса G являются также функцией количества образующих данную систему индивидуальных компонентов.
Уравнения Гиббса-Гельмгольца Уравнения Гиббса-Гельмгольца – это термодинамические соотношения, устанавливающие связь между внутренней энергией (U) и энергией Гельмгольца (F), или между энтальпией (H) и энергией Гиббса (G):
F = U + T(F/T)V (1) G = H + T(G/T)p (2) Эти уравнения выражают зависимость F и G от температуры для индивидуального вещества.
Уравнение (1) следует из определения энергии Гельмгольца (F = U – TS) и выражения для энтропии S = -(F/T)V Уравнение (2) – из определения энергии Гиббса (G = H – TS) и выражения для энтропии S = -(G/T)p
• Если система переходит из состояния 1 «реагенты»
в состояние 2 «продукты», то эти уравнения можно записать для изменений соответствующих потенциалов в результате протекания химической реакции:
F = U + T(F/T)V (3) = H + T(G/T)p (4) G
• Эти уравнения также известны под названием «уравнения Гиббса-Гельмгольца» для процессов.
Они позволяют получить зависимость F и G от T.
Преобразуем уравнение (4) в более явную и удобную форму. Сделаем перегруппировку и разделим обе части на T2 [(G/T)p]/T — G/T2 = — H/T2 [(G/T)/dT]p = -H/T2 • 1) H 0, [(G/T)/ T]p 0, значит с увеличением T растёт (G/T). Поскольку T всегда 0, то G 0, то есть, с увеличением T G увеличивается (G становится менее отрицательной величиной – более положительной).
• 2) H 0, [(G/T)/ T]p 0, значит с увеличением T снижается (G/T). Поскольку T всегда 0, то G 0, то есть, с увеличением T G уменьшается (G становится менее положительной – более отрицательной величиной).
Фундаментальные уравнения для открытых систем.
Понятие о химическом потенциале До сих пор мы рассматривали случаи, в которых изменение энергии системы было следствием сообщения или отнятия теплоты или результатом совершения работы. В открытых же системах масса и состав могут изменяться.
Ясно, что появление в открытой системе некоторого количества вещества или удаление его из системы должно сказаться на запасе энергии системы. Поэтому энергия Гиббса, энергия Гельмгольца, энтальпия и внутренняя энергия являются также функцией количества образующих данную систему индивидуальных компонентов.
• Рассмотрим это на примере энергии Гиббса:
G = f(p, T, n1, n2, … nk), где n1, n2, … nk – это число молей 1, 2, … k-го компонента.
• Поэтому полный дифференциал энергии Гиббса dG будет складываться не только из изменения энергии Гиббса в результате изменения давления и температуры (на dp и dT, соответственно), но и изменения энергии Гиббса в результате изменения числа молей каждого компонента (1-го на dn1, 2-го на dn2, kго на dnk).
• dG = (G/p)T,n1,n2,…nk·dp + (G/T)p,n1,n2,…nk·dT + (G/n1)T,p,n2,…nk·dn1 + (G/n2)T,p,n1,n3,…nk·dn2 + (G/nk)T,p,n1,n2,…n(k-1)·dnk, либо
• dG = (G/p)T,n1,n2,…nk·dp + (G/T)p,n1,n2,…nk·dT + (G/ni)T,p,ji·dni (1) (индекс j i – постоянное количество всех dni компонентов, кроме ni) Обозначим частную производную энергии Гиббса по количеству i-го вещества при постоянных давлении, температуре и количествах всех остальных веществ (G/ni)T,p,ji = i и назовем химическим потенциалом i-го компонента в системе данного состава
• С учётом того, что (G/p)T = V, (G/T)p = -S, уравнение (1) принимает вид dG = -SdT + Vdp + idni
• Полные дифференциалы для остальных термодинамических потенциалов имеют следующий вид:
dF = -SdT – pdV + idni dU = TdS – pdV + idni dH = TdS + Vdp + idni
Таким образом, из приведенных выше уравнений следует:
i = (U/ni)S,V,nj = (H/ni)S,p,nj = (F/ni)T,V,nj = (G/ni)T,p,nj Таким образом, химический потенциал можно определить как изменение любого вида энергии, сопровождающее изменение количества вещества в системе.
•Химический i-го многокомпонентной системы равен частной производной от любого из термодинамических потенциалов по количеству этого компонента при постоянных значениях остальных термодинамических переменных, определяющих данный термодинамический потенциал.
важным является выражение,
•Особенно связывающее химический потенциал с энергией
Гиббса:
• Величина i представляет собой бесконечно малое изменение энергии Гиббса, которое происходит в результате изменения количества молей данного iго компонента на бесконечно малую величину dni при постоянных давлении, температуре и числах молей всех других компонентов, кроме i-го. Но, поскольку dni бесконечно мало, а числа молей всех других компонентов, кроме i-го, не меняются, то можно считать, что i-ый компонент добавляется в систему при постоянном составе системы. Часто химический потенциал i относят к 1 молю добавляемого компонента, отсюда можно сформулировать физический смысл химического потенциала.
Физический смысл химического потенциала
• Это изменение энергии Гиббса однородной многокомпонентной системы при добавлении к ней 1 моль данного компонента при постоянных давлении, температуре и составе системы (то есть, добавление должно происходить при бесконечно больших количествах всех компонентов, чтобы состав системы не изменился).
• Химический потенциал относится к числу вычисляемых, но не измеряемых на опыте параметров.
• Химический потенциал характеризует способность рассматриваемого компонента к выходу из данной фазы (путём испарения, растворения, кристаллизации и т.д.) или к выходу из данного состояния при химическом взаимодействим. В многофазных (гетерогенных) системах переход данного компонента может происходить самопроизвольно только из фазы, где его химический потенциал больше, в фазу, в которой его химический потенциал меньше.
Такой переход сопровождается уменьшением химического потенциала этого компонента в 1-й фазе и увеличением во 2-й.
В результате, разность между химическими потенциалами данного компонента в этих двух фазах уменьшается и при достижении равновесия химический потенциал компонента становится одинаковым в обеих фазах.
В любой равновесной гетерогенной системе химический потенциал каждого компонента одинаков во всех фазах.
Понятие химического потенциала имеет некоторую аналогию с понятием температуры. Как в состоянии теплового равновесия система должна иметь одинаковую температуру, так и при постоянных давлении и температуре в состоянии равновесия химические потенциалы каждого компонента должны быть одинаковыми по всей системе, в любой из имеющихся фаз.
Таким образом, в неравновесных системах любой компонент будет стремиться из состояния с более высоким химическим потенциалом в состояние с более низким потенциалом до тех пор, пока не установится равновесие.
Рассмотрим процесс таяния льда или кристаллизации воды В гетерогенной системе вода-лед при температуре выше 0°С химический потенциал воды ниже, чем химический потенциал льда. В результате, молекулы воды переходят из твёрдой фазы в жидкую – лёд тает.
Наоборот, при температуре ниже 0°С химический потенциал льда ниже, чем химический потенциал воды. При этом молекулы воды переходят из жидкой фазы в твёрдую – происходит процесс кристаллизации.
Рассмотрим диссоциацию слабой кислоты.
HA + Н2О Н3О+ + AВ процессе диссоциации концентрация недиссоциированных молекул снижается, а концентрации ионов растут. Поэтому химический потенциал НА снижается, а сумма химических потенциалов Н+ и А- растёт. Когда сумма химических потенциалов продуктов станет равной сумме химических потенциалов реагентов система достигнет состояния равновесия.
Таким образом, разность величин определяет направление химических реакций, фазовых превращений, диффузии веществ из одной фазы в другую.
Химическое равновесие. Принцип минимума свободной энергии. Закон действующих масс.
Константа химического равновесия и способы её выражения. Кинетический и термодинамический выводы выражения для константы равновесия.
Термодинамическим равновесием называется такое термодинамическое состояние системы, которое при постоянстве внешних условий не изменяется во времени, причём, эта неизменяемость не обусловлена каким-либо внешним процессом.
Принцип минимума свободной энергии:
«самопроизвольно могут протекать только те процессы, которые приводят к понижению свободной энергии системы; система приходит в состояние равновесия, когда свободная энергия достигает минимального значения»
• Протекание самопроизвольного процесса в системе сопровождается уменьшением свободной энергии системы (dG 0; dF 0).
• Очевидно, что рано или поздно система достигнет минимума свободной энергии.
Таким образом, минимальное значение энергии Гиббса или энергии Гельмгольца является условием термодинамического равновесия в закрытой системе:
T и p = const: G = 0; dG = 0 V и T = const: F = 0; dF = 0
• Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации Ci или парциальное давление Pi реагирующих веществ.
• Для некоторой реакции:
• Соответствующие константы равновесия выражаются следующим образом:
KC = (CcC · CdD) / (CaA · CbB) (1), KP = (PcC · PdD) / (PaA · PbB) (2).
• Закон действующих масс (закон ГульдбергаВааге):
• «В состоянии равновесия отношение произведения равновесных концентраций (парциальных давлений) продуктов реакции к произведению равновесных концентраций (парциальных давлений) исходных веществ есть величина постоянная при данной температуре»
Кинетический вывод закона действующих масс Экспериментально установлено, что во многих случаях скорость химической реакции прямо пропорциональна концентрации реагирующих веществ. Если между веществами А и В происходит обратимая реакция и при этом образуются вещества C и D.
aA + bB cC + dD, то скорость прямой реакции можно определить из следующего соотношения:
vпр = k1·CaA·CbB (1), где k1 – константа скорости реакции; CaA и CbB – концентрации веществ А и В в степенях, равных стехиометрическим коэффициентам в уравнении реакции, в данный момент времени.
По мере развития химической реакции концентрации веществ А и В уменьшаются, а веществ C и D – увеличиваются.
При этом скорость обратной реакции возрастает и определяется по уравнению vобр = k2·CcС·CdD (2), где k2 – константа скорости обратной реакции; CcC и CdD – концентрации веществ C и D в степенях, равных стехиометрическим коэффициентам в уравнении реакции, в данный момент времени.
До наступления равновесия суммарная скорость реакции равна разности скоростей прямой и обратной реакций.
Равновесие наступает в тот момент, когда k1·CaA·CbB = k2·CcС·CdD (3) или k1/k2 = (CcC · CdD) / (CaA · CbB) = KC (4), где KC – константа равновесия реакции, зависящая от природы веществ и температуры и не зависящая от концентрации реагирующих веществ.
Концентрации газообразных веществ можно заменить соответствующими парциальными давлениями, при этом константа равновесия обозначается Kp:
Kp = (PcC · PdD) / (PaA · PbB) (5) Константы KC и Kp для одной и той же реакции численно не равны, между ними существует следующая зависимость:
Kp = KC·(RT)n (6) или KС = Kp·(RT) -n, (7) где n – приращение числа молей газообразных веществ.
Термодинамический вывод выражения для константы химического равновесия dG = Vdp – SdT + i·dni (1) Из уравнения (1) следует, что при p = const (dp = 0) и T = const (dT = 0) dG = i·dni (2) и, следовательно, G = ni·i (3) Уравнение (3) утверждает, что общая свободная энергия системы представляет собой сумму числа молей каждого компонента, умноженных на свободную энергию моля компонента (т.е. химический потенциал) при указанной концентрации.
Легко можно установить зависимость i от концентрации iго компонента:
i = 0i + RTlnCi (4), где Ci – молярная концентрация i-го компонента, 0i соответствует химическому потенциалу растворенного вещества, который должен был бы наблюдаться в растворах с единичной концентрацией i-го компонента.
Рассмотрим равновесную обратимую химическую реакцию aA + bB cC + dD Можно утверждать, что в состоянии равновесия (p и T = const) суммарная энергия Гиббса продуктов реакции равна суммарной энергии Гиббса реагентов, поскольку в противном случае равновесие сдвигается в ту или иную сторону:
GA + GB = GC + GD (5) Подставляя уравнение (3) в уравнение (5) находим, что aA + bB = cC + dD (6) а после подстановки уравнения (4) в уравнение (6) получаем a[0A + RTlnCA] + b[0B + RTlnCB] = c[0C + RTlnCC] + d[0D + RTlnCD], или с0C + d0D — a0A — b0B = RT[-clnCC – dlnCD + alnCA + blnCB] (G0C + G0D) – (G0A + G0B) = — RT[lnCcC + lnCdD – lnCaA – lnCbB] G0продукты – G0реагенты = G0r = = -RTln[(CcC · CdD)/(CaA·CbB)] (7) Основной смысл уравнения (7) состоит в том, что поскольку левая часть уравнения постоянна(то есть, не зависит от концентрации), то и правая часть должна также не зависеть от общих концентраций всех веществ, участвующих в реакции.
Следовательно, для обозначения выражения в скобках в уравнении (7) можно ввести новую величину – константу равновесия:
Kравн = (CcC · CdD)/(CaA·CbB), (p и T = const) G0r = -RTlnKравн Уравнение изотермы химической реакции Это уравнение легко получить используя следующее соотношение:
• При постоянной температуре (SdT = 0):
• Для одного моля идеального газа V = RT / P и, следовательно, dG = RT dP / P = RT d (lnP) (3) •
• Интегрируя, получаем G2 = G1 + RTln (P2 / P1) (4) • Это уравнение позволяет, зная молярную энергию Гиббса идеального газа G1 при парциальном давлении P1, вычислить молярную энергию Гиббса G2 при парциальном давлении P2. Допустив, что состояние 1 является стандартным, а состояние 2 произвольным, уравнение (4) можно записать в виде:
Gi = G0i + RTln ai, (5) где G0i – стандартный изобарно-изотермический потенциал вещества i; ai– C/C0 – его активная концентрация (активность).
В соответствии с (5) энергия Гиббса произвольной химической реакции aА + bВ = lL + mМ равна:
При достижении равновесия (G = 0) уравнение (6)принимает вид
где – равновесные значения активных концентраций.
Выражение под знаком логарифма, представляющее собой отношение произведения равновесных активностей продуктов к произведению активностей исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия:
(8) Подставив (8) в (6), получим уравнение, носящее название изотермы Вант-Гоффа:
(9) При определенных условиях активности реагентов могут быть заменены концентрациями (Kc) или парциальными давлениями ( Kp). Для газообразных веществ Kp и Kc связаны соотношением Kp = Kc (RT)n, где n – разность числа молей начальных и конечных газообразных реагентов.
Анализ уравнения изотермы
1) ln[(CeE · CdD)/(CaA·CbB)] lnK.
Следовательно, G0. В системе термодинамически возможно самопроизвольное протекание прямой реакции при указанных выше условиях.
2) ln[(CeE · CdD)/(CaA·CbB)] lnK.
Следовательно, G0. В этом случае в системе термодинамически возможно самопроизвольное протекание обратной реакции при указанных выше условиях.
3) ln[(CeE · CdD)/(CaA·CbB)] = lnK.
Следовательно, G=0. Данная система будет находиться в состоянии химического равновесия.
Из анализа уравнения изотермы химической реакции видно, что меняя начальные концентрации давления) (парциальные веществ, в принципе, можно менять и направление протекания реакции.
Уравнения изобары и изохоры химической реакции Уравнения изобары и изохоры химической реакции определяют зависимость константы равновесия от температуры при p=const или V=const, соответственно.
Запишем уравнение Гиббса-Гельмгольца G = H + T (G/T)p и уравнение изотермы химической реакции G = RTln([C]·[D]/[A]·[B]) – RTlnKх.р.
Возьмём соответствующие производные по температуре (G/T)p = Rln([C]·[D]/[A]·[B]) – RlnKх.р. – RT(lnKх.р./T)p Подставим последние два уравнения в уравнение Гиббса-Гельмгольца RTln([C]·[D]/[A]·[B]) – RTlnKх.р. = H + RTln([C]·[D]/[A]·[B]) – RTlnKх.р. – RT2(lnKх.р./T)p 0 = H — RT2(lnKх.р./T)p (lnKх.р./T)p = H/(RT2) – уравнение изобары (lnKх.р./T)V = U/(RT2) – уравнение изохоры Анализ уравнения изобары
• Рассмотрим случай, когда реакция проводится при p=1 атм. Тогда уравнение (lnKp/T)p = H/RT2 примет следующий вид:
• dlnKp/dT = H0/RT2 • 1) H0 0, следовательно, H0/RT2 0, то есть, при увеличении температуры (dT 0) величина lnKp, а следовательно, и Kp возрастает, а при уменьшении температуры Kp уменьшается.
• 2) H0 0, следовательно, dlnKp/dT 0, то есть, с ростом аргумента Т величина lnKp, а, значит, и Kp уменьшается.
• 3) H0 = 0; dlnKp/dT = 0. Функция lnKp, а также и Kp, не зависит от температуры, то есть, Kp=const при Тconst.
• Проведенный анализ является частным случаем применения принципа ЛеШателье, когда внешним, воздействующим на систему, фактором является температура (то есть, как влияет изменение температуры на смещение равновесия в случае эндо- и экзотермических реакций).
• Чтобы определить изменение константы равновесия при заданном изменении температуры, нужно проинтегрировать уравнение изобары:
• dlnKх.р. = [H/(RT2)]·dT, T2 K2
• dlnKх.р. = [H/(RT2)]·dT T1 K1
• Если полагать, что тепловой эффект реакции в данном диапазоне не зависит от температуры, то получим при H = const:
• ln(K2/K1) = (H0/R) · (1/T1 – 1/T2)








2017 www.pdf.knigi-x.ru — «Бесплатная электронная библиотека — разные матриалы»
Материалы этого сайта размещены для ознакомления, все права принадлежат их авторам.
Если Вы не согласны с тем, что Ваш материал размещён на этом сайте, пожалуйста, напишите нам, мы в течении 1-2 рабочих дней удалим его.
Термодинамика — основные понятия, формулы и определения с примерами
Содержание:
Термодинамические системы и макропараметры состояния вещества:
Термодинамический подход основывается на понятии термодинамической системы, которая представляет собой любое макроскопическое тело или совокупность таких тел. Состояние термодинамической системы определяется ее внутренними параметрами, например состоянием движения микрочастиц, из которых состоит тело. Тепловое состояние тела, которое характеризуется температурой, тесно связано со скоростью движения атомов и молекул — чем больше скорость их движения, тем выше температура тела.
Температура тела зависит от скорости движения атомов и молекул, из которых оно состоит, — чем больше скорость, тем выше температура.
Внутреннее состояние тела очень сложно определить через параметры движения микрочастиц, потому что их очень много. Поэтому, чтоб упростить описание состояния термодинамической системы, его связывают с физическими величинами, которые характеризуют тело в целом, независимо от его молекулярного строения. К таким величинам принадлежат, в частности, масса, объем, плотность, давление, температура и т. п.
Их называют макропараметрами системы. Фактически они являются усредненными значениями данных физических величин на протяжении длительного времени.
Температура — один из основных макропараметров термодинамической системы, характеризующий состояние ее теплового или термодинамического равновесия. Сущность данного понятия объясняется течением тепловых явлений и процессов.
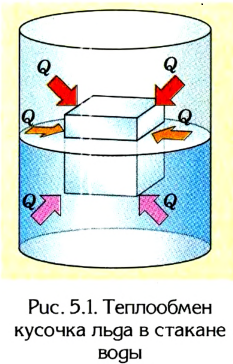
Например, из собственного опыта нам известно, что более нагретые тела отдают теплоту менее нагретым, вследствие чего со временем их температуры станут одинаковыми. Если, к примеру, кусочек льда бросить в стакан с теплой водой (рис. 5.1), то лед будет таять, а вода в стакане охлаждаться, отдавая определенное количество теплоты тающему льду. Кроме того, стакан с водой и лед пребывают в состоянии теплообмена с окружающей средой. Поэтому со временем температуры всех этих тел станут одинаковыми.
Тела с более высокой температурой отдают тепловую энергию телам с более низкой температурой; теплообмен происходит до тех пор, пока их температуры не станут одинаковыми.
Следовательно, со временем вследствие теплообмена в термодинамических системах наступает состояние термодинамического равновесия, когда температуры всех тел становятся одинаковыми и теплообмен между ними прекращается. Значение температуры характеризует вполне определенное состояние теплового равновесия термодинамической системы, в котором она пребывает в данный момент. Он может быть изменен в результате термодинамического процесса.
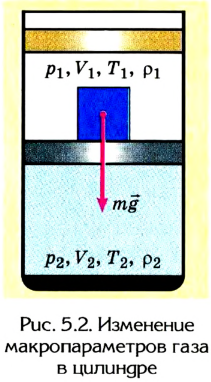
Если, например, на поршень в цилиндре с газом положить груз (рис. 5.2), то объем газа будет изменяться до тех пор, пока давление не сравняется с внешним давлением. Т. е. термодинамическая система «цилиндр — газ» перейдет в иное состояние, характеризующееся новыми значениями макропараметров — давлением 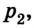
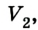
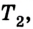
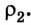
Термодинамика рассматривает в основном состояния термодинамического равновесия и процессы, которые происходят достаточно медленно, и поэтому каждое новое их состояние можно считать равновесным. В состоянии термодинамического равновесия между макропараметрами системы существуют определенные функциональные зависимости, отображаемые уравнениями состояния термодинамической системы.
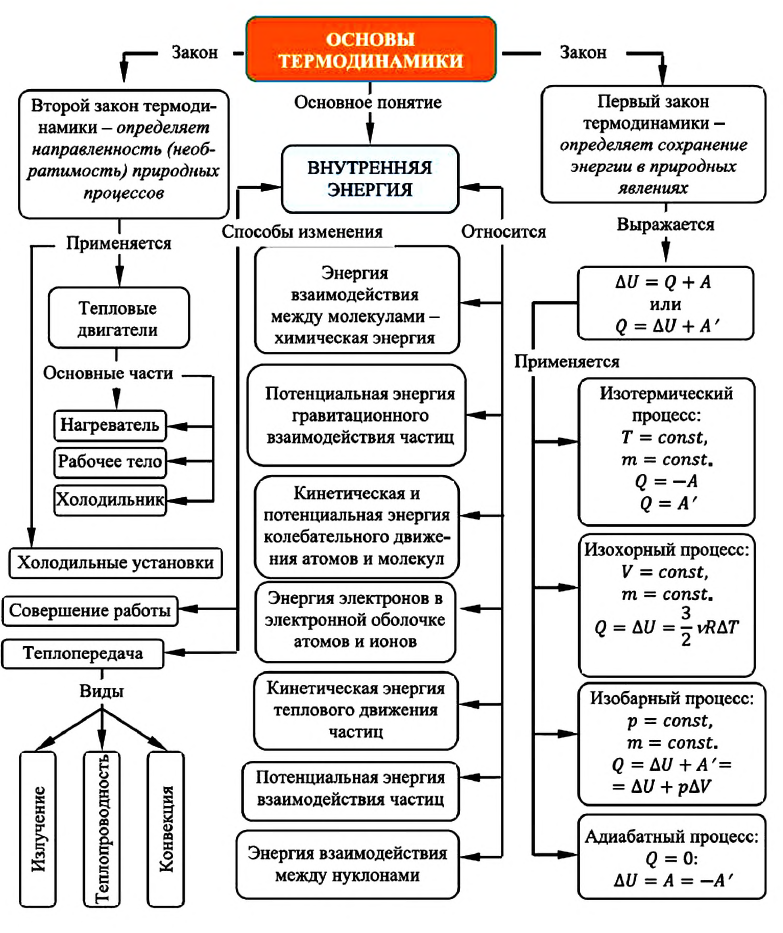
Карта основ термодинамики:
Термодинамическая система
Раздел физики, изучающий тепловые явления в макроскопических системах, называется термодинамикой. В основе термодинамики лежат термодинамические законы, опирающиеся на большое количество экспериментальных фактов. Эти законы отвечают на вопрос «как?», например, как изменяется состояние тела (твердого тела, жидкости или газа) при нагревании (или охлаждении), в каком направлении и как передается тепло, как изменяется температура газа при его расширении и другие. Объектами исследования термодинамики являются термодинамические системы.
Любое макроскопическое тело или система макроскопических тел называется термодинамической системой. Состояние термодинамической системы характеризуется макроскопическими или термодинамическими параметрами (масса, плотность, объем, давление, температура).
Внутренняя энергия
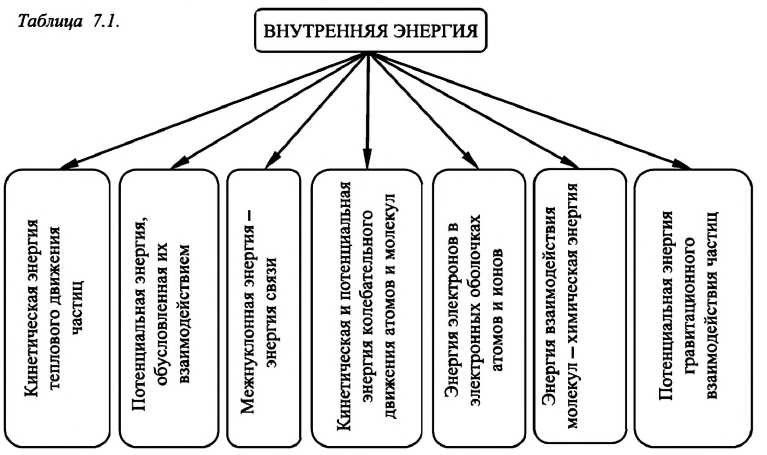
Величины, определяющие состояние термодинамической системы в данный момент времени, то есть соответствующие этому состоянию макроскопические параметры, называются функциями состояния. Основной среди этих величин является внутренняя энергия.
Внутренняя энергия — это сумма кинетических энергий различных видов, движения частиц системы и потенциальных энергий взаимодействия этих частиц (см.: таблица 7.1).
Внутренняя энергия термодинамической системы является функцией температуры и объема, определяющих состояние системы:
Внутренняя энергия одноатомного идеального газа
Газ, молекулы которого состоят из одного атома, называют одноатомным газом. Внутренняя энергия одноатомного газа равна сумме кинетических энергий поступательного движения частиц и потенциальных энергий их взаимодействия:
Однако внутренняя энергия идеального газа данной массы равна сумме средних кинетических энергий хаотического движения частиц:
Средняя кинетическая энергия одной частицы одноатомного идеального газа определяется выражением 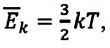
Это выражение является формулой закона Джоуля:
Внутренняя энергия идеального газа зависит от ее массы, рода (молярной массы) и температуры. Даже если давление и объем газа изменятся, при постоянной температуре его внутренняя энергия не изменится.
Сопоставив формулу (7.1) с выражением Менделеева-Клапейрона, получим:
Способы изменения внутренней энергии
Для изменения внутренней энергии термодинамической системы необходимо изменить или среднюю кинетическую энергию теплового движения молекул системы, или потенциальную энергию их взаимодействия, или же изменить обе энергии одновременно. Из многочисленных опытов было определено, что существует два способа изменения внутренней энергии: теплопередача и совершение работы.
Изменение внутренней энергии системы происходит двумя способами: передачей количества теплоты 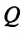
Если внутренняя энергия изменяется только в результате теплообмена, то изменение внутренней энергии равно полученному (или отданному) системой количеству теплоты. Например, при нагревании и охлаждении тела изменение его внутренней энергии определяется так:
Изменение внутренней энергии в процессе плавления твердого тела или кристаллизации жидкости происходит за счет изменения потенциальной энергии взаимодействия молекул тела. Изменение внутренней энергии при этих процессах численно равно теплоте плавления (кристаллизации):
Где 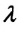
Изменение внутренней энергии тела в процессе парообразования и конденсации также равно затраченному во время этого процесса количеству теплоты:
Где 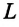
Изменение внутренней энергии одноатомного идеального газа определяется изменением его температуры:
Где 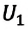
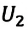
Внимание. Изменение внутренней энергии термодинамической системы зависит не от вида процесса, а от его начального и конечного состояния.
Работа в термодинамике
Если изменение внутренней энергии происходит только в результате совершения механической работы, то это изменение равно или работе внешних сил над системой 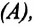
Работа в термодинамике — это одна из мер изменения внутренней энергии термодинамической системы.
Работа газа
Предположим, что в толстостенном цилиндре находится газ, сжимаемый поршнем. При сжатии поршень передает часть своей кинетической энергии молекулам газа, в результате чего увеличивается внутренняя энергия газа и повышается его температура — внешние силы совершают работу над газом. При расширении, наоборот, молекулы газа, передавая часть своей кинетической энергии поршню, уменьшают свою скорость и газ охлаждается — он совершает работу над внешними силами (b).
Таким образом, работа, совершенная газом над внешними силами, в результате расширении газа данной массы при постоянном давлении равна:
Работа же, совершенная внешними силами над газом равна :
Где 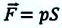
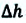
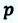
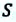

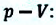
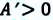
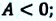
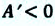
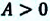
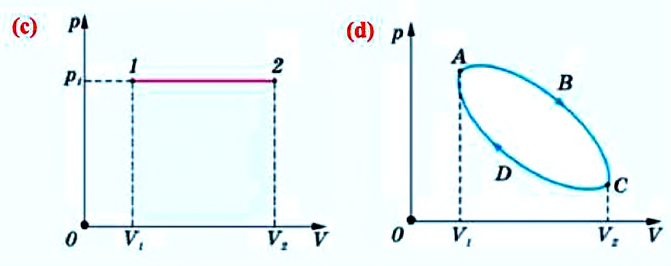
Если в процессе совершения работы газ через некоторое время возвращается в первоначальное состояние, то такой процесс называется замкнутым или циклическим процессом.
Если стрелки, показывающие направление циклического процесса, совпадают с направлением вращения часовых стрелок, то работа газа положительна, а работа внешних сил отрицательна (d). Если же стрелки, определяющие направление процесса, направлены против вращения часовых стрелок, то работа газа отрицательна, а работа внешних сил положительна.
Что такое термодинамическая система
Полную энергию физической системы можно представить как алгебраическую сумму её механической энергии и внутренних энергий тел, образующих систему. Убыль механической энергии системы в ряде случаев происходит при самопроизвольном переходе её части во внутреннюю энергию тел системы. Так, например, режущие инструменты заметно нагреваются при заточке. При скольжении конькобежца под коньками тает лёд, что обеспечивает хорошее скольжение. В этих примерах тела при трении нагреваются, и интенсивность теплового движения их молекул возрастает, что приводит к увеличению внутренней энергии тел. Как же определить внутреннюю энергию термодинамической системы? И что понимают под термодинамической системой?
В термодинамике физические тела и их модели называют термодинамическими системами. Для их описания используют параметры системы, такие, как давление, объём, температура (макропараметры), а не физические характеристики молекул (микропараметры). Макропараметры можно непосредственно измерить, используя приборы, или выразить через другие величины, которые можно измерить на опыте. Мы рассмотрим простейшие термодинамические системы, состояние которых определяют, используя только давление, объём и температуру.
Тела, образующие термодинамическую систему, могут обмениваться с окружающей средой энергией, а также веществом. Если этого не происходит, то термодинамическую систему называют замкнутой или изолированной.
Что такое внутренняя энергия
Рассматривая полную энергию макроскопического тела, необходимо учитывать не только его механическую энергию (кинетическую и потенциальную), но также и энергию, заключённую внутри самого тела, — внутреннюю энергию.
Внутренняя энергия макроскопического тела — алгебраическая сумма кинетической энергии теплового движения всех частиц, образующих тело, и потенциальной энергии их взаимодействия.
Внутренняя энергия любой термодинамической системы состоит из внутренних энергий тел, входящих в данную систему, и является одной из основных физических величин, используемых в термодинамике.
В термодинамике представляет интерес не само значение внутренней энергии системы, а её изменение. Поэтому обычно принимают во внимание только те составляющие внутренней энергии, которые изменяются в рассматриваемых процессах.
Рассмотрим переход некоторой массы идеального газа из состояния 1, в котором его внутренняя энергия 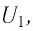
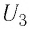
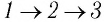
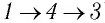
Внутренняя энергия зависит от конкретного состояния системы. Это означает, что изменение внутренней энергии при переходе термодинамической системы из одного состояния в другое зависит только от значений параметров этих состояний и не зависит от процесса перехода.
- *
— приращение физической величины, т. е. разность между её конечным и начальным значениями;
— убыль величины, т. е. разность между её начальным и конечным значениями.
Внутренняя энергия идеального одноатомного газа
Определим внутреннюю энергию идеального одноатомного газа, т. е. газа, образованного атомами. Например, одноатомными газами являются инертные газы — гелий, неон, аргон и др.
Из определения понятия «идеальный газ» следует, что его внутренняя энергия является суммой кинетических энергий хаотического движения всех атомов (или молекул) (потенциальная энергия взаимодействия между частицами отсутствует). Следовательно, внутренняя энергия идеального одноатомного газа равна произведению средней кинетической энергии 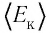
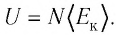
где 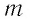
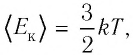
С учётом того, что произведение постоянной Больцмана и постоянной Авогадро 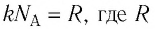
Из формулы (11.1) следует, что внутренняя энергия данной массы идеального одноатомного газа пропорциональна его абсолютной температуре. Она не зависит от других макроскопических параметров состояния — давления и объёма. Следовательно, изменение внутренней энергии данной массы одноатомного идеального газа происходит только при изменении его температуры:
При определении внутренней энергии реальных газов, жидкостей и твёрдых тел необходимо учитывать потенциальную энергию взаимодействия частиц, которая зависит от расстояния между ними. Поэтому в общем случае внутренняя энергия макроскопических тел зависит не только от абсолютной температуры, но и от объёма.
Изменить внутреннюю энергию термодинамической системы можно двумя способами: используя теплообмен и совершая работу. Процесс теплообмена и совершение работы характеризуют соответственно физическими величинами — количеством теплоты Q и работой А, которые являются мерами изменения внутренней энергии системы.
Пример решения задачи №1
При изобарном охлаждении внутренняя энергия идеального одноатомного газа изменилась на 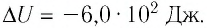
Решение. Приращение внутренней энергии некоторого количества идеального одноатомного газа
Используя уравнение Клапейрона—Менделеева, можно осуществить замену:

Решая совместно уравнения (1) и (2), получим:
Ответ:
Внутренняя энергия тела
Любое макроскопическое тело обладает энергией, что обусловлено его микросостоянием. Эта энергия называется внутренней (обозначается U). Она равна энергии всех микрочастиц вещества, из которых состоит данное тело. Например, внутренняя энергия идеального газа состоит из кинетической энергии всех его молекул, без учета их потенциальной энергии, поскольку взаимодействием молекул в модели идеального газа пренебрегают.
Модель идеального газа предусматривает, что молекулы пребывают на расстоянии нескольких диаметров друг от друга. Поэтому энергия их взаимодействия намного меньше энергии их движения, следовательно, ею можно пренебречь.
В реальных газах, а также в жидкостях и твердых телах внутреннюю энергию необходимо учитывать, потому что она соизмерима с кинетической энергией и существенно влияет на их свойства. В таком случае их внутренняя энергия состоит из кинетической энергии теплового движения микрочастиц и потенциальной энергии их взаимодействия.
Для того чтобы изменить внутреннюю энергию тела, следует фактически изменить или кинетическую энергию теплового движения микрочастиц, или потенциальную энергию их взаимодействия, или и ту и другую вместе. Многовековой опыт человечества убеждает нас в том, что это можно сделать двумя способами — либо в процессе теплообмена, либо в ходе выполнения работы. В первом случае это произойдет вследствие передачи определенного количества теплоты Q; во втором — в результате выполнения работы А.
Изменение внутренней энергии тела может произойти за счет теплообмена или в результате выполнения работы:
Следовательно, передача количества теплоты и выполнение работы являются факторами, благодаря которым можно изменить внутреннюю энергию тела:
В случае, когда происходит лишь теплообмен, полученное или отданное телом количество теплоты полностью идет на изменение его внутренней энергии, в частности кинетической энергии его атомов и молекул: 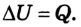
В процессе плавления или кристаллизации твердых тел внутренняя энергия изменяется за счет потенциальной энергии взаимодействия микрочастиц, потому что происходит структурная перестройка вещества. В данном случае изменение внутренней энергии равно теплоте плавления (кристаллизации) тела:
где 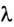
Если изменение внутренней энергии тела происходит вследствие теплообмена, то 
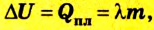
Испарение жидкости или конденсация пара также ведет к изменению внутренней энергии, которая равна в таком случае теплоте парообразования: 
где r — удельная теплота парообразования (конденсации) жидкости.
Изменение внутренней энергии тела вследствие выполнения механической работы (без теплообмена) равно значению работы:
Следовательно, с точки зрения молекулярной физики внутренняя энергия тела является суммой кинетической энергии теплового движения атомов, молекул и других частиц, из которых оно состоит, и потенциальной энергии их взаимодействия. Это энергия термодинамической системы, которая зависит от ее внутреннего состояния. Поэтому вычисляют изменение внутренней энергии 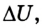
Работа газа
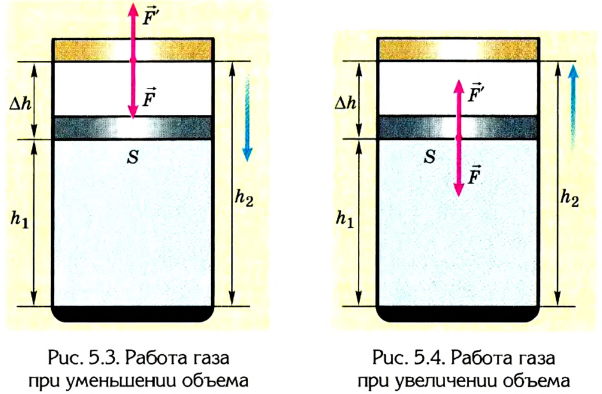
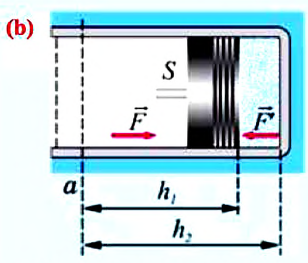
Вычисление выполненной работы в термодинамике связывают с макропараметрами системы. Рассмотрим газ, находящийся в цилиндре под поршнем площадью S (рис. 5.3).
Пусть на газ действует поршень, вызывая его сжатие. Под действием силы F поршень опускается на высоту 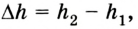
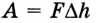
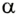
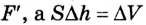
Поскольку 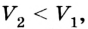
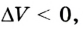
Если под действием силы давления F’ газ расширяется (рис. 5.4), т. е. он сам выполняет работу 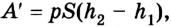
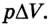
Во время незначительных изменений объема и при постоянном давлении формулы (1) и (2) справедливы не только для газов, но и иных термодинамических систем. Поскольку изменение объема при постоянном давлении сопровождается изменением температуры тела, то можно сделать вывод, что выполнение работы в термодинамике вызывает изменение состояния тела, ведь при этом изменяются его температура Т и объем V.
Первый закон термодинамики
Тот факт, что внутреннюю энергию тела можно изменить двумя способами — в результате выполнения работы или за счет теплопередачи, вынуждал ученых искать соотношение между соответствующими величинами. Вначале в 1842 г. немецкий естествоиспытатель Р. Майер теоретически установил, а затем в 1843 г. английский ученый Дж. Джоуль экспериментально измерил эквивалентность значений количества теплоты и работы. В соответствии с полученными результатами ученые сделали обобщения, которые касались сохранения энергии в природе: энергия в природе не возникает из ничего и не пропадает бесследно; она лишь переходит из одного вида в другой.
Позже этот фундаментальный закон природы приобрел логическую форму первого закона термодинамики: переход термодинамической системы из одного состояния в другое характеризуется изменением ее внутренней энергии, равной сумме работы внешних сил и количества теплоты, переданной системе:
В каком бы состоянии не было тело, оно обладает определенной внутренней энергией. Однако нельзя утверждать, что оно содержит определенное количество теплоты либо запас выполненной работы. Независимо от того, каким из этих способов произведено изменение состояния тела, его состояние однозначно определяется внутренней энергией. Например, газ может быть нагрет за счет передачи ему некоторого количества теплоты либо в результате выполнения внешними силами над ним работы (сжатие газа). Однако невозможно однозначно указать, благодаря какому из этих процессов — выполнению работы или теплопередаче — произошло нагревание газа.
Если система сама выполняет работу (А = -А’), то первый закон термодинамики приобретает другой вид:
т. е. передача термодинамической системе определенного количества теплоты вызывает изменение ее внутренней энергии или выполнение работы, либо то и другое одновременно.
Еще в 1775 г. Французская академия наук приняла решение не рассматривать проекты вечных двигателей.
Последняя формулировка первого закона термодинамики важна с точки зрения отрицания возможности создания вечного двигателя: нельзя создать машину, которая бы неограниченно выполняла работу, не получая энергию извне. Ведь, если количество теплоты Q = 0, то А’ = 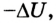
Тепловые двигатели
Человечество научилось использовать тепловую энергию, создав тепловые машины и двигатели. В основу их действия положена идея, что выполнение механической работы может осуществляться за счет теплоты, получаемой от какого-либо нагревателя и частично отдаваемой холодильнику.
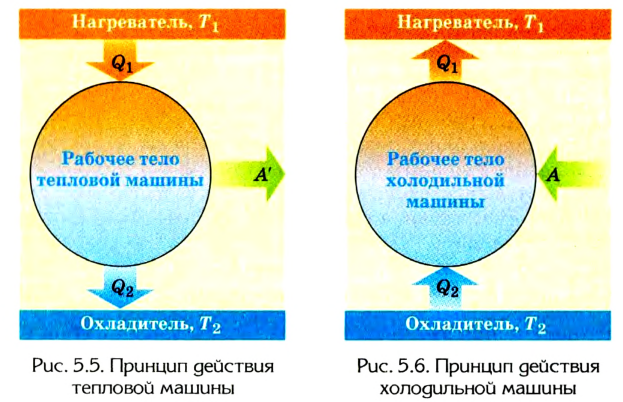
Принцип действия тепловой машины можно представить схематически (рис. 5.5). Нагреватель передает рабочему телу определенное количество теплоты 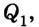
может быть газ или пар, выполняющие работу вследствие своего расширения при нагревании. В паровых турбинах это происходит благодаря паровым котлам, в двигателях внутреннего сгорания — в результате сгорания топливной смеси, в реактивных двигателях — за счет большой теплоотдачи топлива во время быстрого его сгорания.
Выполняя работу, рабочее тело отдает определенную часть количества теплоты 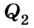
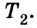
Согласно закону сохранения энергии значение выполненной работы 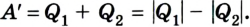
Следовательно, коэффициент полезного действия тепловой машины всегда меньше 1 (часто его представляют в процентах). К примеру, у двигателей внутреннего сгорания он равен приблизительно 44 %, у паровых турбин — до 40 %.
Коэффициент полезного действия равен отношению величины выполненной работы к затраченной при этом энергии:
Холодильник также является тепловой машиной. Принцип его действия основан на обратимости цикла тепловой машины. Холодильная машина работает как тепловой насос: она отбирает тепловую энергию у менее нагретого тела и передает ее более нагретому (рис. 5.6). Это не противоречит законам термодинамики, поскольку охлаждение происходит за счет выполнения работы.
Для того чтобы привести в действие холодильную машину, необходимо над рабочим телом выполнить работу. В таком случае нагревателю будет передаваться количество теплоты, превышающее по значению то, которое отбирается у охладителя: 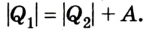
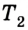
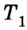
Эффективность работы холодильной машины характеризуется отношением количества теплоты 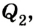
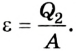
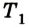
Основные определения и формулы
В основу термодинамического подхода положено описание термодинамической системы при помощи легко измеримых макропараметров — температуры (Т), давления (р), объема (V), массы (m) и др.
Внутренняя энергия тела равна энергии всех микрочастиц вещества, из которых оно состоит. Ее можно изменить за счет теплообмена или в результате выполнения работы. Количество теплоты, переданное телу (либо отобранное у него), определяется в зависимости от теплового процесса, который при этом осуществляется:
при нагревании (охлаждении )
при плавлении (кристаллизации )
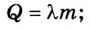
при парообразовании (конденсации)
Работа газа при постоянном давлении (р = const) равна: 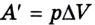
Первый закон термодинамики устанавливает, что количество теплоты, переданное термодинамической системе, вызывает изменение ее внутренней энергии или выполнение работы, либо и той другое одновременно:
Он отражает сущность фундаментального закона сохранения энергии, которым отрицается возможность создания вечного двигателя: нельзя создать машину, которая неограниченно выполняла бы работу, не получая энергию извне.
Законы термодинамики получили широкое практическое применение, в частности, в технике, при конструировании тепловых машин. Все тепловые машины (двигатели внутреннего сгорания, реактивные двигатели, паровые и газовые турбины, холодильные машины и пр.) построены по принципу выполнения механической работы за счет внутренней энергии. Их КПД всегда меньше 1 и равен:
Основы термодинамики
В 9 классе вы узнали, что полная энергия физической системы представляет собой сумму её механической энергии и внутренних энергий тел, образующих систему. Причём изменение механической энергии в ряде случаев происходит в результате перехода её части во внутреннюю энергию тел системы. Режущие инструменты заметно нагреваются при заточке их на точильном камне. При скольжении конькобежца по льду под коньками тает лёд, что обеспечивает хорошее скольжение. В этих примерах тела при трении нагреваются, и интенсивность хаотического движения молекул возрастает, что приводит к увеличению внутренней энергии тел. Как же определить внутреннюю энергию термодинамической системы? И что понимают под термодинамической системой?
Выводы термодинамики основаны на фундаментальных законах, называемых началами термодинамики. Эти законы установлены в результате обобщения многочисленных экспериментальных фактов. Опираясь на них, термодинамика позволяет делать определённые выводы о свойствах исследуемых систем, которые подтверждаются экспериментально. Физические тела и их модели в термодинамике называют термодинамическими системами. Термодинамическую систему характеризуют набором параметров, определяющих её состояние. В отличие от молекулярно-кинетической теории в термодинамике не рассматривают микроскопическое строение тел и для их описания используют не физические характеристики молекул (микропараметры), а параметры системы (макропараметры), такие как давление, объём, температура.
Замкнутая, или же изолированная, термодинамическая система стремится к равновесию, когда все её макропараметры не изменяются с течением времени. Иначе говоря, для каждой изолированной термодинамической системы существует состояние термодинамического равновесия, в которое она переходит самопроизвольно.
Это утверждение называют нулевым началом термодинамики.
Говоря о полной энергии макроскопического тела, необходимо всегда учитывать не только его механическую энергию (кинетическую и потенциальную), но также кинетическую энергию теплового движения его частиц и потенциальную энергию их взаимодействия. В термодинамике под внутренней энергией тела понимают полную энергию, относящуюся к самим частицам, образующим тело. Это кинетическая энергия теплового движения молекул, кинетическая энергия движения атомов внутри молекул, потенциальная энергия взаимодействия между молекулами, энергия электронных оболочек атомов и внутриядерная энергия.
Внутренняя энергия любой термодинамической системы состоит из внутренних энергий тел, входящих в данную систему.
В термодинамике главную роль играет не сама внутренняя энергия, а её изменение, которое происходит при переходе системы из одного состояния в другое. Под приращением (изменением) внутренней энергии понимают разность внутренних энергий в конечном и начальном состояниях:
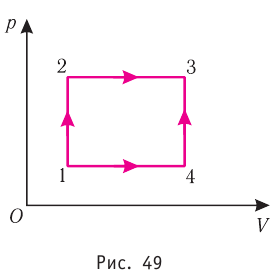
Например, переход некоторой массы идеального газа из состояния / в состояние 3 (рис. 49) можно осуществить или в ходе процесса 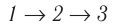
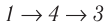
Внутренняя энергия является функцией состояния системы. Это означает, что изменение внутренней энергии при переходе термодинамической системы из одного состояния в другое зависит только лишь от значений параметров этих состояний, а не от процесса перехода.
Внутренняя энергия идеального одноатомного газа:
Определим внутреннюю энергию идеального одноатомного газа, т. е. газа, состоящего из отдельных атомов. Например, к одноатомным газам относят инертные газы — гелий, неон, аргон и др.
Из определения понятия «идеальный газ» следует, что его внутренняя энергия является суммой кинетических энергий хаотического движения всех молекул или атомов (взаимодействие между частицами отсутствует). Следовательно, внутренняя энергия идеального одноатомного газа равна произведению средней кинетической энергии 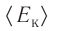
т. е. 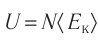
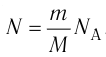
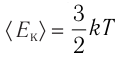
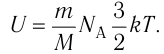
С учётом того, что 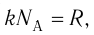
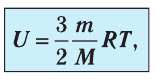
или
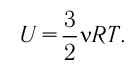
Как видно из формулы (9.1), внутренняя энергия данной массы идеального одноатомного газа пропорциональна абсолютной температуре газа. Она не зависит от других макроскопических параметров состояния — давления и объёма. Следовательно, изменение внутренней энергии данной массы идеального одноатомного газа происходит только при изменении его температуры: 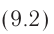
При определении внутренней энергии реальных газов, жидкостей и твёрдых тел необходимо учитывать потенциальную энергию взаимодействия частиц, которая зависит от расстояния между ними. Поэтому в общем случае внутренняя энергия макроскопических тел зависит не только от абсолютной температуры, но и от объёма.
При изучении физики в 8 классе вы узнали, что изменить состояние термодинамической системы можно двумя способами: используя теплопередачу и совершая работу. Процесс теплопередачи и совершение работы характеризуют соответственно физическими величинами — количеством теплоты Q и работой А, которые являются мерами изменения внутренней энергии системы.
- Физические тела и их модели в термодинамике называют термодинамическими системами. Термодинамическую систему характеризуют набором макронараметров, определяющих её состояние.
- Состояние изолированной термодинамической системы, когда все её макропараметры не изменяются с течением времени, называют равновесным.
- Под внутренней энергией термодинамической системы понимают сумму кинетической энергии всех частиц системы и потенциальной энергии их взаимодействия.
- Изменение внутренней энергии тела при переходе из одного состояния в другое зависит только лишь от значений параметров этих состояний, а не от процесса перехода.
- Внутренняя энергия данной массы идеального одноатомного газа зависит только от температуры:
Пример решения задачи №2
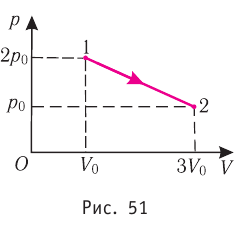
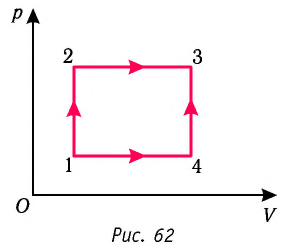
На рисунке 51 в координатах (р, V) изображён процесс перехода идеального одноатомного газа определённой массы из состояния 1 в состояние 2. Определите приращение внутренней энергии газа, если давление газа в конечном состоянии 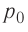
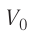
Приращение внутренней энергии идеального одноатомного газа 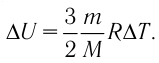
изменение температуры 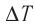
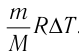
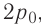
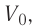
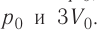
Вычтем из уравнения (2) уравнение (1): 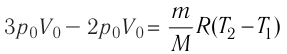
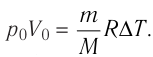
Ответ:
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Необратимость тепловых процессов
- Адиабатический процесс
- Молекулярно-кинетическая теория
- Работа в термодинамике
- Освоение космоса — история, этапы и достижения с фотографиями
- Закон сохранения механической энергии в физике
- Релятивистская механика в физике
- Теория относительности Эйнштейна
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
http://pdf.knigi-x.ru/21fizika/218642-1-termodinamika-himicheskogo-ravnovesiya-lekciya-fundamentalnie-uravneniya-dlya-zakritih-sistem-differenciali-termodinam.php
http://www.evkova.org/termodinamika
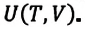
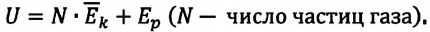
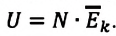
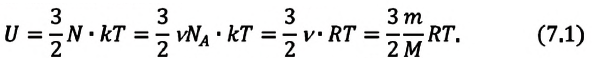


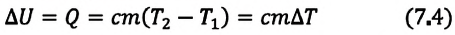


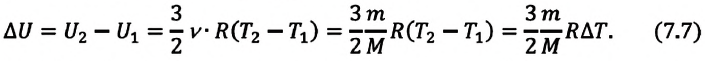

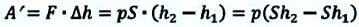

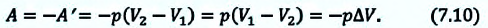
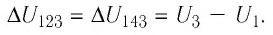
 — приращение физической величины, т. е. разность между её конечным и начальным значениями;
— приращение физической величины, т. е. разность между её конечным и начальным значениями;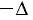 — убыль величины, т. е. разность между её начальным и конечным значениями.
— убыль величины, т. е. разность между её начальным и конечным значениями.