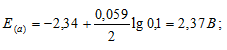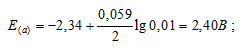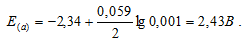СХЕМА РАБОТЫ ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА И ТИПОВЫЕ ЗАДАЧИ
Фундаментальные законы физики и химии, и в том числе, закон сохранения массы и энергии вещества, находят свое подтверждение на уровне перемещения мельчайших частиц – электронов, массами которых в химии обычно пренебрегают.
Речь идет об окислительно-восстановительных процессах, сопровождающихся переходом электронов от одних веществ (восстановителей) к другим (окислителям). Причем вещества могут обмениваться электронами, непосредственно соприкасаясь друг с другом.
Однако существует множество случаев, когда прямого контакта веществ не происходит, а процесс окисления-восстановления все равно идет. А если он идет самопроизвольно, то при этом еще и энергия выделяется. Ее человек с успехом использует для выполнения электрической работы.
Реализуется такая возможность в гальваническом элементе, схема работы которого, а также расчеты, связанные с ним, рассматриваются в данной статье.
Простейший гальванический элемент: схема работы
Гальванический элемент – это прибор, позволяющий при посредстве химической реакции получить электрическую энергию.
Пластинка металла и вода: простые взаимоотношения
Давайте сначала разберемся, что происходит с пластинкой металла, если опустить ее в воду?
Процесс схож с диссоциацией соли: диполи воды ориентируются к ионам металла и извлекают их из пластины. Но почему же тогда не происходит растворения самой пластины в воде? Все дело в строении кристаллической решетки.
Кристаллы соли состоят из катионов и анионов, поэтому диполями воды извлекаются из решетки и те, и другие.
У металла же кристаллическая решетка представлена атомами-ионами. Внутри нее всегда происходит превращение атомов в катионы за счет отщепления валентных электронов и обратный процесс: катионы снова превращаются в атомы, присоединяя электроны. Электроны являются общими для всех ионов и атомов, присутствующих в кристаллической решетке металла.
Процессы внутри металлической кристаллической решетки в обобщенном виде можно показать так:
В итоге, вода, окружающая пластинку – это уже не собственно вода, а раствор, составленный из молекул воды и перешедших в нее из пластины ионов металла. На пластине же возникает избыток электронов, которые скапливаются у ее поверхности, так как сюда притягиваются гидратированные катионы металла.
Возникает так называемый двойной электрический слой.
Бесконечно катионы металла с пластины в раствор уходить не будут, поскольку существует и обратный процесс: переход катионов из раствора на пластину. И он будет идти до тех пор, пока не наступит динамическое равновесие:
На границе раздела «металлическая пластина – раствор» возникает разность потенциала, которая называется равновесным электродным потенциалом металла.
Пластинка металла и раствор его соли: к чему приводит такое соседство
А что произойдет, если металлическую пластинку поместить не в воду, а в раствор соли этого же металла, например, цинковую пластинку Zn в раствор сульфата цинка ZnSO4?
В растворе сульфата цинка уже присутствуют катионы цинка Zn 2+ . Таким образом, при погружении в него цинковой пластины возникнет избыточное количество этих катионов, и уже известное нам равновесие (см. выше) сместится влево. Все это приведет к тому, что отрицательный заряд на пластинке будет иметь меньшее значение, так как меньшее количество катионов с нее будет переходить в раствор. Как результат – более быстрое наступление равновесия и менее значительный скачок потенциала.
Потенциал металла в растворе его же соли в момент равновесия записывают так:
Металл, погруженный в раствор электролита, называют электродом, обратимым относительно катиона.
Цинк – достаточно активный металл. А если речь будет идти о медной пластинке Cu, погруженной в раствор, например, сульфата меди (II) CuSO4?
Медь – металл малоактивный. Двойной электрический слой, конечно же, появится и в этом случае. Но! Катионы из пластинки в раствор переходить не будут. Наоборот, катионы меди (II) Cu 2+ из раствора соли начнут встраиваться в кристаллическую решетку пластинки и создавать положительный заряд на ее поверхности. Сюда же подойдут сульфат-анионы SO4 2- и создадут вокруг нее отрицательный заряд. То есть распределение зарядов в данном случае будет совершенно противоположным, чем на цинковой пластинке.
Это общая закономерность: пластинки из малоактивных металлов при погружении в раствор их солей всегда заряжаются положительно.
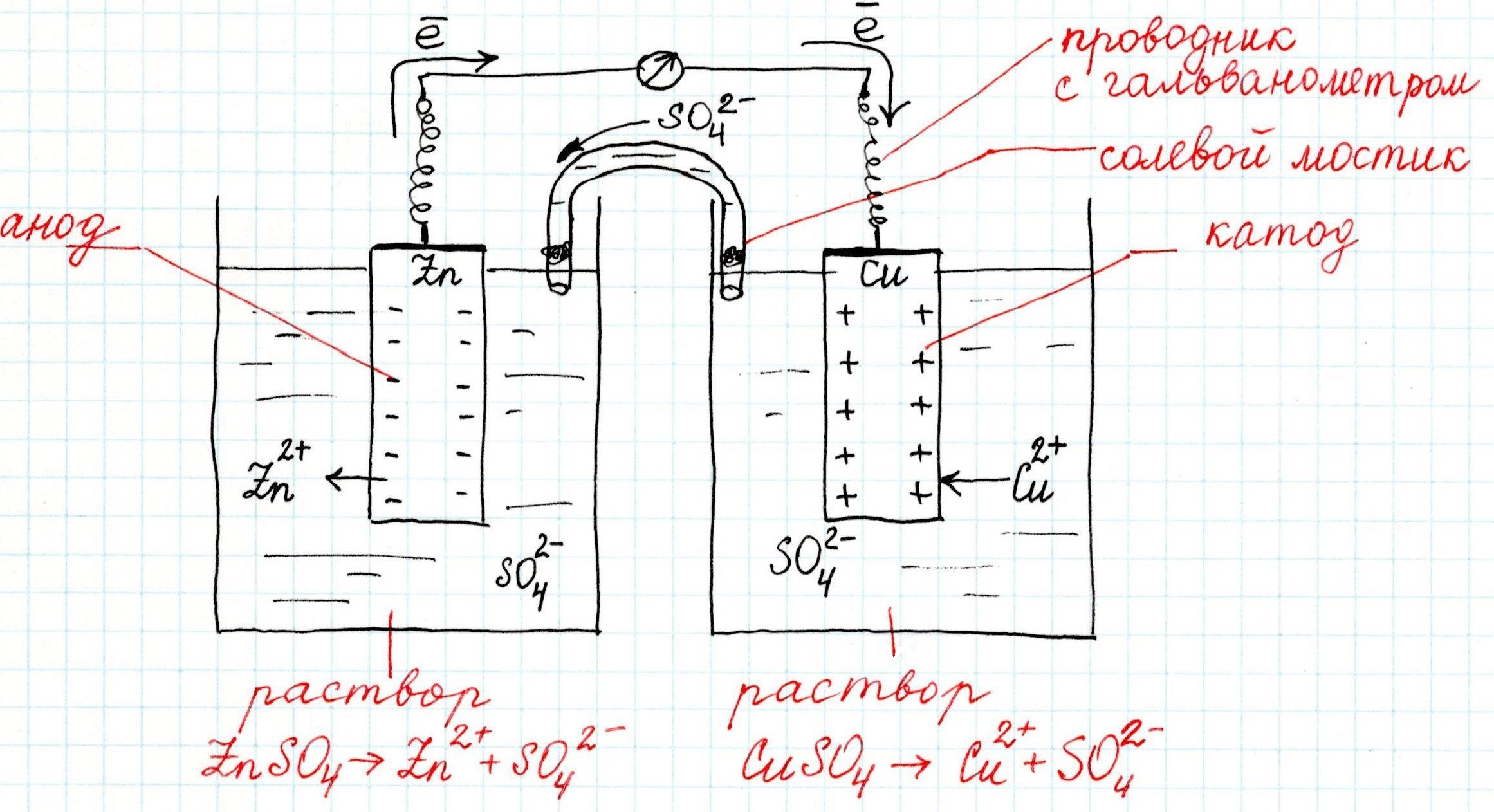
Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
Известно, что электрический ток – это направленное движение заряженных частиц (электронов).
На активном металле скапливаются электроны, а поверхность малоактивного металла, заряжается положительно. Если соединить проводником (например, металлической проволокой) оба металла, то электроны с одного перейдут на другой, а двойной электрический слой перестанет существовать. Это будет означать возникновение электрического тока.
Причем, ток возникает за счет окислительно-восстановительного процесса: активный металл окисляется (так как отдает электроны малоактивному), а малоактивный металл восстанавливается (так как принимает электроны от активного). Металлы друг с другом не соприкасаются, а взаимодействуют через посредника: внешнего проводника. Данная схема и есть схема гальванического элемента. Именно так устроен и работает гальванический элемент Даниэля-Якоби:
В схеме элемента показан «солевой мостик». Он представляет собой трубку, в которой присутствует электролит, не способный взаимодействовать ни с электродами (катодом или анодом), ни с электролитами в пространствах у электродов. Например, это может быть раствор сульфата натрия Na2SO4. Подобный мостик нужен для того, чтобы уравновешивать (нейтрализовать) заряды, образующиеся в растворах гальванического элемента.
Таким образом, возникшая электрическая цепь замыкается: анод → проводник с гальванометром → катод → раствор в катодном пространстве → «солевой мостик» → раствор в анодном пространстве → анод.
Анод – электрод, на котором происходит окисление (цинковая пластинка):
Электроны цинка Zn отправляются по внешней цепи (то есть по проводнику) на катод.
Катод – электрод, на котором происходит восстановление (медная пластинка):
Катионы меди Cu 2+ , пришедшие на пластинку из раствора сульфата меди (II), получают электроны цинкового анода.
В общем виде весь процесс окисления-восстановления в гальваническом элементе выглядит так:
Для любого гальванического элемента можно составить запись в виде схемы. Например, для приведенного элемента Даниэля-Якоби она будет выглядеть так:
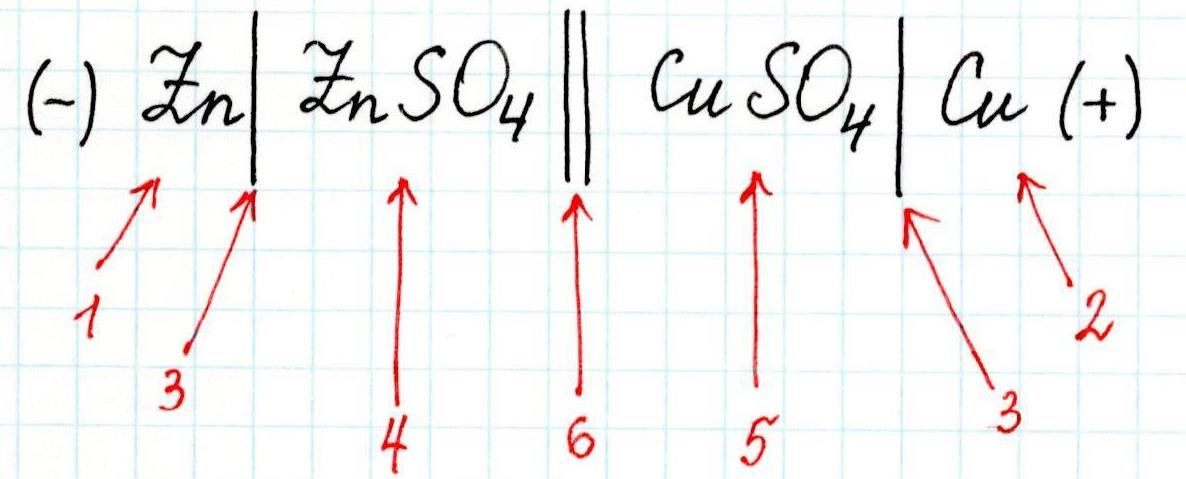
3 – скачок потенциала (граница раздела фаз);
4 – электролит в анодном пространстве;
5 – электролит в катодном пространстве;
6 – граница между растворами (солевой мостик).
Или сокращенно:
Типовые задачи на схему гальванического элемента: примеры решения
По вопросу, рассмотренному в данной статье, возможны два основных вида задач.
Задача 1. Составьте схему гальванического элемента, в котором протекает реакция:

Задача 2. Напишите электродные и суммарные уравнения реакций, протекающих в гальваническом элементе:

Итак, разобрав принцип работы гальванического элемента, мы научились записывать схему его работы и определять основные процессы на электродах.
Процессы протекающие при работе гальванического элемента
Если два электрода, например Zn и Cu погрузить в растворы их солей (соответственно ZnSO4 и CuSO4) и соединить металлическим проводником, образуется гальванический элемент. Гальваническими элементаминазывают устройства, в которых химическая энергия окислительно-восстановительных процессов преобразуется в электрическую энергию.
При работе гальванического элемента цинк, как более активный металл, окисляется, его ионы переходят в раствор, а высвобождающиеся электроны движутся по внешней цепи к медному электроду. На медном электроде протекает реакция восстановления ионов меди из раствора.
Суммируя оба процесса, получаем уравнение, выражающее происходящую в гальваническом элементе реакцию в ионной форме:
Zn + Cu2+ → Cu + Zn2+.
Молекулярное уравнение этой реакции будет иметь вид:
Zn + CuSO4 → Cu + Zn SO4.
Суммарная окислительно-восстановительная реакция, протекающая в гальваническом элементе,
называется
токообразующей.
В гальваническом элементе процессы окисления и восстановления протекают раздельно, на разных электродах. Электрод, на котором протекает окисление,
называется
анодом. В гальваническом элементе анод имеет знак минус. Электрод, на котором протекает восстановление
, называется
катодом. В гальваническом элементе катод имеет знак плюс. В паре металлов всегда более активный металл является анодом, менее активный – катодом.
Гальванический элемент обозначают схемой. Слева записывается анод Zn|Zn2+, на котором возникает избыток электронов и происходит процесс окисления. Справа – катод Cu2+|Cu – электрод с недостатком электронов. Одна вертикальная черта изображает фазовый раздел между металлом и раствором электролита. Двойная вертикальная линия отделяет анодное пространство от катодного. Электроны по внешнему участку цепи, металлическому проводнику, переходят от отрицательного полюса к положительному. Внешнюю цепь на схеме не изображают. В круглых скобках знаками «плюс» и «минус» обозначают полюсы электродов. В рассмотренном примере эта схема будет иметь следующий вид:
(–)Zn|Zn2+|| Cu2+|Cu (+) или (–)Zn|ZnSO4|| CuSO4|Cu(+) .
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента
, называется
электродвижущей силой(ЭДС). Обозначается E, измеряется в вольтах. ЭДС элемента равна разности потенциалов катода и анода: E = jк – jа.
Стандартная ЭДС равна разности стандартных электродных потенциалов катода и анода: E0 = j0к – j0а. Так, для элемента Даниэля – Якоби стандартная ЭДС равна: Eo = joСu2+/Cu – j0Zn2+/Zn = +0,337 – (–0,763) = +1,100 В.
Окислительно-восстановительная реакция, характеризующая работу гальванического элемента, протекает в направлении, в котором ЭДС имеет положительное значение. В этом случае ΔG0х.р. Читайте также: Характеристики и область применения провода ПРКС
Гальванические элементы являются источниками электрической энергии одноразового действия. Реагенты (окислитель и восстановитель) входят непосредственно в состав гальванического элемента и расходуются в процессе его работы. Гальванический элемент характеризуется ЭДС, напряжением, мощностью, емкостью и энергией, отдаваемой во внешнюю цепь, а также сохраняемостью и экологической безопасностью.
ЭДС определяется природой протекающих в гальваническом элементе процессов. Напряжение гальванического элемента U всегда меньше его ЭДС в силу поляризации электродов и потерь сопротивления:
U = Eэ – I(r1–r2) – ΔE,
где Еэ – ЭДС элемента; I – сила тока в режиме работы элемента; r1 и r2 – сопротивление проводников I и II рода внутри гальванического элемента; ΔЕ – поляризация гальванического элемента, складывающаяся из поляризаций его электродов (анода и катода). Поляризация возрастает с увеличением плотности тока (i), определяемой по формуле i = I/S, где S – площадь поперечного сечения электрода, и ростом сопротивления системы.
В процессе работы гальванического элемента его ЭДС и, соответственно, напряжение постепенно снижаются в связи с уменьшением концентрации реагентов и увеличением концентрации продуктов окислительно-восстановительных процессов на электродах (вспомним уравнение Нернста). Однако чем медленнее снижается напряжение при разряде гальванического элемента, тем больше возможностей его применения на практике. Емкостью элемента называют общее количество электричества Q, которое гальванический элемент способен отдать в процессе работы (при разрядке). Емкость определяется массой запасенных в гальваническом элементе реагентов и степенью их превращения. При увеличении тока разряда и снижении температуры работы элемента, особенно ниже 00С, степень превращения реагентов и емкость элемента снижаются.
Энергия гальванического элемента равна произведению его емкости на напряжение: ΔН = Q.U. Наибольшей энергией обладают элементы с большим значением ЭДС, малой массой и высокой степенью превращения реагентов.
Сохраняемостью называют продолжительность срока хранения элемента, в течение которого его характеристики остаются в заданных параметрах. С ростом температуры хранения и эксплуатации элемента, его сохраняемость уменьшается.
Состав гальванического элемента: восстановителями (анодами) в портативных гальванических элементах, как правило, служат цинк Zn, литий Li, магний Mg; окислителями (катодами) – оксиды марганца MnO2, меди CuO, серебра Ag2O, серы SO2, а также соли CuCl2, PbCl2, FeS и кислород О2.
Самым массовым в мире остается производство марганец–цинковых элементов Mn–Zn, широко применяемых для питания радиоаппаратуры, аппаратов связи, магнитофонов, карманных фонариков и т.п. Конструкция такого гальванического элемента представлена на рисунке
Токообразующими реакциями в этом элементе являются:
— на аноде (–): Zn – 2ē → Zn2+ (на практике происходит постепенное растворение цинковой оболочки корпуса элемента);
— на катоде (+): 2MnO2 + 2NH4+ + 2ē → Mn2O3 + 2NH3 + H2O.
В электролитическом пространстве также идут процессы:
— у анода Zn2+ + 2NH3 →[Zn(NH3)2]2+;
— у катода Mn2O3 + H2O → [Mn2O2(OH)2] или 2[MnOOH].
В молекулярном виде химическую сторону работы гальванического элемента можно представить суммарной реакцией:
Zn + 2MnO2 + 2NH4Cl → [Zn(NH3)2]Cl2 + 2[MnOOH].
Схема гальванического элемента:
ЭДС такой системы составляет Е= 1,25 ÷ 1,50В.
Гальванические элементы с подобным составом реагентов в щелочном электролите (КОН) имеют лучшие выходные характеристики, но они неприменимы в портативных устройствах в силу экологической опасности. Еще более выгодными характеристиками обладают серебряно-цинковые элементы Ag-Zn, но они чрезвычайно дороги, а значит, экономически неэффективны. В настоящее время известно более 40 различных типов портативных гальванических элементов, называемых в быту «сухими батарейками».
2. Электрические аккумуляторы
Электрические аккумуляторы (вторичные ХИТ)— перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить.
Аккумуляторы – это устройства, в которых под воздействием внешнего источника тока в системе накапливается (аккумулируется) химическая энергия (процесс зарядки аккумулятора), а затем при работе устройства (разрядка) химическая энергия снова превращается в электрическую. Таким образом, при зарядке аккумулятор работает как электролизер, а при разрядке – как гальванический элемент.
В упрощенном виде аккумулятор представляет собой два электрода (анод и катод) и ионный проводник между ними – электролит. На аноде как при разряде, так и при заряде протекают ре6акции окисления, а на катоде – реакции восстановления.
До последнего времени по-прежнему наиболее распространенными в России, да и в Приднестровье, остаются кислотные свинцовые и щелочные никель-кадмиевые и никель-железные аккумуляторы.
Электроды в нем представляют собой свинцовые решетки, из которых одна заполняется в порах порошком оксида свинца IV – PbO2. Электроды соединены с электролитом через пористый сепаратор. Всеь аккумулятор помещается в бак из эбонита или полипропилена.
При работе такого устройства в нем происходят следующие электродные процессы:
А). Разрядка или работа аккумулятора как источника электрической энергии.
На аноде: (–) Pb – 2ē → Pb2+;
на катоде: (+) PbO2 + 4H+ + 2ē → Pb2+ + 2H2O.
Образующиеся на электродах катионы свинца взаимодействуют с анионами электролита с выделением белого осадка сульфата свинца
Pb2+ + SO42– = ↓PbSO4.
Суммарная токообразующая реакция процесса разрядки аккумулятора:
Pb + PbO2 + 2H2SO4 = 2PbSO4↓ + 2H2O,
а схема работающего аккумулятора как гальванического элемента имеет вид (–) Pb|PbSO4||PbO2 (+).
Напряжение на клеммах работающего аккумулятора достигает величины 2,0÷2,5В. В процессе эксплуатации устройства электролит расходуется, а в системе накапливается осадок. Когда концентрация активных ионов водорода [Н+] становится критической для реакции на катоде, аккумулятор прекращает свою работу.
Б). Зарядка или восстановление химического потенциала аккумулятора для последующего его преобразования в электрическую энергию. Для этого аккумулятор подсоединяют к внешнему источнику тока таким образом, что к клемме «анод» подается отрицательный полюс, а к клемме «катод» — положительный. В этом случае на электродах под действием внешнего напряжения возникают обратные процессы, восстанавливающие их до первоначального состояния.
Металлический свинец восстанавливает поверхность электрода (–): PbSO4 + 2ē → Pb + SO42;
Образующийся оксид свинца IV заполняет поры свинцовой решетки (+): PbSO4 + 2H2O – 2ē → ↓PbO2 + 4H+ + SO42.
Суммарная восстановительная реакция: 2PbSO4 + 2H2O = Pb + PbO2 +2H2SO4.
Определить момент окончания процесса зарядки аккумулятора можно по появлению пузырьков газа над его клеммами («кипение»). Это связано с возникновением побочных процессов восстановления катионов водорода и окисления воды с ростом напряжения при восстановлении электролита:
2Н+ + 2ē → Н2↑; 2Н2О – 4ē → О2↑ + 2Н2↑.
Коэффициент полезного действия аккумулятора достигает 80% и рабочее напряжение длительное время сохраняет свое значение.
ЭДС аккумулятора может быть рассчитана по уравнению:
EЭ = EЭ0 + –––– ℓn –––––––––––––– (твердые фазы в Сравн. не
2F α2(H2O) учитываются).
Надо заметить, что в аккумуляторе нельзя использовать концентрированную серную кислоту (ω(H2SO4) > 30%), т.к. при этом уменьшается ее электрическая проводимость и увеличивается растворимость металлического свинца. Свинцовые аккумуляторы широко используются в автомобильном транспорте всех типов, на телефонных и электрических станциях. Однако из-за высокой токсичности свинца и его продуктов, свинцовые аккумуляторы требуют герметичной упаковки и полной автоматизации процессов их эксплуатации.
А) В щелочных аккумуляторах положительный электрод изготавливается из никелевой решетки, пропитанной гелеобразным гидрооксидом никеля II Ni(OH)2; а отрицательный – из кадмия или железа. Ионным проводником служит 20%-ый раствор гидрооксида калия КОН. Суммарные токообразующие и генерирующие реакции в таких аккумуляторах имеют вид:
2NiOOH + Cd + 2H2O ◄======►2Ni(OH)2 + Cd(OH)2; ЕЭ0 = 1,45В.
2NiOOH + Fe + 2H2O ◄======►2Ni(OH)2 + Fe(OH)2; ЕЭ0 = 1,48В.
К достоинствам этих аккумуляторов относят большой срок их службы (до 10 лет) и высокую механическую прочность, а к недостаткам – невысокие КПД и рабочее напряжение. Щелочные аккумуляторы используются для питания электрокар, погрузчиков, рудничных электровозов, аппаратуры связи и электронной аппаратуры, радиоприемников. Вспомним также, что кадмий является высокотоксичным металлом, что требует соблюдения правил безопасности при утилизации отработанных устройств.
В последние годы активно разрабатываются аккумуляторы с литиевым отрицательным электродом, неводным электролитом и положительным электродом, состоящим из оксидов V2O3; NiO; CoO; MnO2. Они используются в электронной слаботоковой аппаратуре.
Гальванические элементы Читать далее: Топливные элементы
Информация о работе «Гальванические элементы»
Раздел: Физика Количество знаков с пробелами: 54469 Количество таблиц: 0 Количество изображений: 3
Похожие работы
Гальванические элементы. Аккумуляторы
… элемент, обладающий технически ценными свойствами. Кроме того, многие окислительно-восстановительные реакции требуют расхода дорогостоящих веществ. В отличие от медно-цинкового элемента, во всех современных гальванических элементах и аккумуляторах используют не два, а один электролит; такие источники тока значительно удобнее в эксплуатации. ТИПЫ ГАЛЬВАНИЧЕСКИХ ЭЛЕМЕНТОВ Угольно- …
Схемы соединения гальванических элементов. Схема включения реостата. Схема включения потенциометра
… ЭДС и тока. Необходимо помнить, что в батарею должны соединятся элементы с одинаковыми характеристиками. План работы Начертить схемы замещения: Схемы включения реостата Схемы включения потенциометра Схемы соединения гальванических элементов. Вывод Из построенных схем и условий каждая цепь имеет своё значение ЭДС на каждой схеме она определяется по разному. Ответы на …
История создания гальванического производства
… развития гальванотехники в XIX – XX вв. в значительной степени остаётся открытым. Представляется, что его можно решить на основании реконструкции процесса создания гальванического производства; прослеживания, каким областям науки и техники, их конкретным достижениям обязано оно своим становлением; рассмотрения социально-экономических предпосылок возникновения и становления гальванотехники. …
… тока ниже, чем в гальваностегии; в железных гальванопластических ваннах она не превышает 10—30 а/м2, в то время как при железнении (гальваностегия) плотность тока достигает 2000—4000 а/м2. Гальванические покрытия должны иметь мелкокристаллическую структуру и равномерную толщину на различных участках покрываемых изделий — выступах и углублениях. Это требование имеет в гальваностегии особенно важное …
Составление уравнений электродных процессов и суммарной реакции, происходящей при работе гальванического элемента
Задача 652.
Гальванический элемент состоит из серебряного электрода, погруженного в 1 М раствор AgNO3, и стандартного водородного электрода. Написать уравнения электродных процессов и суммарной реакции, происходящей при работе элемента. Чему равна его э.д.с.?
Решение: 


H20 — 2 
Серебро, потенциал которой +0,80 В, — катод, т.е. электрод, на котором протекает восстановительный процесс:
Ag + + 2 
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим
H20 + 2Ag + = 2H + + 2Ag 0
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т.е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:


Ответ: +0,80В.
Задача 653.
Э. д. с. гальванического элемента, состоящего из стандартного водородного электрода и свинцового электрода, погруженного в 1 М раствор соли свинца, равна 126 мВ. При замыкании элемента электроны во внешней цепи перемещаются от свинцового к водородному электроду. Чему равен потенциал свинцового электрода? Составить схему элемента. Какие процессы протекают на его электродах?
Решение: 
Pb 0 — 2 
А на водородном – восстановительный:
2H + + 2 
Таким образом, свинцовый электрод будет анодом, а водородный – катодом.
Уравнение окислительно-восстановительного процесса, протекающего при работе данного гальванического элемента, можно получить, сложив электронные процессы на электродах:
Pb 0 + 2H + = Pb 2+ + H2 0
Для расчета электродного потенциала свинца, можно использовать уравнение определения ЭДС гальванического элемента:
E = 

Подставив в уравнение данные задачи, получим:
Е = 



Ответ: -0,126В.
Задача 654.
Рассчитать электродные потенциалы магния в растворе его соли при концентрациях иона Mg 2+ 0,1, 0,01 и 0,001 молы/л.
Решение:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация (при точных измерениях активность) гидратированных ионов металла в растворе. Е 0 для магния равен -2,34 В.
Определим электродные потенциалы магния в растворах при разных значениях концентрации его ионов:
а) Mg 2+ = 0,1 молы/л.
б) Mg 2+ = 0,01 молы/л.
в) Mg 2+ = 0,001 молы/л.
Ответ: а) 2,37 В; б) 2,40 В; в) 2,43 В.
http://lampa-ekb.ru/provodka/processy-protekayushchie-pri-rabote-galvanicheskogo-elementa-2.html
http://buzani.ru/zadachi/khimiya-glinka/1226-elektrodnye-protsessy-galvanicheskogo-elementa-zadachi-672