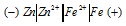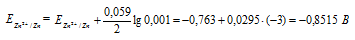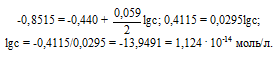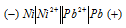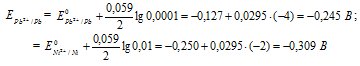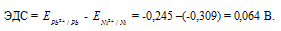Химические процессы протекающие на электродах при зарядке и разрядке аккумулятора. Концентрация ионов на электродах
Решение задач по химии на составление схемы аккумулятора
Задание 256.
Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (+2) (моль/л), чтобы ЭДС элемента стала равной нулю, если [Zn 2+ ] = 0,00 1 моль/л? Ответ: 7,3 моль/л.
Решение:
Цинк имеет меньший потенциал (-0,763 В) и является анодом, на котором протекает окислительный процесс:
Zn 0 — 2 
Железо, потенциал которого (-0,440 В) — катод, т.е. электрод, на котором протекает восстановительный процесс:
Fe 2+ + 2 
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
ЭДС гальванического элемента равна нулю, если электродные потенциалы электродов равны, следовательно, электродный потенциал железа численно равен электродному потенциалу цинка, т.е. равен -0,8515 В. Рассчитаем концентрацию ионов железа Fe 2+ , если электродный потенциал железного электрода равен -0,8515 В, получим:
Ответ: сFe 2+ = 1,124 . 10 -14 моль/л.
Задание 257.
Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
Ni + Pb(NO3)2 = Ni(NO3)2 + Рb
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Pb 2+ ] = 0,0001 моль/л, [Ni] = 0,01 моль/л. Ответ: 0,064 В.
Решение:
Уравнение реакции имеет вид:
Из уравнения реакции вытекает, что никель является анодом, на котором протекает окислительный процесс:
Ni 0 — 2 
Свинец – катод, электрод на котором протекает восстановительный процесс:
Pb 2+ + 2 
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Ответ: 0,064 В.
Задание 258.
Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
Решение:
В свинцовом аккумуляторе в качестве электролита используется раствор H2SO4 (p = 1,24-130 г/см 3 ). Электроды этого аккумулятора представляют свинцовые решётки. Решётки сначала заполняются оксидом свинца (IV) PbO2, который при взаимодействии с H2SO4 превращается в PbSO4. Сначала аккумулятор нужно зарядить. Суммарная реакция зарядки в аккумуляторе имеет вид:
2PbSO4 + 2H2O ⇔ Pb + PbO2 + 2H2SO4 (молекулярная форма);
2PbSO4 + 2H2O ⇔ Pb + PbO2 + 4H + + 2SO4 2- (ионно-молекулярная форма)
Электрохимические процессы при зарядке:
Анод: PbSO4 + 2H2O — 2 
Катод: PbSO4 + 2 
При разрядке свинцового аккумулятора протекает следующая химическая реакция:
Электрохимические процессы при разрядке аккумулятора:
Анод: Pb 2+ + SO4 2- — 2 
Катод: PbO2 + 4H + + SO4 2- + 2 
При разрядке аккумулятора:
К(+): PbO2 + 4H + + 2 
А(-): Pb 0 → Pb 2+ + 2
При зарядке аккумулятора:
К(+): Pb 2+ + 2 
А(-): Pb2+ + 2H2O → PbO2+4H + + 2
Задание 259.
Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
Решение:
При зарядке аккумулятора:
А(+): Ni(OH)2 + OH — → NiOOH + H2O + 1 
К(-): Cd(OH)2 + 2 
При разрядке аккумулятора:
К(+): NiOOH + H2O + 1 
А(-): Cd + 2OH — → Cd(OH)2 + 2 
Задание 260.
Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
Решение:
При зарядке аккумулятора:
А: Ni 2+ → Ni 3+ + 1 
К: Fe 2+ + 2 
При разрядке аккумулятора:
А: Fe 0 → Fe 2+ + 2 
К: Ni 3+ + 1 
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e28ce765f66717b • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей.
Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и катоде. Какой концентрации надо бы было взять ионы Fe 2+ , чтобы ЭДС элемента стала равной нулю, если [Zn 2+ ] = 0,001 моль/л?
Е 0 (Fe 2+ / Fe 0 ) = – 0,44 В
Е 0 (Zn 2+ / Zn 0 ) = – 0,763 В
По уравнению Нернста:
Е 0 (Zn 2+ / Zn 0 ) = – 0,763 В + 0,059/2* lg10 -3 = – 0,763 – 0,0885 = – 0,8515 В
ЭДС = Е 0 (Fe 2+ / Fe 0 ) – Е 0 (Zn 2+ / Zn 0 ) = 0 В
0 = х – (- 0,8515) → х = – 0,8515 В
Е 0 (Fe 2+ / Fe 0 ) = – 0,44 В + 0,059/2* lg у = – 0,8515 В
0,059/2* lg у = – 0,8515 + 0,44 = – 0,4115
Zn имеет меньший потенциал – он анод, Fe – катод.
На аноде: Zn 0 – 2ê = Zn 2+
На катоде: Fe 2+ + 2ê = Fe 0
Уравнение окислительно-восстановительной реакции:
http://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/256.html
http://einsteins.ru/subjects/chemistry/zadachi-chemistry/resheno-190