Курсовая работа Получение синтез-газа высокотемпературной конверсией углеводородов
Получение синтез-газа высокотемпературной конверсией углеводородов
1. Теоретические основы процесса высокотемпературной конверсии углеводородов 4
2. Аппаратурное оформление процесса высокотемпературной конверсии углеводородов 6
3. Технология процесса высокотемпературной конверсии углеводородов 8
Первые органические вещества, с которыми познакомился человек, были выделены из растительных и животных организмов или из продуктов их жизнедеятельности. Каждый растительный или животный организм представляет собой своеобразную химическую лабораторию в которой протекает множество сложнейших реакций, приводящих к образованию огромного числа органических веществ, как весьма простых (например, метан, муравьиная, щавелевая кислоты и т. п.), так и самых сложных (например, алкалоиды, стероиды, белки).
Характерной чертой органического синтеза у растений является накопление потенциальной химической энергии путем превращения в нее энергии солнечных лучей. С помощью хлорофилла на свету растения синтезируют сложнейшие органические соединения из самых простых химических веществ, в конечном счете, из двуокиси углерода, улавливаемой из воздуха, из воды и из минеральных солей, находящихся в почве. По всей вероятности, первичными продуктами фотосинтеза являются углеводы, которые в дальнейшем превращаются в жиры и белковые вещества растительных организмов. Фотосинтез у растений сопровождается выделением кислорода, который, как теперь точно установлено, образуется не из двуокиси углерода, а из воды. Таким образом, путем фотосинтеза в растениях происходит накопление сложных органических веществ. Естественно, что растения в большей мере, чем животные, служат первоисточником получения органических веществ.
Особенно богатым источником органических веществ являются древесные растения.
Наиболее давно известны термические методы переработки древесины, приводящие к разрушению содержащихся в ней сложных органических веществ с образованием более простых соединений.
1. Теоретические основы процесса высокотемпературной конверсии углеводородов
Химическое производство основано на использовании в качестве сырья доступных, относительно дешевых, широко распространенных или возобновляющихся материалов. Наиболее важными природными источниками углеводородов являются природный и попутный нефтяной газы, нефть и каменный уголь. Особое внимание в последнее время также уделяется использованию отходов сельскохозяйственного производства, вторичной переработке промышленных и бытовых отходов.
1. Состав природного и попутного нефтяного газов
Запасы природного газа на нашей планете велики. Природный газ представляет собой смесь газов, состав которой в значительной мере определяется месторождением. Однако в любом случае основным компонентом является метан, объемная доля которого колеблется от 70 до 98%. Остальные компоненты – это этан, пропан, бутан, изобутан, неорганические газы (азот, углекислый и благородный газы). Чем больше относительная молекулярная масса углеводорода, тем меньше его содержание в природном газе.
Попутный нефтяной газ растворен в нефти или находится над ней, образуя своеобразную «газовую шапку». В процессе добычи нефти его отделяют и используют в качестве топлива или химического сырья. В попутном газе содержится значительно меньше метана и больше его гомологов, чем в природном газе.
Для практических целей попутный газ разделяют на фракции: газовый бензин (смесь пентана, гексана и других алканов), пропан-бутановая фракция (смесь пропана и бутана) и сухой газ (сходен по составу с природным).
В органическом синтезе применяют как чистый оксид углерода, так и его смеси с водородом (синтез – газ) в объемном отношении от 1:1 до 2 – 2,3:1. Оксид углерода СО представляет собой бесцветный трудно сжижаемый газ ( температура конденсации при атмосферном давлении – 1920С, критическое давление 3,43 МПа, критическая температура – 1300С). С воздухом образует взрывоопасные смеси в пределах концентраций 12,5 – 74 % (об.). Оксид углерода является весьма токсичным веществом, его предельно допустимая концентрация (ПДК) в производственных помещениях составляет 20 мг/м3. Обычные противогазы его не адсорбируют, поэтому применяют противогазы изолирующего типа или имеющие специальный гопкалитовый патрон, в котором находятся оксиды марганца, катализирующие окисление СО и СО2. Оксид углерода слабо сорбируется не только твердыми телами, но и жидкостями, в которых он мало растворим. Однако некоторые соли образуют с ним комплексы, что используют для сорбции оксида углерода водно-аммиачными растворами солей одновалентной смеси.
Водород – второй компонент синтез – газа – наиболее трудно сжижаемый газ (температура конденсации при атмосферном давлении – 252,80С). Образует с воздухом взрывоопасные смеси в пределах 4,0 – 75 % (об.) Н2. Наряду с высокой взрывоопасностью оксида углерода это предъявляет повышенные требования к технике безопасности при производстве синтез-газа, а также в цехах, где он служит сырьем для органического синтеза.
Для производства синтез-газа вначале использовали уголь. Затем преобладающее значение получила конверсия углеводородов, которую осуществляют в двух вариантах: каталитическом и высокотемпературном. Сырьем для нее может служить метан или природный газ, а также жидкие фракции нефти.
При сгорании предельных углеводородов выделяется большое количество тепла, поэтому природный газ является самым эффективным и дешевым топливом для теплоэлектростанций, котельных установок, доменных и стекловаренных печей. Кроме того, при сгорании метана воздух практически не загрязняется вредными веществами.
Метан природного и попутного нефтяного газов является важным сырьем для химической промышленности. Конверсией метана получают синтез-газ, а на его основе – метанол и синтетический бензин:
СН4 + Н2О 
СО + 2Н2 
nСО + (2n + 1)Н2 
Из метана получают ацетилен, водород, сажу, галогенопроизводные:
2СН4 
СН4 
СН4 + CI2 
Гомологи метана, содержащиеся в природном и, главным образом, в попутном нефтяном газах, после разделения на индивидуальные углеводороды идут на получение алкенов и далее полимеров. Пропан-бутановая фракция в сжиженном виде используется как бытовое топливо и топливо для карбюраторных двигателей автомобилей. Газовый бензин, получаемый из попутного газа, также является основой низкосортных бензинов.
2. Аппаратурное оформление процесса высокотемпературной конверсии углеводородов
Высокотемпературная конверсия углеводородов отличается высокой температурой (1350 – 14500С) и отсутствием катализаторов. Процесс состоит в неполном термическом окислении метана или жидких фракций нефти, причем главной первичной реакцией в случае СН4 является окисление его в смесь СО, Н2О и Н2:
СН4 + О2 → СО + Н2О + Н2
В небольшом количестве образуются также СО2 и за счет реакций пиролиза углеводороды С3 и С2, в том числе ацетилен. В заключительной стадии процесса водяной пар консервирует оставшиеся углеводороды до СО и Н2, причем устанавливается равновесие между оксидами углерода, которое при высокой температуре сильно смещено в пользу СО. Видимо, при разложении ацетилена выделяется углерод (сажа), также способный к конверсии водяным паром (С + Н2О ↔ СО + Н2). Выход сажи особенно значителен при высокотемпературной конверсии жидких углеводородов, и для его снижения в этом случае добавляют к исходному сырью водяной пар. Суммарные уравнения реакций при высокотемпературной конверсии метана и жидких углеводородов таковы:
СН4 + 0,5О2 → СО + 2Н2
CnH2n+2 + 0,5nO2 → nCO + (n+1)H2
Следовательно, соотношение Н2 и СО в зависимости от исходного сырья может меняться от 2:1 до 1:1. Кроме того, в газе находятся 2 – 3 % (об.) СО2, 0,3 – 0,5 % (об.) СН4 и до 1 % (об.) N2 и Ar.
Высокотемпературную конверсию углеводородов проводят при давлении от 2 – 3 до 10 – 14 МПа.
Конвертор для этого процесса подобен изображенному на рис. 1, за исключением того, что в нем нет ни катализатора, ни свода, на который его укладывают.
Рис. 1 Шахтная печь окислительной конверсии
Это – пустотелый аппарат, рассчитанный на высокое давление. Конвертор имеет внутреннюю изоляцию и водяную рубашку, предохраняющую корпус от действия высоких температур, а также смеситель углеводорода и кислорода, обеспечивающий быструю гомогенизацию смеси во взрывобезопасных условиях. Достоинствами процесса являются его высокая интенсивность, простота конструкции конвертора, отсутствие катализатора и нетребовательность к качеству исходного сырья. Это обуславливает все более широкое распространение высокотемпературной конверсии особенно для жидких углеводородов (вплоть до мазута и сырой нефти), которую оформляют в виде энерготехнологических схем с агрегатами большой единичной мощности.
3. Технология процесса высокотемпературной конверсии углеводородов
Технологическая схема высокотемпературной конверсии мазута представлена на рис. 2.
Мазут под давлением 2 – 4 МПа подогревается до 500 – 8000С в блоке 1 рекуперации тепла горячих газов конверсии. Этот блок состоит из теплообменников и котла-утилизатора.
Подогретый мазут вводят через форсунки в смеситель конвертора 2, куда подают смесь кислорода с водяным паром. В рубашке конвертора, необходимой для охлаждения его корпуса, генерируется пар того же давления, при котором проводится конверсия. Горячие газы конверсии поступают в блок 1 рекуперации тепла. Затем из газов выделяют сажу, для чего большей частью промывают их циркулирующей водой в скруббере 3. Вода с сажей стекает в отстойник 4, куда добавляют легкую нефтяную фракцию, способную к коагуляции и извлечению сажи из водного слоя. Углеводородную суспензию сажи используют по-разному: отфильтровывают и сжигают, возвращая нефтяную фракцию на извлечение сажи, а в других случаях направляют в виде суспензии в мазуте на конверсию. Загрязненную воду из отстойника 4 возвращают на улавливание сажи в скруббер 3.
После отделения сажи газ направляют на очистку от H2S и CO2. Нередко требуется изменить соотношение H2:CO в газе в пользу водорода. Для этого служит блок конверсии оксида углерода: газ подогревают в теплообменнике 5 до 4000С, добавляют соответствующее количество пара высокого давления высокого давления и направляют смесь в конвертор, где на сплошном слое катализатора (оксиды железа, хрома и магния) происходит частичная конверсия оксида углерода (СО + Н2О ↔ СО2). Полученный синтез-газ с требуемым соотношением Н2:СО отдает тепло поступающему на конверсию газу в теплообменнике 5, очищается от СО2 в блоке 7 и направляется потребителю.
На получение 1000 м3 смеси СО + Н2 расходуется 250 кг мазута (или 380 м3 природного газа), 250 – 270 м3 кислорода и 60 кг водяного пара. При этом в котле-утилизаторе вырабатывается 850 – 900 кг пара высокого давления.
Рис. 2. Технологическая схема высокотемпературной конверсии мазута
1. Блок рекуперации тепла, 2. Конвертор, 3. Скруббер-сажеуловитель, 4. Отстойник, 5. Теплообменник, 6. Конвертор оксида углерода, 7. Блок очистки от диоксида углерода, 8. Холодильник
1. , Остроумов . М., Дрофа, 2008;
2. Чичибабин начала органической химии. М., Госхимиздат, 1963. – 922 с.;
3. Лебедев и технология основного органического и нефтехимического синтеза. М., Химия. 1988. – 592 с.;
4. , , Вишнякова нефтехимического синтеза. М., 1973. – 448 с.;
5. Юкельсон основного органического синтеза. М., «Химия», 1968.
Технология получения синтез-газа паровой конверсией углеводородов
Авторы: С.В. Афанасьев (Тольяттинский государственный университет), О.С. Рощенко (ОАО «Тольяттиазот»), С.П. Сергеев (ОАО «ГИАП»).
Опубликовано в журнале Химическая техника №6/2016
Cинтез-газ является смесью водорода и оксида углерода и широко используется в химической промышленности для получения базовых продуктов – аммиака, метанола, уксусной кислоты и др. Кроме того, он применяется в качестве экологически чистого источника тепловой энергии.
Сегодня существуют три основных метода производства синтез-газа. 1. Газификация угля. Данный процесс основан на взаимодействии каменного угля с водяным паром и протекает по формуле
Приведенная реакция является эндотермической, и равновесие при температуре 900…1000°С сдвигается вправо. Разработаны различные технологические процессы, использующие парокислородное дутье, благодаря которому наряду с упомянутой реакцией параллельно протекает экзотермический процесс сгорания угля, который обеспечивает необходимый тепловой баланс. 2. Конверсия метана – взаимодействие водяного пара и метана при повышенных значениях температуры и давлении в присутствии никелевых катализаторов (Ni–Al2O3):
CH4 + H2O → CO + 3H2.
Вместо метана можно использовать любое сырье, содержащее углеводороды. 3. Парциальное окисление углеводородов. Данный процесс, происходящий при температурах выше 1300°С, заключается в термическом окислении углеводородов:
CnH2n +2 + 1/2nO2 → nCO + (n + 1)H2.
Настоящее исследование посвящено усовершенствованию промышленного способа получения синтез-газа, обогащенного водородом и монооксидом углерода, путем каталитического риформинга углеводородсодержащего сырья в трубчатых реакторах с использованием катализаторов определенной конструктивной формы с целью внедрения на крупнотоннажных производствах аммиака, метанола, уксусной кислоты и водорода.
При осуществлении указанного процесса реализуются следующие эндои экзотермические реакции:
СnHm + nH2O → nCO + (n + m/2)H2 (–ΔHо 298 Способ осуществления парового риформинга
%
Как видно, по сравнению с известным методом наблюдается снижение содержания метана в вырабатываемом синтез-газе, что указывает на повышение активности катализатора.
Согласно выполненным кинетическим и теплофизическим расчетам, установка в печи риформинга реакционных труб с уменьшенным внутренним диаметром (101 мм) позволит снизить температуру конвертированного газа и содержание остаточного метана, существенно повысить производительность установки по синтезгазу (табл. 2).
Параметры работы печи риформинга с реакционными трубами разного диаметра
| Производительность, т/сутки | 1950…2000 | 1750…1800 | 1440 | 1440 (база) |
| Внутренний диаметр трубы, мм | 101 | 101 | 102 | 89 |
| Температура конвертированного газа, °С: | ||||
| в центре трубы | 718,5 | 721,1 | 732,1 | 732,9 |
| у стенки | 743,5 | 745,8 | 755,6 | 752,4 |
| Линейная скорость, м/с: | ||||
| в центре трубы | 2,233 | 2,084 | 1,996 | 2,536 |
| у стенки | 2,288 | 2,126 | 2,002 | 2,549 |
| Содержание метана в сухом газе на выходе из трубы, мол. % | 13,2557 | 12,1942 | 11,7262 | 12,6346 |
| Соотношение пар : газ на выходе из реакционной трубы | 0,8831 | 0,8533 | 0,8009 | 0.8260 |
Выводы
Использование предлагаемого технического решения позволяет улучшить теплоперенос через стенку труб в печи риформинга и как результат снизить разность температур между их наружной поверхностью и выходящим синтез-газом. Одновременно с этим удается уменьшить перепад давления по катализаторному слою, сократить расход топливного газа на проведение конверсии, увеличить выработку синтез-газа на агрегатах аммиака.
Конверсия монооксида углерода (СО).
Лекция 3.
В результате конверсии метана различными окислителями получается газовая смесь, содержащая оксид углерода (II). Дальнейшей стадией является конверсия оксида углерода (II) водяным паром.

Константа равновесия данной реакции описывается уравнением:
где Р – парциальное давление, С – концентрация.
Если выразить парциальные давления через равновесную степень превращения и начальные концентрации участников реакции, получится уравнение:
где 


Зависимость константы равновесия от температуры имеет следующий вид:
Согласно принципу Ле-Шателье выходу водорода способствует применение пониженных температур. Давление не оказывает влияние на термодинамическое равновесие. Степень конверсии СО можно повысить за счет увеличения содержания пара в исходной газовой смеси.
В промышленности конверсию СО проводят в две стадии.
Реакция протекает с достаточной скоростью только в присутствии катализатора.
На ускорение процесса влияют оксиды железа, хрома, кобальта, никеля.
Кинетический анализ процесса конверсии монооксида углерода.
При низких температурах процесс конверсии монооксида углерода водяным паром протекает с минимальной скоростью. В условиях действующего производства процесс проводят в присутствии катализаторов.
Характеристика катализаторов конверсии монооксида углерода.
В зависимости от рабочей температуры, применяемые катализаторы подразделяются на:
Среднетемпературный — это железохромовый катализатор. Его готовят смешением оксида или гидроксида железа с хромовым ангидридом.
Промышленность выпускает катализатор СТК следующих марок: СТК-1-5; СТК-1-7; СТК-2-5; СТК-1М (модернизированный). Первая цифра в маркеровке указывает на способ изготовления катализатора: «1» – экструдированный, полученный смешением Fe2O3 и Cr2О3 .Выпускается в виде цилиндров размером 5х10 мм (первая цифра указывает на диаметр катализатора (мм), вторая – высота цилиндра). «2» – это таблетированный катализатор, полученный смешением Cr2O3 и Fe(OH)2.. «М» – катализатор модернизированный.
Свежеприготовленный катализатор в своем составе содержит Fe2O3. Активным компонентом катализатора является Fe3O. Для перевода катализатора в активную форму проводят его восстановление генераторным газом (СО+Н2).
Процесс восстановления включает несколько стадий (этапов):
1. Нагрев катализатора до температуры 170°С со скоростью 30-40°С/ч., при давлении близком к атмосферному. Теплоноситель — сухой азот, дымовые газы.
2. Подъем температуры до 240-280°С за счет тепла водяного пара или газа, содержащего пар. Давление — рабочее.
3. Восстановление катализатора рабочим газом при температуре 300-320°С. Не допускается повышение температуры до 500°С, т.к. при этой температуре происходит снижение активности катализатора, а в интервале 550-600°С катализатор полностью теряет свою активность.
При проведении восстановления обращают внимание на присутствие в газе водяного пара.При его отсутствии возможны следующие нежелательные химические процессы:
1. Крекинг монооксида углерода:
Образующийся углерод снижает активность катализатора.
2. Перевосстановление катализатора:
Появление металлического железа недопустимо, так как протекает побочная реакция гидрирования монооксида углерода:
Ядами для катализатора СТК являются: сероводород, сероорганические соединения, а также соединения фосфора, хлора, кремния (после умягчения воды). Активность катализатора снижается в присутствии пыли, сажи.
На второй ступени конверсии монооксида углерода применяют низкотемпературный катализатор следующих марок: НТК-4; НТК-8; ПКК-2.
Низкотемпературный катализатор НТК – цинкхроммедный, интервал работы которого находится в пределах 170-250 0 С; химический состав катализатора: (%масс.): 15,4 ZnO; 50 CuO; 12,6 Cr2O3; 21,6 Al2O3.
Процесс восстановления катализатора проводят в четыре этапа.
1.Разогрев катализатора до 200°С циркулирующим азотом. Скорость нагрева 30-40°/ч.
2. Начальный этап восстановления, за счет введения азото-водородной смеси. Концентрация водорода в газе-восстановителе не более 3%, температура не выше 230°С.
3. Восстановление катализатора во всем объеме при 230°С.Содержание водорода в газе достигает 1-1,2%. Процесс восстановления сопровождается выделением значительного количества тепла, поэтому для поддержания температуры в заданном интервале в газ-восстановитель вводят азот. Продолжительность процесса составляет 3-4 часа.
4. Выдержка катализатора в среде водорода в течение 3-4час. с последующим увеличением содержания водорода до 10-20%. Продолжительность этой операции 3-4 час.
Контактными ядами для катализатора являются соединения серы, хлора, фосфора, кремния, причем соединения хлора, серы отравляют катализатор необратимо.
Катализаторы СТК, НТК являются пирофорными (самовозгорающиеся). Поэтому перед выгрузкой катализатора из аппарата его предварительно охлаждают паром до определенной температуры, а затем окисляют. Этот процесс сопровождается выделением тепла.Для снижения теплового эффекта процесс восстановления проводят смесью пара и азота.Содержание кислорода в азоте должно быть: для катализатора СТК в пределах 1-2% и не более 0,1% для НТК.
Механизм конверсии монооксида углерода.
Механизм данного процесса исследовали многие ученые. В результате исследований было предложено несколько гипотез.
Темкин и Кулькова считают, что механизм процесса конверсии СО водяным паром является окислительно-восстановительным:
Так как процесс конверсии проводят при избытке водяного пара, то лимитирующей является стадия (2). Водород оказывает отрицательное влияние на реакцию конверсии.
Кириллов И. П. с сотрудниками, в результате исследований показали, что лимитирующей стадией данного процесса является окисление поверхности катализатора (1). Выделяющийся водород замедляет данный процесс, который протекает в кинетической области.
Применительно к катализаторам СТК и НТК можно использовать следующее кинетическое уравнение:
Для НТК (Т = 100-300 °С): 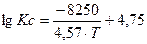

Для СТК (Т = 300-600 °С): 

Обоснование оптимальных условий процесса конверсии монооксида углерода водяным паром.
Результаты термодинамического анализа реакции конверсии монооксида углерода водяным паром показали, что процесс желательно проводить при более низких температурах. Однако в этих условиях процесс конверсии протекает с минимальной скоростью. На практике оптимальная температура определяется температурным интервалом работы катализатора. При использовании среднетемпературного катализатора не целесообразно проводить процесс в одну стадию, так как выделяется большое количество тепла и выход водорода, целевого продукта, уменьшается. Если подавать газ с низкой температурой, то не эффективно используются первые по ходу газа слои катализатора, что отрицательно влияет на скорость конверсии СО.
Рассматриваемая реакция, относится к числу процессов с неблагоприятным положением равновесия и в промышленных условиях ее осуществляют, используя линию оптимальных температур (ЛОТ). На начальном этапе конверсию проводят при максимально возможной температуре. Но эта температура, с учетом экзотермичности процесса, не должна превышать верхний температурный интервал работы катализатора. Обеспечив высокую скорость реакции, на последующих этапах доконверсию проводят при более низких температурах. Для отвода тепла химической реакции используют следующие приемы:
— байпасирование (ввод свежего газа);
— введение реагента, способного аккумулировать тепло химической реакции (например, введение конденсата).
При использовании низкотемпературного катализатора конверсию монооксида углерода проводят в одну ступень.
Согласно термодинамическому анализу, повышение давления не оказывает влияния на равновесие реакции, но существенно увеличивает скорость химического процесса. В этих условиях:
— улучшается тепловой баланс установки;
— снижаются удельные капитальные затраты;
— снижается расход электрической энергии на дальнейшее сжатие азото-водородной смеси.
Однако наряду с положительным влиянием давления на процесс конверсии, необходимо учитывать следующие отрицательные факторы:
— пожаро- и взрывоопасность процесса;
— усиление водородной коррозии конструкционных материалов;
— загрязнение конвертированного газа продуктами побочных реакций;
— сложности обслуживания процесса.
Оптимальное давление зависит от выбранной схемы конверсии и находится в пределах 20-40 атм.
3.Скорость подачи парогазовой смеси.
Процесс конверсии протекает в кинетической области. Поэтому увеличение скорости подачи парогазовой смеси не приводит к увеличению скорости реакции. Желательно, чтобы скорость подачи парогазовой смеси соответствовала скорости химической реакции.
В условиях действующего производства этот параметр находится в пределах 2000-3000 час -1 .
4. Требования, предъявляемые к составу исходной газовой смеси.
Для увеличения скорости процесса и получения высокого выхода водорода целесообразно использовать избыток водяного пара, который должен обеспечить:
— максимальную степень конверсии монооксида углерода;
— предотвратить крекинг монооксида углерода по реакции: 2СО = С + СО2
— исходная смесь не должна содержать контактных ядов.
Технологическая схема конверсии моноокисда углерода паром.
На рисунке 1 представлена принципиальная технологическая схема двухступенчатой конверсии СО.
 | Рис. 1. принципиальная технологическая схема двухступенчатой конверсии СО: 1 – увлажнитель, 2 – конвертор 1-ой ступени, 3 – котел-утилизатор, 4 – подогреватель газа, 5 – конвертор 2-ой ступени. |
Поступающий в конвертор 1-ой ступени газ имеет примерно следующий состав: 57% Н2, 22-23% N2, 12-12,5% СО, 7,5-8% СО2, 0,25% Ar, 0,35% СН4. Соотношение пар:газ составляет (0,57-0,66):1. Небольшое донасыщение газа паром производится в увлажнителе (1) за счет впрыска конденсата. В конверторе 1-ой (2) ступени процесс проводят железохромовом катализаторе при объемной скорости 200-3000 ч -1 и температуре на входе 320-380°С. При прохождении через катализатор температура повышается до 400-450°С. Из конвертора газ поступает в котел-утилизатор (3), где его тепло используется для получения пара. После смесь поступает в газовый теплообменник (4), где осуществляется нагрев газа, поступающего на метанирование. Парогазовая смесь при этом охлаждается до 210-220°С и направляется в конвертор второй ступени (5). Газ на входе в конвертор 2-ой ступени имеет примерно следующий состав: 57-61% Н2, 20,5-21% N2, 2,5-4% СО, 15-17% СО2, 0,23% Ar, 0,35% СН4. На низкотемпературном катализаторе при температуре 210-250°С и объемной скорости 2000-3000 ч-1 происходит конверсия СО до остаточного содержания 0,2-0,55%. Температура на входе газа во 2-ую ступень регулируется путем байпасирования части газа мимо котла-утилизатора. Можно так же проводить регулирование температуры за счет впрыска конденсата в газ перед конвертором. После конверсии монооксида углерода 2-ой ступени конвертированный газ с температурой 240-275°С проходит охладитель, где охлаждается до 180°С и поступает на стадию моноэтанольной очистки.
Для проведения конверсии монооксида углерода применяют аппараты двух типов – с аксиальным и радиальным ходом газа. В аксиальных реакторах парогазовая смесь проходит параллельно оси аппарата через слой катализатора толщиной 3-5 м со скоростью 0,25-0,5 м/с. В радиальных конверторах парогазовая смесь проходит через слой катализатора толщиной 1-1,3 м со скоростью 0,03-0,1 м/с перпендикулярно оси аппарата.
На рисунках 2-3 представлены конструкции аксиальных аппаратов, применяемые для конверсии СО (рис. 2 – полочный реактор, рис. 3 – шахтный реактор).
 | Рис. 2. Полочный конвертор оксида углерода (II): 1 – входной штуцер, 2 – катализатор, 3 – решетка, 4 – выходной штуцер, 5 – разгрузочный люк, 6 – загрузочный люк. В аппаратах данного типа катализатор располагают слоями на полках, размещенных в цилиндрическом корпусе. Полки могут работать по газу как последовательно, так и параллельно. В аппарате укладывают колосниковую решетку, покрываемую металлической сеткой. Поверх сетки насыпают слой керамической или металлической насадки, затем загружают катализатор. Сверху опять укладывают сетку с насадкой. |
 | Рис. 3. Шахтный конвертор оксида углерода (II): 1 – входной штуцер, 2 – термопарный карман, 3 – металлические сетки, 4 – разгрузочный люк, 5 – выходной штуцер, 6 – керамическая насадка, 7 – катализатор, 8 – металлическая насадка, 9 – загрузочный люк. Аппараты данного типа являются разновидностью полочных аппаратов. Катализатор в них располагается в один слой, в нижней части аппарата уложены керамические, мулитовые или корундовые шары. На слой шаров укладывается металлическая сетка, а затем катализатор. Шарами заполняются так же патрубки для выгрузки катализатора. На выходном патрубке устанавливают сетку, поверхность катализатора делают ровной, на нее укладывают металлическую сетку, а затем слой колец Рашига и прижимают решетку. Снаружи аппарат имеет теплоизоляционный слой. |
На рисунке 4 представлена конструкция радиального конвертора СО.
http://chemtech.ru/tehnologija-poluchenija-sintez-gaza-parovoj-konversiej-uglevodorodov/
http://poisk-ru.ru/s42661t6.html








