Формулы для расчета газовых смесей
САМАРСКИЙ ГОСУДАРСТВЕННЫЙ
ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ТЕПЛОВЫХ И ГИДРАВЛИЧЕСКИХ ПРОЦЕССОВ В ТЕХНИКЕ
Методические указания к курсовой работе
по дисциплине «Математическое моделирование энергетических процессов и систем»
Курсовая работа выполняется в соответствии с выданным заданием и включает в себя расчетную и графические части.
Расчетная часть состоит из трех разделов:
1. Математическое моделирование процессов теплообмена в газовоздушном подогревателе.
2. Математическое моделирование процессов теплообмена в двигателях внутреннего сгорания.
3. Математическое моделирование тепловых и гидравлических процессов в теплообменных аппаратах.
Графическая часть работы содержит изображение цикла двигателя внутреннего сгорания (ДВС) в р-v и T-s диаграммах, изображение водо-водяного подогревателя и графика изменения температур теплоносителей по длине подогревателя.
Характерные точки циклов наносятся в соответствии с результатами расчетов в выбранном масштабе.
Математическое моделирование процессов теплообмена в газовоздушном подогревателе
Для выполнения первого раздела задания необходимо изучить следующие вопросы: параметры состояния рабочего тела, газовые смеси, теплоемкость газов.
Под газовыми смесями понимают механическую смесь нескольких газов, химически между собой не взаимодействующих. Состав газовой смеси определяется количеством каждого из газов, входящих в смесь, и может быть задан массовыми mi или объемными ri долями:
где Mi – масса i-го компонента, Vi – объем i-го компонента, а M и V – масса и объем всей смеси соответственно.
Для удобства решения практических задач со смесями газов введено понятие о кажущейся молекулярной массе смеси газов, которая представляет собой среднюю массу из действительных молекулярных масс отдельных компонентов смеси.
Уравнение состояния смеси газов имеет вид:
На смеси газов распространяется понятие универсальной газовой постоянной
Связь между давлением газовой смеси р и парциальным давлением отдельных компонентов рi, входящих в смесь, устанавливается законом Дальтона:

Если заданы состав газовой смеси, а также характеристики составляющих смесь газов, то можно рассчитать необходимые характеристики смеси по приводимым в таблице 1 формулам.
Формулы для расчета газовых смесей
| Задание состава смеси | Перевод из одного состава в другой | Удельный объем и плотность смеси | Кажущаяся молекуляр-ная масса смеси | Газовая постоян-ная смеси | Парциаль-ное давление |
| Мас-совыми долями |  |   |  |  |  |
| Объем-ными долями |  |   |  |  |  |
В таблице 1: mi – молекулярная масса i-го компонента; 8314 Дж/(кмоль×К) – значение универсальной газовой постоянной; Ri – газовая постоянная i-го компонента.
Для вычисления количества теплоты полученного или отданного газом в процессе его энергетического взаимодействия с окружающей средой введено понятие теплоемкости. Под удельной теплоемкостью понимают количество теплоты, которое необходимо сообщить телу, чтобы повысить температуру какой-либо его количественной единицы на 1 0 С (К). В зависимости от выбранной количественной единицы различают теплоемкости:
мольную mс, кДж/(кмоль×К);
объемную с / , кДж/(м 3 × К). (1.7)
Эти теплоемкости связаны между собой следующими соотношениями:
где rн – плотность газа при нормальных условиях.
1 м 3 газа имеет различную массу в зависимости от давления и температуры. В связи с этим объемную теплоемкость всегда относят к массе газа, заключенной в 1 м 3 при нормальных условиях (ρн = 101325 Па, Тн = 273 К). При этом объем 1 кмоля различных газов равен 22,4 м 3 /кмоль, а универсальная газовая постоянная — mR = 8314 Дж/(кмоль×К). В зависимости от способа подвода тепла к газу (р = const или V = const) различают изобарную ср и изохорную сv теплоемкости. Отношение этих величин носит название показателя адиабаты
Теплоемкости ср и сv связаны также соотношением Майера
Теплоемкость газов меняется с изменением температуры, причем эта зависимость имеет криволинейный характер. Значения истинных и средних теплоемкостей в интервале от 0 0 до t берутся непосредственно из таблиц, причем в необходимых случаях производится интерполяция. Количество теплоты, которое необходимо затратить в процессе нагревания 1 кг газа в интервале температур от t1 до t2:

Если в процессе участвуют М (кг) или Vн (м 3 ) газа, то:
Теплоемкость газовой смеси следует определять по формулам:
массовая — 
объемная — 
мольная — 
Теплотехника. Лабораторные работы «Техническая термодинамика»
в начало
Задание № 1. Газовые смеси и теплоемкости (Параметры состояния. Уравнение состояния.)
Условие
Таблица с вариантами
Задание №2. Термодинамические процессы идеальных газов (Первый закон термодинамики)
Условие
Таблица с вариантами
Задание № 3. Максимальная работа. Эксергия. (Второй закон термодинамики)
Условие
Таблица с вариантами
Задание №4 «Циклы энергетических установок»
Условие
Таблица с вариантами
Задание №5 «Истечение газов из сопла Лаваля»
Условие
Таблица с вариантами
Задание «Термодинамический анализ процессов в компрессорах»
Условие
Таблица с вариантами
Справочные таблицы
Газовые смеси и теплоемкости (Параметры состояния. Уравнение состояния.) Газовая смесь задана следующим образом: в вариантах с № 1 по 15 в объемных долях ri, с № 16 по 30 в массовых gi долях, процентным составом компонентов смеси (графа 1); давление смеси pсм = …[бар] (графа 2), объем смеси Vсм = …[м3] (графа 3), температура смеси tсм=100C (Tсм=373 K).
— состав смеси (если состав смеси задан в объемных долях, то представить его в массовых долях, если состав смеси задан в массовых долях, то представить его в объемных долях);
— газовые постоянные компонентов и смеси , [кДж/(кг•К)].
— среднюю молярную массу смеси, , [кг/кмоль], выраженную через объемные и массовые доли;
— парциальные давления компонентов pi, выраженные через объемные ri и массовые gi доли;
— массу смеси mсм, [кг] и ее компонентов mi, [кг]; — парциальные объемы Vi, [м3] и плотности ρi, [кг/м3] компонентов и смеси ρсм, [кг/м3];
— истинную молярную , [кДж/(кмоль•К)], объемную , [кДж/(м3•К)] и массовую , [кДж/(кг•К)] теплоемкости для , при температуре смеси t, [C] (графа 4).
— среднюю молярную , [кДж/(кмоль•К)], объемную , [кДж/(м3•К)] и массовую , [кДж/(кг•К)] теплоемкости интервала температур t1–t2, [C] (графа 5).
— количество теплоты Q, [кДж], необходимое для нагрева (охлаждения) , на интервале температур t1–t2, [C] (графа 5) при для случаев, когда количество вещества смеси задано как: 2 моль, 5 м3, 7 кг.
Варианты заданий приведены в таблице 1.
Таблица с заменой воздуха на двуокись серы.
Газ, массой m=…[кг], при начальном давлении p1=…[МПа] и начальной температуре, расширяется по политропе до конечного давления p2=…[МПа] и конечной температуры t2=…[°C]. Определить начальный и конечный объемы, показатель политропы, работу расширения, изменение внутренней энергии, количество подведенной теплоты, и изменение энтропии.
Варианты заданий приведены в таблице 2.
воздух
Определить эксергетический КПД котельной установки, ессли известно, что температура продуктов сгорания в топке равна t1=…[°C], а теплотворная способность топочного мазута Q=…[кДж/кг]. В котельной установке вырабатывается пар с температурой t2=…[°C]. Температура окружающей среды t0=…[°C].
Варианты заданий приведены в таблице 3.
При расчете газового цикла считается, что рабочее тело — 1 кг воздуха, для которого
известны следующие термодинамические параметры:
Cp = 1,005 кДж/кг*град
Cм = 0,71 кДж/кг*град
| № | Т1, | Р1, | Характеристики цикла | Цикл | |||||
| п/п | °К | кПа | n1 | n2 | ε | λ | ρ | π | |
| Вариант 1 | 273 | 100 | 1,4 | 1,35 | 5 | 4,6 | — | — | 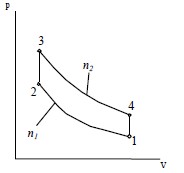 |
| Вариант 2 | 283 | 110 | 1,34 | 1,3 | 5,5 | 4,3 | — | — | |
| Вариант 3 | 303 | 120 | 1,3 | 1,23 | 6 | 4 | — | — | |
| Вариант 4 | 323 | 90 | 1,32 | 1,2 | 6,5 | 3,8 | — | — | |
| Вариант 5 | 343 | 130 | 1,36 | 1,25 | 7 | 3,4 | — | — | |
| Вариант 6 | 263 | 80 | 1,38 | 1,27 | 7,5 | 3 | — | — | |
| Вариант 7 | 263 | 80 | 1,4 | 1,36 | 10 | — | 2,2 | — | 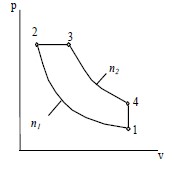 |
| Вариант 8 | 273 | 90 | 1,38 | 1,33 | 10,5 | — | 2,1 | — | |
| Вариант 9 | 283 | 100 | 1,36 | 1,3 | 11 | — | 2 | — | |
| Вариант 10 | 303 | 110 | 1,34 | 1,28 | 11,5 | — | 1,9 | — | |
| Вариант 11 | 323 | 120 | 1,32 | 1,25 | 12 | — | 1,8 | — | |
| Вариант 12 | 343 | 130 | 1,3 | 1,24 | 12,5 | — | 1,7 | — | |
| Вариант 13 | 263 | 85 | 1,3 | 1,25 | 14 | 1,4 | 2 | — |  |
| Вариант 14 | 273 | 90 | 1,32 | 1,28 | 15 | 1,5 | 1,9 | — | |
| Вариант 15 | 283 | 95 | 1,34 | 1,3 | 16 | 1,6 | 1,8 | — | |
| Вариант 16 | 308 | 100 | 1,36 | 1,32 | 17 | 1,7 | 1,7 | — | |
| Вариант 17 | 323 | 105 | 1,38 | 1,34 | 16 | 1,6 | 1,6 | — | |
| Вариант 18 | 343 | 110 | 1,4 | 1,36 | 19 | 1,5 | 1,5 | — | |
| Вариант 19 | 253 | 70 | 1,4 | 1,38 | — | — | 2 | 5 |  |
| Вариант 20 | 263 | 80 | 1,38 | 1,36 | — | — | 1,9 | 5,5 | |
| Вариант 21 | 273 | 90 | 1,36 | 1,34 | — | — | 1,8 | 6 | |
| Вариант 22 | 283 | 95 | 1,34 | 1,32 | — | — | 1,7 | 6,5 | |
| Вариант 23 | 293 | 100 | 1,32 | 1,3 | — | — | 1,6 | 7 | |
| Вариант 24 | 303 | 105 | 1,3 | 1,28 | — | — | 1,5 | 7,5 | |
| Вариант 25 | 253 | 70 | 1,4 | 1,38 | — | 1,4 | — | 7 | 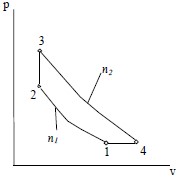 |
| Вариант 26 | 263 | 75 | 1,38 | 1,36 | — | 1,5 | — | 6,5 | |
| Вариант 27 | 273 | 80 | 1,36 | 1,34 | — | 1,6 | — | 6 | |
| Вариант 28 | 283 | 85 | 1,34 | 1,32 | — | 1,7 | — | 5,5 | |
| Вариант 29 | 293 | 90 | 1,32 | 1,3 | — | 1,8 | — | 5 | |
| Вариант 30 | 303 | 95 | 1,3 | 1,28 | — | 1,9 | — | 4,5 | |
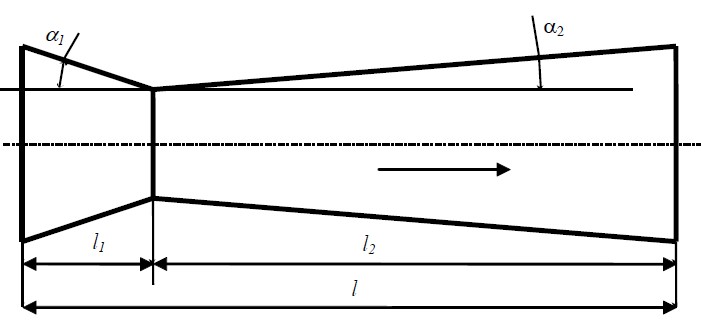
Чеpез сужающейся канал (кофузор), а затем через pасшиpяющейся канал (диффузор)
пpотекает газ.
Тpебуется опpеделить: геометричесие и теплофизичесиен паpаметpы на входе,
выходе и в кpитическом сечении сопла; кpитическую скоpость и скоpость истечения;
pассчитать pазмеpы сопла; и найти pасполагаемую pаботу газового потока.
Постpоить гpафики изменения v, P и T по длине сопла.
| п/п | Газ | Давление газа на входе, баp | Скорость течения, м/сек | Давление газа на выходе сопла, бар | Массовый расход газа, кг/ч | Угол конусности 1, град | Угол конусности 2, град | |
| Вариант1 | водух | 25 | 1800 | 150 | 2 | 2000 | 30 | 10 |
| Вариант2 | O2 | 24 | 1700 | 140 | 1,9 | 2100 | 31 | 9°30′ |
| Вариант3 | N2 | 23 | 1600 | 130 | 1,8 | 2200 | 32 | 9 |
| Вариант4 | CO2 | 22 | 1500 | 120 | 1,7 | 2300 | 33 | 8°30′ |
| Вариант5 | O2 | 21 | 1400 | 110 | 1,6 | 2400 | 34 | 8 |
| Вариант6 | водух | 20 | 1700 | 100 | 1,5 | 2500 | 35 | 7°30′ |
| Вариант7 | O2 | 19 | 1600 | 90 | 1,4 | 2600 | 36 | 7 |
| Вариант8 | N2 | 18 | 1500 | 80 | 1,3 | 2700 | 37 | 6°30′ |
| Вариант9 | CO2 | 17 | 1400 | 70 | 1,2 | 2800 | 38 | 6 |
| Вариант10 | CO | 16 | 1300 | 60 | 1,1 | 2900 | 39 | 5°30′ |
| Вариант11 | воздух | 15 | 1600 | 50 | 1 | 3000 | 40 | 5 |
| Вариант12 | O2 | 14 | 1500 | 40 | 0,9 | 3100 | 41 | 5°30′ |
| Вариант13 | N2 | 13 | 1400 | 50 | 0,8 | 3200 | 42 | 6 |
| Вариант14 | CO2 | 12 | 1300 | 60 | 0,7 | 3300 | 43 | 6°30′ |
| Вариант15 | CO | 11 | 1200 | 70 | 0,7 | 3400 | 44 | 7 |
| Вариант16 | воздух | 12 | 1750 | 80 | 0,8 | 3450 | 45 | 7°30′ |
| Вариант17 | O2 | 13 | 1650 | 90 | 0,9 | 3350 | 44 | 8 |
| Вариант18 | N2 | 14 | 1550 | 100 | 1 | 3250 | 43 | 8°30′ |
| Вариант19 | CO2 | 15 | 1450 | 110 | 1,1 | 3150 | 42 | 9 |
| Вариант20 | CO | 16 | 1350 | 120 | 1,2 | 3050 | 41 | 9°30′ |
| Вариант21 | воздух | 17 | 1650 | 130 | 1,3 | 2950 | 40 | 10 |
| Вариант22 | O2 | 18 | 1550 | 140 | 1,4 | 2850 | 39 | 9°30′ |
| Вариант23 | N2 | 19 | 1450 | 150 | 1,5 | 2750 | 38 | 8 |
| Вариант24 | CO2 | 20 | 1350 | 140 | 1,6 | 2650 | 37 | 7 |
| Вариант25 | CO | 21 | 1250 | 130 | 1,7 | 2550 | 36 | 6 |
| Вариант26 | воздух | 22 | 1900 | 120 | 1,8 | 2450 | 35 | 5 |
| Вариант27 | O2 | 23 | 1750 | 110 | 1,9 | 2350 | 34 | 6 |
| Вариант28 | N2 | 24 | 1650 | 100 | 2 | 2250 | 33 | 7 |
| Вариант29 | CO2 | 25 | 1550 | 90 | 2,1 | 2150 | 32 | 8 |
| Вариант30 | CO | 26 | 1450 | 80 | 2,2 | 2050 | 31 | 9 |
Определить теоретическую работу на привод одноступенчатого и трехступенчатого компресоров при сжатии воздуха до давления p2=…[МПа]. Начальное давление p1=…[МПа] и температура t1=…[°C]. Показатель политропы для всех ступеней n=…. Определить работу на 1 м 3 воздуха и температуру сжатия в одноступенчатом, трехступенчатом и четырех ступенчатом компрессорах. Оценить уменьшение затрат работы при переходе с от одноступенчатого к четырехступенчатому компрессору.
Вывод уравнений медленных течений смесей газов из уравнения Больцмана Текст научной статьи по специальности « Математика»
Аннотация научной статьи по математике, автор научной работы — Галкин В. С.
Метод Гильберта асимптотического решения уравнения Больцмана применен для вывода уравнений, описывающих медленные течения смесей одноатомных газов как сплошной среды (т. е. при числе Кнудсена Kn→0), в условиях, когда относительные перепады температуры и концентраций в потоке порядка единицы. Полученные результаты совпадают с результатами, следующими из соответствующего переразложения ряда Чепмена Энскога. Кратко рассматривается вопрос о граничных условиях.
Похожие темы научных работ по математике , автор научной работы — Галкин В. С.
Текст научной работы на тему «Вывод уравнений медленных течений смесей газов из уравнения Больцмана»
УЧЕНЫЕ ЗАПИСКИ Ц АГ И
Т о м V 1 97 4 М4
ВЫВОД УРАВНЕНИЙ МЕДЛЕННЫХ ТЕЧЕНИЙ СМЕСЕЙ ГАЗОВ ИЗ УРАВНЕНИЯ БОЛЬЦМАНА
Метод Гильберта асимптотического решения уравнения Больцмана применен для вывода уравнений, описывающих медленные течения смесей одноатомных газов как сплошной среды (т. е. при числе Кнудсена Кп -*■ 0), в условиях, когда относительные перепады температуры И концентраций в потоке порядка единицы. Полученные результаты совпадают с результатами, следующими из соответствующего переразложения ряда Чепмена — Энскога. Кратко рассматривается вопрос о граничных условиях.
1. Медленные течения газа как сплошной среды реализуются при числе Кп^М/Яе-^О, числе М^О и фиксированных значениях числа Ие и характерных перепадах температуры и концентраций. В силу последних условий уравнения Навье — Стокса здесь неприменимы, ибо в уравнении импульса необходимо учитывать температурные и концентрационные напряжения [1—3]. Этот вывод был получен из уравнений Барнетта, иначе говоря, путем переразложения результатов метода Чепмена — Энскога*.
Необходимость такого переразложения при рассмотрении конкретных классов течений и задачи кнудсеновского слоя вызвана тем, что отдельные приближения метода Чепмена—Энскога содержат внепорядковые по Кп члены. В то же время прямой метод решения уравнения Больцмана — метод Гильберта, позволяющий избежать появления таких членов, в своем первоначальном виде пригоден только для течений, близких к невязким (см., например, [5, 6]). Для применения этого метода к вязким-течениям необходимо учесть некоторую дополнительную информацию. Для случая М = 0 (1), Ие-> оо, когда реализуется концепция пограничного слоя, это проделано в работе [7]. Модифицированный метод Гильберта в основном — первом — приближении сразу же дает
* Выписанное в [3] выражение для концентрационных напряжений получено из уравнений кинетических моментов методом Максвелла. Уравнения Барнетта для смесей одноатомных газов выведены в [4] в первом приближении по полиномам Сонина для коэффициентов переноса, т. е. в том же приближении, что и в [3].
уравнения Прандтля, в следующем—уравнения пограничного слоя второго порядка. Важно отметить, что в работе [8], посвященной тому же вопросу, сделан ошибочный вывод о несправедливости уравнений пограничного слоя второго порядка.
В рассматриваемом в настоящей работе случае указанная дополнительная информация состоит в том, что среднемассовая скорость газа и — Кп, а характерное время £— Кп-1. Цель данной работы — демонстрация применения метода Гильберта с учетом этой информации и доказательство того, что получаемые с его помощью результаты совпадают с результатами соответствующего переразложения ряда Чепмена — Энскога. Предполагается, что отношения масс молекул тл\щ фиксированы, поэтому справедливо однотемпературное приближение (а, Р = 1, 2, , Ы, А^—число
2. При сформулированных условиях уравнения Больцмана в безразмерном виде запишем
где /(/а /р) — интеграл столкновений молекул сортов а и р. Приведение к безразмерному виду проведено для того, чтобы выявить порядок построения внешнего асимптотического разложения уравнения Больцмана.В дальнейшем будем пользоваться его размерной формой, не изменяя обозначений входящих в (2.1) величин. Для сокращения записи асимптотические степенные ряды по Кп будем
обозначать так: а а(г\ где а(г> = аг Кпг, аг не зависит от Кп.
Ищем указанное разложение в виде
где коэффициенты а«, Ь„ с не зависят от на частные решения этих интегральных уравнений /‘0)х1г). как обычно [5], накладываются условия „однозначности»: они не дают вкладов в и, парциальную численную плотность пл и температуру Т (или давление р = п!гТ, « = £«*), т. е. для г> 1
Кп3 + Кп 5в «»=/>«» (0- (2.8) Это является следствием того, что В / )], (2-ю)
где концентрация уа = па.1п, которое следует из уравнения для „навье-стоксовского“ приближения метода Чепмена — Энскога [5], если в нем отбросить величины О(Кп) и выше по сравнению с единицей. Условия однозначности также совпадают с приведенным в [5], поэтому можнй воспользоваться известным решением
Здесь коэффициенты Ла, с» ■) зависят от Т(0), я*’ и 1|- С помощью МОЖНО вычислить напряжения р^1), тепловые ПОТОКИ ФР и диффузионные скорости гК1», воспользовавшись соотношениями
Отсюда, используя (2.12), получим указанным выше способом уравнения для импульса и энергии
Н V («10) «(1) + А1’)=о, = рм (о,
Соотношения (2.13), (2.15) позволяют найти /Р> и, следовательно, рЩ, Этим можно было бы ограничиться, однако с целью получения уравнений, справедливых с погрешностью 0(Кп2) по сравнению с единицей, нужно рассмотреть третье приближение
Из этого соотношения имеем ди^Р
+ V (« образуют замкнутую систему уравнений асимптотически главного („первого») приближения. Решения (2.18) и уравнения для м(2>
Р и у , что можно сделать, не вычисляя / Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
где О* — левая часть уравнения (2.16), Д*— коэффициент перед слагаемым с градиентом скорости в функции распределения навье-стоксовского приближения метода Чепмена — Энскога, причем в этом коэффициенте отброшены члены 0(Кп)ивыше по сравнению с единицей. Отметим сразу, что в силу (2.20). не дает вклада
в ибо это слагаемое уравнения (2.16) является суммой скалярных
и линейных по \ членов, для которых интеграл в (2.20) равен нулю.
Как показано в п. 3, и у получаются путем переразложе-ния навье-стоксовских формул (в которых, конечно, пренебрегается •бародиффузией), напримео, ^2> = — Х(Л°))и7’(1> — М1>уЛ°>; р и
Рг7 получаются аналогичным переразложением формул [1—3], включающих как навье-стоксовские напряжения, так и те члены барнет-товского тензора напряжений, которые содержат вторые и произведения первых производных от Г и уа. Следовательно, складывая <2.14) и (2.17)—(2.19), получим систему уравнений [3], справедливую с погрешностью 0(Кп2) по сравнению с единицей. Подчеркнем, что в общем случае в Рц входят не только производные от Т и у„, но и слагаемые вида
3. Уравнения метода Гильберта менее удобны для решения, чем аналогичные уравнения метода Чепмена — Энскога. К тому же вряд ли имеет смысл находить их решение при наличии известных решений уравнений метода Чепмена — Энскога в „навье-стоксовском» и „барнеттовском“ приближениях и / , г
где Ия=1» и> как можно видеть, Кроме того, из урав-
нений 21 (Л°ЕАв) = о следует
Предположим, что четыре первых члена разложения (2.2), т. е.
и (1 + Ф^ + Ф(с2) + Ф(а3)), равны первым четырем членам пере-разложения отрезка ряда (3.1) с помощью (3.2). Тогда
й’=й¥, Ф1!)-й++г1х.т + хй+1», > ,34)
•Р-й-цвлУ+ев+ехв + вн-)®- I
Используя (3.4) и соотношения для определения ^ (например,
«1Г) == |/»0)ФаЫЪ), можно показать, что принятые в методе Чепмена—Энскога условия однозначности [5] переходят в условия (2.4). Сложим уравнения метода Чепмена — Энскога для /£Ц и /йг до№ , до/‘У */$ а/й
Применяя известные [9] правила исключения „производных» по входящих в (3.5), найдем
Следовательно, описывающие медленные течения смесей газов уравнения могут быть непосредственно получены из уравнений
Барнетта, как это было сделано в работах [1—3]. При этом q и у’а даются навье-стоксовскими формулами, а в pi> входят указанные выше барнеттовские слагаемые.
4. Чтобы найти граничные условия, нужно решить задачу кнудсеновского слоя, т. е. срастить внутреннее разложение с внешним /a = /i0)(l + Ф(а1) + Ф12)В Ф^ входят только первые производные от температуры и концентраций, поэтому в первом приближении по Кп задача сводится к известным задачам о скорости и Надоели баннеры? Вы всегда можете отключить рекламу.
http://reshebnik.su/node/10544
http://cyberleninka.ru/article/n/vyvod-uravneniy-medlennyh-techeniy-smesey-gazov-iz-uravneniya-boltsmana