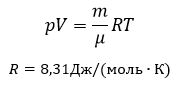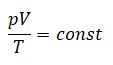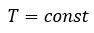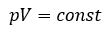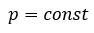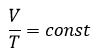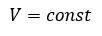Физика. 10 класс
Конспект урока
Физика, 10 класс
Урок 20. Уравнение состояния идеального газа. Газовые законы
Перечень вопросов, рассматриваемых на уроке:
1) уравнение состояния идеального газа и уравнение Менделеева — Клапейрона;
2) закон Дальтона, парциальное давление, закон Авогадро;
3) газовые законы и границы их применимости;
4) графики изохорного, изобарного и изотермического процесса;
5) определение по графикам характера процессов и макропараметров идеального газа;
6) применение модели идеального газа для описания поведения реальных газов.
Глоссарий по теме
Уравнение, связывающее три макроскопических параметра давление, объём и температура, называют уравнением состояния идеального газа.
Парциальное давление – давление отдельно взятого компонента газовой смеси, равно давлению, которое он будет оказывать, если занимает весь объем при той же температуре.
Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами (изопроцессами).
Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим.
Процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении называют изобарным.
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным.
Основная и дополнительная литература по теме урока:
Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. Физика. 10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. – С. 209 – 218.
Рымкевич А.П. Сборник задач по физике. 10-11 класс. — М.: Дрофа, 2009.
Открытые электронные ресурсы по теме урока:
Теоретический материал для самостоятельного изучения
Уравнение Клапейрона при m = const: отношение произведения давления и объёма к температуре есть величина постоянная для постоянной массы газа:
Если изменяется какой-либо макроскопический параметр газа постоянной массы, то два других параметра изменятся таким образом, чтобы указанное соотношение осталось постоянным.
Отношение произведения давления и объёма к температуре равно универсальной газовой постоянной для одного моля идеального газа.
Уравнение Менделеева при v = 1 моль
Произведение постоянной Больцмана и постоянной Авогадро называется универсальной газовой постоянной.

Уравнение состояния идеального газа получило название «уравнение Менделеева-Клапейрона».
Давление смеси химически невзаимодействующих газов равно сумме их парциальных давлений: закон Дальтона.
где pi– парциальное давление i-й компоненты смеси.
Парциальное давление – давление отдельно взятого компонента газовой смеси, равное давлению, которое он будет оказывать, если занимает весь объём при той же температуре.
Один моль любого газа при нормальных условиях занимает один и тот же объём равный:
V0=0,0224м 3 /моль=22,4дм 3 /моль.
Это утверждение называется законом Авогадро
Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами (изопроцессами).
Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим.
Для газа данной массы произведение давления на объём постоянна, если температура газа не меняется — закон Бойля – Мариотта.
Изотерма соответствующая более высокой температуре T1, лежит на графике выше изотермы, соответствующей более низкой температуре T2.
Если значения давления и температуры в различных точках объёма разные, то в этом случае газ находится в неравновесном состоянии.
Равновесное состояние — это состояние, при котором температура и давление во всех точках объёма одинаковы.
Процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении называют изобарным.
Для газа данной массы отношение объема к температуре постоянно, если давление не изменяется — закон Гей-Люссака.
Изобара соответствующая более высокому давлению p2 лежит на графике ниже изобары соответствующей более низкому давлению p1.
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным.
При данной массе газа отношение давление газа к температуре постоянно, если объем газа не изменяется — закон Шарля.
Изохора соответствующая большему объему V2 лежит ниже изохоры, соответствующей меньшему объему V1.
Примеры и разбор решения заданий
1. Установите соответствие между физическими величинами и приборами для их измерения. К каждой позиции первого столбца подберите нужную позицию второго и запишите в таблицу выбранные цифры под соответствующими буквами.
Газовые законы уравнения и графики
Уравнение состояния идеального газа определяет связь температуры, объема и давления тел.
- Позволяет определить одну извеличин, характеризующих состояние газа, по двум другим (используется в термометрах);
- Определить, как протекают процессы при определенных внешних условиях;
- Определить, как меняется состояние системы, если она совершает работу или получает тепло от внешних тел.
Уравнение Менделеева-Клапейрона (уравнение состояния идеального газа)
— универсальная газовая постоянная, R = kNA
Уравнение Клапейрона (объединенный газовый закон)
Частными случаями уравнения являются газовые законы, описывающие изопроцессы в идеальных газах, т.е. процессы, при которых один из макропараметров (T, P, V) в закрытой изолированной системе постоянный.
Количественные зависимости между двумя параметрами газа одной и той же массы при неизменном значении третьего параметра называют газовыми законами.
Газовые законы
Закон Бойля — Мариотта
Первый газовый закон был открыт английским ученым Р. Бойлем (1627—1691) в 1660 г. Работа Бойля называлась «Новые эксперименты, касающиеся воздушной пружины». И действительно, газ ведет себя подобно сжатой пружине, в этом можно убедиться, сжимая воздух в обычном велосипедном насосе.
Бойль изучал изменение давления газа в зависимости от объема при постоянной температуре. Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим (от греческих слов isos — равный, therme — тепло).
Независимо от Бойля несколько позднее французский ученый Э. Мариотт (1620—1684) пришел к тем же выводам. Поэтому найденный закон получил название закона Бойля—Мариотта.
Произведение давления газа данной массы на его объем постоянно, если температура не меняется
Закон Гей-Люссака
Сообщение об открытии еще одного газового закона было опубликовано лишь в 1802 г., спустя почти 150 лет после открытия закона Бойля—Мариотта. Закон, определяющий зависимость объема газа от температуры при постоянном давлении (и неизменной массе), был установлен французским ученым Гей-Люссаком (1778— 1850).
Относительное изменение объема газа данной массы при постоянном давлении прямо пропорционально изменению температуры
Закон Шарля
Зависимость давления газа от температуры при постоянном объеме экспериментально установил французский физик Ж. Шарль (1746—1823) в 1787 г.
Ж. Шарль в 1787 г., т. е. раньше, чем Гей-Люссак, установил и зависимость объема от температуры при постоянном давлении, но он своевременно не опубликовал своих работ.
Давление данной массы газа при постоянном объеме прямо пропорционально абсолютной температуре.
| Название | Формулировка | Графики |