HTTP Status 400 – Bad Request
Type Exception Report
Message Invalid character found in the request target [/ru/?s=K3[Fe(CN)6]+++FeSO4+=+Fe3[Fe(CN)6]2+++K2SO4 ]. The valid characters are defined in RFC 7230 and RFC 3986
Description The server cannot or will not process the request due to something that is perceived to be a client error (e.g., malformed request syntax, invalid request message framing, or deceptive request routing).
Note The full stack trace of the root cause is available in the server logs.
Аналитические реакции
Гексацианоферрат(III) калия K3[Fe(CN)6] с катионом Fe 2+ образует синий осадок «турнбулевой сини»:
Осадок не растворяется в кислотах, но разлагается щелочами с образованием Fe(OH)2. При избытке реактива осадок приобретает зеленый оттенок. Реакции мешают ионы Fe 3+ , которые при большой концентрации дают с реактивом бурое окрашивание раствора, и ионы Мn 2+ и Bi 3+ , дающие с реактивом слабоокрашенные осадки, растворимые в кислотах. Выполнение реакций. В пробирку поместить 1–2 капли раствора FeSO4 и прибавить 1 каплю реактива. Полученный осадок разделить на две части, к первой прибавить 1-2 капли 2 М раствора НС1, ко второй– 1-2 капли 2 М раствора щелочи. Условия проведения реакции – с разбавленными растворами в кислой среде, рН = 3.
1.5.2.> Окисление Fe 2+ до Fe 3+ . Ион Fe 2+ представляет собой довольно сильный восстановитель и способен окисляться при действии ряда окислителей, например, H2O2, KMnO4, K2Cr2O7 в кислой среде и др.
При проведении систематического анализа Fe 2+ следует открыть в предварительных испытаниях, т.к. в процессе разделения групп Fe 2+ может окислиться до Fe 3+ .
Частные аналитические реакции ионов Fe 3+
1.5.3. Гексацианоферрат(II) калия K4[Fe(CN)6] с катионами Fe 3+ образует темно-синий осадок «берлинской лазури»:
Осадок практически не растворяется в кислотах, но разлагается щелочами с образованием Fe(OH)3. В избытке реактива осадок заметно растворяется. Выполнение реакции. К 1–2 каплям раствора FeCl3 прибавить 1 каплю реактива. Полученный осадок разделить на две части. К одной части прибавить 2–3 капли 2 М раствора НС1, к другой –1-2 капли 2 М раствора NaOH, перемешать.
1.5.4. Тиоцианат (роданид) калия KNCS с ионами Fe 3+ образует комплекс кроваво-красного цвета. В зависимости от концентрации тиоцианата могут образовываться комплексы различного состава:
Fe 3+ + NCS – ↔ Fe(NCS) 2+ ,
Fe 3+ + 2NCS – ↔ Fe(NCS) 2+ ,
и т.д. до Fe 3+ + 6NCS – ↔ Fe(NCS)6 3– ,
Реакция обратима, поэтому реактив берется в избытке. Определению мешают ионы, образующие с Fe 3+ устойчивые комплексы, например, фторид-ионы, соли фосфорной, щавелевой и лимонной кислот.
89.Элементы I B группы. Типичные свойства важнейших соединений, биологическая роль. Бактерицидное действие ионов Ag + и Сu 2+ . Аналитические реакции на ионы серебра и меди.
n = 4 Cu ns1(n-1)d10, внешний уровень — 1 ē,
предвнешний — 18 ē
n = 5 Ag Неспаренных ē — один (провал, проскок), но
n = 6 Au 18 — электронный слой, устойчивый у подгруппы
цинка, здесь еще не вполне стабилизировался и
способен к потере ē, поэтому СО возможны
Только d-элементы IB группы образуют соединения, в которых СО превышает N группы, причем она более устойчива для Cu2+, Ag+, Au+3
Хаpактеpное свойство двухзаpядных ионов меди — их способность соединяться с молекулами аммиака с обpазованием комплексных ионов.Медь пpинадлежит к числу микpоэлементов. Такое название получили Fe, Cu, Mn, Mo, B, Zn, Co в связи с тем, что малые количества их необходимы для ноpмальной жизнедеятельности pастений. Микpоэлементы повышают активность феpментов, способствуют синтезу сахаpа, кpахмала, белков, нуклеиновых кислот, витаминов и феpментов. Сеpебpо — малоактивный металл. В атмосфеpе воздуха оно не окисляется ни пpи комнатных темпеpатуpах, ни пpи нагpевании. Часто наблюдаемое почеpнение сеpебpяных пpедметов — pезультат обpазования на их повеpхности чёpного сульфида сеpебpа — AgS2. Это пpоисходит под влиянием содеpжащегося в воздухе сеpоводоpода, а также пpи сопpикосновении сеpебpяных пpедметов с пищевыми пpодуктами, содеpжащими соединения сеpы.4Ag + 2H2S + O2 —> 2Ag2S +2H2OВ pяду напpяжения сеpебpо pасположено значительно дальше водоpода. Поэтому соляная и pазбавленная сеpная кислоты на него не действуют. Раствоpяют серебpо обычно в азотной кислоте, котоpая взаимодействует с ним согласно уpавнению:Ag + 2HNO3 —> AgNO3 + NO2+ H2OСеpебpо обpазует один pяд солей, pаствоpы котоpых содеpжат бесцветные катионы Ag + .Пpи действии щелочей на pаствоpы солей сеpебpа можно ожидать получения AgOH, но вместо него выпадает буpый осадок оксида сеpебpа(I):2AgNO3 + 2NaOH —> Ag2O + 2NaNO3 + H2OКpоме оксида сеpебpа(I) известны оксиды AgO и Ag2O3.Hитpат сеpебpа (ляпис) — AgNO3 — обpазует бесцветные пpозpачные кpисталлы, хоpошо pаствоpимые в воде. Пpименяется в пpоизводстве фотоматеpиалов, пpи изготовлении зеpкал, в гальванотехнике, в медицине.Подобно меди, сеpебpо обладает склонностью к обpазованию комплексных соединений.Многие неpаствоpимые в воде соединения сеpебpа (напpимеp: оксид сеpебpа(I) — Ag2O и хлоpид сеpебpа— AgCl), легко pаствоpяются в водном pаствоpе аммиака.Комплексные цианистые соединения сеpебpа пpименяются для гальванического сеpебpения, так как пpи электpолизе pаствоpов этих солей на повеpхности изделий осаждается плотный слой мелкокpисталлического сеpебpа.Все соединения сеpебpа легко восстанавливаются с выделением металлического сеpебpа. Если к аммиачному pаствоpу оксида сеpебpа(I), находящемуся в стеклянной посуде, пpибавить в качестве восстановителя немного глюкозы или фоpмалина, то металлическое сеpебpо выделяется в виде плотного блестящего зеpкального слоя на повеpхности стекла. Ионы сеpебpа подавляют pазвитие бактеpий и уже в очень низкой концентpации, сеpилизуют питьевую воду. В медицине для дезинфекции слизистых оболочек пpименяются стабилизиpованные специальными добавками коллоидные pаствоpы сеpебpа (пpотаpгол, коллаpгол и дp.Серебро (наряду с другими тяжелыми металлами, такими как медь, олово, ртуть) способно в малых концентрациях оказывать бактерицидное действие (так называемый, олигодинамический эффект). Выраженный бактерицидный эффект (способность гарантированно убивать определенные бактерии) наблюдается при концентрациях ионов серебра свыше 0,15 мг/л. В количестве 0,05 — 0,1 мг/л ионы серебра обладают только бактериостатическим действием (способностью сдерживать рост и размножение бактерий).Хотя скорость обеззараживания серебром не так высока, как озоном или УФ лучами, ионы серебра могут долгое время оставаться в воде, обеспечивая ее длительную дезинфекцию.Механизм действия серебра еще до конца не изучен. Как полагают ученые, обеззараживающий эффект наблюдается, когда положительно заряженные ионы серебра, а также меди образуют электростатические связи с отрицательно заряженной поверхностью клеток микроорганизмов. Эти электростатические связи создают напряжение, которое может нарушить проницаемость клеток и снизить проникновение в них жизненно-необходимого количества питательных веществ. Проникая же внутрь клеток, ионы серебра, а также меди взаимодействуют с аминокислотами, которые входят в состав протеинов и используются в процессе фотосинтеза. В результате чего, процесс превращения солнечного излучения в пищу и энергию микроорганизмов нарушается, что и приводит к их гибели.В результате многочисленных исследований подтверждено эффективное бактерицидное воздействие ионов серебра на большинство патогенных микроорганизмов, а также и на вирусы. Однако спорообразующие разновидности микроорганизмов практически нечувствительны к серебру.Обогащение воды ионами серебра может осуществляться несколькими способами: непосредственным контактом воды с поверхностью серебра, обработкой воды раствором солей серебра и электролитическим методом.
Качественная реакция на ионы меди
Гексацианоферрат (2) калия K4[Fe(CN)6] образует с раствором соли меди красно-бурый осадок Cu2[Fe(CN)6], нерастворимый в разбавленных кислотах, но растворимый в растворе аммиака.
Cu 2+ + [Fe(CN)6] 4+ ® Cu2[Fe(CN)6]¯К 3 каплям раствора CuSO4 прибавить 2 капли раствора соли K4[Fe(CN)6]. Hаблюдать выпадение красного осадка. Осадок отцентрифугировать и прибавить к нему 3–5 капель раствора аммиака.
Реакции обнаружения ионов меди Сu2+
Действие группового реагента H2S. Сероводород образует в подкисленных растворах солей меди черный осадок сульфида меди (II)CuS:CuSO4 + H2S = CuS + H2SO4,Cu2+ + H2S = CuS + 2H+.
Действие гидроксида аммония NH4OH. Гидроксид аммония NH4OH, взятый в избытке, образует с солями меди комплексный катион тетраамминмеди (II) интенсивно-синего цвета:
CuSO4 + 4NH4OH = [Cu(NH3)4]SO4 + 4Н2O,
Сu2+ + 4NH4OH = [Cu(NH3)4]+ + 4Н2О.
Реакции обнаружения ионов серебра Ag+
Действие группового реагента НС1. Соляная кислота образует с растворами солей Ag+ практически нерастворимый в воде белый осадок хлорида серебра AgCl:
Обнаружение катиона серебра. Соляная кислота и растворы ее солей (т. е. хлорид-ионы Сl-) образуют с растворами солей Ag+ практически нерастворимый в воде белый осадок хлорида серебра AgCl, который хорошо растворяется в избытке раствора NH4OH; при этом образуется растворимая в воде комплексная соль серебра хлорид диамминсеребра. При последующем действии азотной кислоты комплексный ион разрушается и хлорид серебра снова выпадает в осадок (эти свойства солей серебра используются для его обнаружения):
AgNO3 + НСl = AgCl + HNO3,
AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2Н2О,
[Ag(NH3)2]Cl + 2HNO3 = AgCl + 2NH4NO3.
90.Элементы II В группы. Типичные свойства важнейших соединений, биологическая роль. Комплексная природа, медь- и цинксодержащих ферментов. Аналитические реакции на ионы Zn 2+ .
Ферментами называют природные белковые катализаторы. Некоторые ферменты имеют чисто белковый состав и не нуждаются для проявления своей активности в каких-либо иных веществах. Однако существует обширная группе ферментов, активность которых проявляется только в присутствии определенных соединений небелковой природы. Эти соединения называются кофакторами. Кофакторами могут быть, например, ионы металлов или органические соединения сложного строения — их обычно называют коферментами. Установлено, что для нормальной работы фермента иногда требуется и кофермент, и ион металла, образующие вместе с молекулой субстрата тройной комплекс. Так металлы входят в состав биологических машин как незаменимая часть. Ионы магния нужны для работы по переносу остатков фосфорной кислоты, для этих же целей нужны и ионы калия; гидролиз белков требует ионов цинка и т. д. Ниже мы разберем эти вопросы детально.Ферменты, как правило, ускоряют однотипные реакции, и лишь немногие из них действуют только на одну определенную и единственную реакцию. К таким ферментам, обладающим абсолютной специфичностью, относится, в частности, уреаза, разлагающая мочевину. Большинство ферментов не столь строги в выборе субстрата. Одна и та же гидролаза, например, способна катализировать гидролитическое разложение нескольких различных сложных эфиров.По мере того как в биологических исследованиях их химическая сторона углублялась и химики все чаще становились помощниками и сотрудниками биологов, число вновь открываемых ферментов неуклонно возрастало; вскоре их пришлось считать уже не десятками, а сотнями. Такое расширение круга биологических катализаторов вызвало некоторые трудности в классификации и номенклатуре ферментов.Раньше ферменты называли по тому субстрату, на который они действовали, с прибавлением окончания «аза». Так, если фермент действует на сахар мальтозу, то его называли «мальтаза», если на лактозу — «лактаза» и т. д. В настоящее время принята номенклатура, в которой название отражает также и химическую функцию фермента. Частица «аза» сохранена для простых ферментов. Если же в реакции участвует комплекс ферментов, применяют термин «система».
Ферменты делят на шесть классов:
Оксидоредуктазы. Это ферменты, катализирующие окислительно-восстановительные реакции. Примером оксидоредуктаз могут служить пируватдегидрогеназа, отнимающая водород от пировиноградной кислоты, каталаза, разлагающая пероксид водорода, и др.
Желтая кровяная соль
| Калий железистосинеродистый | |
|---|---|
 | |
 |
наименование
тригидрат — бледно-жёлтые кристаллы
650 °C
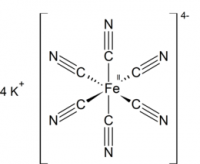
Гексацианоферрат (II) калия (железистосинеродистый калий, ферроцианид калия, гексацианоферроат калия, жёлтая кровяная соль) — комплексное соединение двухвалентного железа K4[Fe(CN)6], существующее обычно в виде тригидрата K4[Fe(CN)6]·3H2O.
Содержание
- 1 История открытия и тривиальные названия
- 2 Получение
- 3 Химические свойства
- 4 Токсичность
- 5 Применение
- 6 Мнемоническое правило
История открытия и тривиальные названия
- жёлтая кровяная соль — кристаллогидрат K4[Fe(CN)6]·3H2O.
- жёлтое синькали
- жёлтая соль
- кровещелочная соль
Тривиальное название появилось из-за того, что ранее «жёлтую кровяную соль» получали путём сплавления отходов с боен (в частности, крови) с поташом и железными опилками. Это, а также жёлтый цвет кристаллов, обусловили название соединения.
Получение
В настоящее время в промышленности получают из отработанной массы после очистки газов на газовых заводах (содержит цианистые соединения); эту массу обрабатывают суспензией Ca(OH)2; фильтрат, содержащий Ca2[Fe(CN)6], перерабатывают путём последовательного добавления сначала KCl, а затем K2CO3.
Он также может быть получен путём взаимодействия суспензии FeS с водным раствором KCN. Реакцию можно представить следующей схемой:
1. цианид калия переводит Fe 2+ в белый осадок гексацианоферрата(II) железа(II) (а не в цианид железа(II), как считалось ранее, что вытекает из взаимодействия этого цианида со щёлочью: 3Fe(CN)2 + 4KOH → 2Fe(OH)2↓ + K4[Fe(CN)6]):
2. затем осадок растворяется в избытке KCN с образованием «жёлтой кровяной соли»:
Fe2[Fe(CN)6] + 12CN − → 3[Fe(CN)6] 4−
Химические свойства
Светло-жёлтые кристаллы с тетрагональной решеткой, существующие в виде тригидрата K4[Fe(CN)6]·3H2O.
Плотность 1,853 г/см³ при 17 °C. Растворимость в воде 31,5 г/100 г при 25 °C, 48,3 г при 50 °C. Практически не растворяется в эфире, этаноле, пиридине, анилине, этилацетате.
Гексацианоферрат(II) калия диамагнитен.
Выше 87,3 °C (по другим данным, выше 120 °C) превращается в безводную соль с плотностью 1,935 г/см³. Выше 650 °C разлагается:
В реакции с соляной кислотой выделяется белый осадок железистосинеродистой кислоты (H4[Fe(CN)6]).
С концентрированной серной кислотой реагирует по уравнению:
Этим способом можно пользоваться в лаборатории для получения монооксида углерода.
С солями металлов в степени окисления +2 и +3, образует малорастворимые соединения гексацианоферратов(II) (см. в разделе «применение»).
В водных растворах окисляется хлором и другими окислителями, такими, как пероксид водорода до K3[Fe(CN)6]:
Анион [Fe(CN)6] 4− очень прочен (константа нестойкости 8⋅10 -36 ), не разлагается ни щелочами, ни кислотами, устойчив по отношению к воздуху; поэтому растворы ферроцианидов не показывают реакций ни на Fe 2+ , ни на CN − .
Токсичность
Нейтральное вещество, не разлагается в воде и внутри человеческого организма. Летален при приёме перорально дозы в 6400 мг/кг (испытания на крысах).
Применение
Применяют при изготовлении пигментов, крашении шёлка, в производстве цианистых соединений, ферритов, цветной бумаги, как компонент ингибирующих покрытий и при цианировании сталей, для выделения и утилизации радиоактивного цезия.
В Российской Федерации широко применяют при производстве продуктов питания — соли, творожных продуктов, в виноделии и пр.
Гексацианоферрат(II) калия применяется в аналитической химии как реактив для обнаружения некоторых катионов:
1. Fe 3+ : образуется малорастворимый синий осадок «берлинской лазури»:
или, в ионной форме
Получающийся гексацианоферрат(II) калия-железа(III) слабо растворим (с образованием коллоидного раствора), поэтому носит название «растворимая берлинская лазурь».
2. Zn 2+ : образуется белый осадок гексацианоферрата(II) цинка-калия:
или, в ионной форме
3. Cu 2+ : из нейтральных или слабокислых растворов выпадает красно-бурый осадок гексацианоферрата(II) меди(II):
или, в ионной форме
В пищевой промышленности ферроцианид калия зарегистрирован в качестве пищевой добавки E536, препятствующей слёживанию и комкованию. Применяется как добавка к поваренной соли.
Мнемоническое правило
Для того, чтобы запомнить формулу желтой кровяной соли K4[Fe(CN)6] и не спутать её с красной кровяной солью K3[Fe(CN)6], существует мнемоническое правило:
- Число атомов калия соответствует числу букв в английских названиях солей: «gold» — 4 буквы, то есть 4 атома калия — желтая кровяная соль (калий железистосинеродистый) K4[Fe(CN)6]. «Red» — 3 буквы, то есть 3 атома калия — красная кровяная соль (калий железосинеродистый) — K3[Fe(CN)6].
[Fe(CN)6] 4–
аммония • бария • железа(II) • железа(III) • калия • кальция • кобальта • магния • марганца • меди(II) • натрия • никеля • олова • свинца • стронция • таллия • цинка • Железистосинеродистая кислота H4[Fe(CN)6]
[Fe(CN)6] 3–
железа(II) • железа(II,III) • калия • кальция • кобальта • меди(I) • натрия • неодима(III) • олова • свинца • Железосинеродистая кислота H3[Fe(CN)6]
http://helpiks.org/6-49403.html
http://chem.ru/zheltaja-krovjanaja-sol.html




