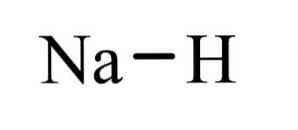Гидрид натрия: способы получения и химические свойства
Гидрид натрия NaH — неорганическое бинарное соединение щелочного металла натрия и водорода. Белый. При нагревании разлагается, под избыточным давлением H2 плавится без разложения.
Относительная молекулярная масса Mr = 24,00; d = 1,364; tпл = 638º C и избыточном давлении.
Способ получения
Гидрид натрия получают реакцией взаимодействия натрия и водорода:
2Na + H2 = 2NaH
Химические свойства
1. Гидрид натрия — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами.
1.1. При взаимодействии с кислородом при температуре выше 230º C гидрид натрия образует гидроксид натрия:
2NaH + O2 = 2NaOH
1.2. При температуре 450–500º C г идрид натрия взаимодействует с хлором , образуя хлорид натрия и хлороводород:
NaH + Cl2 = NaCl + HCl
1.3. Гидрид натрия реагирует с серой при температуре 350–400º C с образованием сульфида натрия и сероводорода:
2NaH + 2S = Na2S + H2S
1.4. Взаимодействуя с углеродом (графитом) гидрид натрия образует ацетиленид натрия и ацетилен, температура при этом должна быть 350º C:
2. Гидрид натрия взаимодействует со сложными веществами :
2.1. При взаимодействии с водой гидрид натрия образует гидроксид натрия и газ водород:
NaH + H2O = NaOH + H2↑
2.2. С разбавленной хлороводородной кислотой гидрид натрия реагирует образованием хлорида натрия и газа водорода:
NaH + HCl = NaCl + H2↑
2.3. Гидрид натрия может реагировать с такими оксидами , как:
2.3.1. Оксидом серы IV при температуре 200–250º C, образуя сульфат натрия и хлороводород:
2.4. Гидрид натрия реагирует с аммиаком при t = 350º C с образованием нитрида натрия и водорода:
2.5. Гидрид натрия может взаимодействовать с различными солями:
2.5.1. При взаимодействии с хлоридом алюминия в присутствии эфира, гидрид лития образует тетрагидроалюминат натрия и хлорид натрия:
4NaH + AlCl3 = Na[AlH4] + 3NaCl
2.5.2. Реагируя с хлоридом титана, гидрид натрия образует титан, хлорид натрия и хлороводородную кислоту:
2NaH + TiCl4 = Ti + 2NaCl + 2HCl
3. Гидрид натрия разлагается при температуре 430–500º C и вакууме, с образованием натрия и водорода:
2NaH = 2Na + H2
Гидрид натрия (NaH) свойства, реакционная способность, опасности и использование
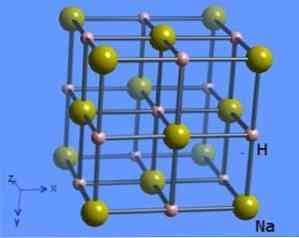
гидрид натрия неорганическое соединение формулы NaH. Он имеет ионную связь между натрием и гидридом. Его структура проиллюстрирована на рисунке 1. Он представляет собой солевой гидрид, что означает, что он представляет собой гидрид, подобный соли, состоящей из ионов Na + и H-, в отличие от более молекулярных гидридов, таких как боран, метан, аммиак. и вода.
Кристаллическая структура имеет координационное число 6, где каждая молекула натрия окружена 8 ионами гидрида, имеющими октаэдрическую форму, и показана на рисунке 2 (Марк Уинтер [Университет Шеффилда и WebElements Ltd, 1993-2016).
Соединение получают прямой реакцией между газообразным натрием и водородом (формула гидрида натрия — использование, свойства, структура и формула гидрида натрия, 2005-2017 гг.) Следующим образом:
Гидрид натрия продается коммерчески в виде 60% мас. / Мас. Дисперсии (процентное отношение массы к массе) в минеральном масле для безопасного обращения (SODIUM HYDRIDE, s.f.).
- 1 Физико-химические свойства гидрида натрия
- 2 Реактивность и опасности
- 3 использования
- 4 Ссылки
Физико-химические свойства гидрида натрия
Гидрид натрия представляет собой белое твердое вещество в чистом виде, хотя обычно его получают в сером или серебристом цвете. Его внешний вид показан на рисунке 3.
NaH имеет молекулярную массу 23,99771 г / моль, плотность 1,396 г / мл и температуру плавления 800 ° C (Royal Society of Chemistry, 2015). Он нерастворим в аммиаке, бензоле, четыреххлористом углероде и сероуглероде (Национальный центр биотехнологической информации, s.f.).
Соединение крайне нестабильно. Чистый NaH может легко воспламениться в воздухе. Когда он вступает в контакт с водой, присутствующей в воздухе, он выделяет легковоспламеняющийся водород.
Когда он открыт для воздуха и влаги, NaH также легко гидролизуется в сильное коррозионное основание гидроксида натрия (NaOH) в соответствии с реакцией:
NaH + H2O → NaOH + H2
В этой реакции можно наблюдать, что гидрид натрия ведет себя как основание. Это связано с электроотрицательностью.
Натрий обладает значительно более низкой электроотрицательностью (≈1,0), чем водород (≈2,1), что означает, что водород извлекает электронную плотность по направлению к себе, удаляясь от натрия, образуя катион натрия и анион гидрида.
Чтобы соединение было кислотой Бренстеда, оно должно отделять электронную плотность от водорода, то есть соединять его с электроотрицательным атомом, таким как кислород, фтор, азот и т. Д. Только тогда он может быть формально описан как H + и может быть диссоциирован как таковой..
Гидрид намного лучше описан как H- и имеет свободную пару электронов. Таким образом, это основание Бренстеда, а не кислота. Фактически, если вы расширите определение кислоты / основания Бренстеда так же, как это сделал Льюис, вы придете к выводу, что натрий (Na +) является кислотным видом здесь..
Продукт реакции кислоты Бренстеда с кислотой-основанием H-основания и H + кислоты превращается в H2. Поскольку кислотный водород извлекается непосредственно из воды, газообразный водород может пузыриться, смещая равновесие, даже если реакция не термодинамически благоприятна.
Можно оставить ионы ОН-, которые можно записать вместе с остальной частью катиона Na +, чтобы получить гидроксид натрия (почему на основе твердого гидрида натрия, а не кислоты при реакции с водой?, 2016).
Реактивность и опасности
Соединение является мощным восстановителем. Атакует SiO2 в стекле. Воспламеняется при контакте с газообразными F2, Cl2, Br2 и I2 (последний при температуре выше 100 ° C), особенно в присутствии влаги, с образованием HF, HCl, HBr и HI.
Реагирует с серой с образованием Na2S и H2S. Может вступать в реакцию с диметилсульфоксидом. Активно реагирует с ацетиленом даже при -60 ° С. Самовоспламеняется во фторе.
Он инициирует реакцию полимеризации в этил-2,2,3-трифторпропионате, так что сложный эфир сильно разлагается. Присутствие в реакции диэтилсукцината и этилтрифторацетата, вызвало взрывы (SODIUM HYDRIDE, 2016).
Гидрид натрия считается разъедающим для кожи или глаз из-за потенциальных побочных продуктов едких реакций с водой.
В случае попадания в глаза их следует промыть большим количеством воды под веками не менее 15 минут и немедленно обратиться к врачу..
В случае попадания на кожу, немедленно почистите щеткой и промойте пораженный участок водой. Обратиться к врачу, если раздражение не проходит.
Это вредно при проглатывании из-за реакции на воду. Не вызывайте рвоту. Вам следует немедленно обратиться за медицинской помощью и перевести пострадавшего в медицинский центр..
Дисперсия гидрида натрия в масле не является пылью. Однако материал, который реагирует, может испускать мелкий едкий туман. При вдыхании прополощите рот водой и перенесите пострадавшего в место со свежим воздухом. Следует обратиться за медицинской помощью (Rhom and Hass Inc., 2007).
приложений
Основное использование гидрида натрия заключается в проведении реакций конденсации и алкилирования, которые развиваются в результате образования карбаниона (катализируемого основанием)..
Гидрид натрия в масле напоминает алкоголяты натрия и металла по своей способности действовать в качестве депротонирующего агента в эфире ацетоуксусной кислоты, Кляйзена, Стоббе, Дикмана и других связанных реакциях. Он имеет заметные преимущества перед другими конденсирующими агентами в том, что:
- Это более сильное основание, что приводит к более прямой депротонации.
- Нет необходимости в избытке.
- Произведенный H2 дает меру степени реакции.
- Вторичные реакции, такие как сокращения, устраняются.
Алкилирование ароматических и гетероциклических аминов, таких как 2-аминопиридин и фенотиазин, легко достигается с высоким выходом при использовании смесей толуол-метилформамид. Концентрация диметилформамида является переменной, используемой для контроля скорости реакции (HINCKLEY, 1957).
Было предложено использовать гидрид натрия для хранения водорода для использования в транспортных средствах на топливных элементах, причем гидрид заключен в пластиковые гранулы, которые измельчаются в присутствии воды для выделения водорода.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://ru.thpanorama.com/articles/qumica/hidruro-de-sodio-nah-propiedades-reactividad-peligros-y-usos.html http://acetyl.ru/o/nna1h1.php |