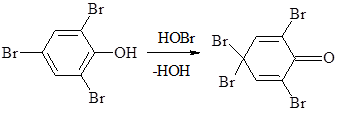Работа 3. Цветные реакции на фенольную группу
Выполнение работы:в пять пробирок наливают по 1 мл 5%-ного раствора фенола, пирокатехина, резорцина, гидрохинола, пирогаллола. В каждую пробирку добавляют по 2-3 капли 1%-ного раствора хлорида железа (III). Появляется окрашивание: в пробирке с фенолом — сине-фиолетовое, с пирокатехином — зеленое, с резорцином — фиолетовое, с гидрохиноном — зеленое, быстро переходящее в желтое, спирогаллолом — буро-красное.
Одновременно с образованием фенолятов хлорид железа (III) действует как окислитель. Изменение зеленой окраски на желтую в пробирке с гидрохином обусловлено тем, что при его окислении в хинон образуется промежуточное соединение одной молекулы гидрохинона с одной молекулой хинона, так называемый хингидрон. Заметить зеленую окраску можно только в первый момент попадания капли хлорида железа (III) в раствор гидрохинона при рассмотрении на белом фоне. Окраска становится заметнее в насыщенном растворе гидрохинона и разбавленном растворе хлорида железа (III).
+ FeCI3 → сине- фиолетовое окрашивание
+ FeCI3 → зеленое окрашивание
+ FeCI3 → фиолетовое окрашивание
+ FeCI3 → зеленое → желтое окрашивание
+ FeCI3 → буро-красное окрашивание
Работа 4. Взаимодействие адреналина с хлоридом железа (III)
Выполнение работы:В пробирку наливают 1 мл адреналина и 2-3 капли 1%-ного раствора хлорида железа (III). Появляется зеленое окрашивание, т.к. адреналин в своей структуре содержит двухатомный фенол пирокатехин (1,2-дигидроксибензол).
Дата добавления: 2014-12-16 ; просмотров: 4948 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
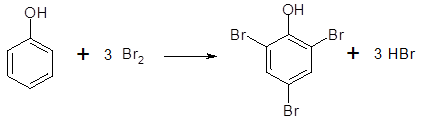
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Опыт № 6. Реакция фенолов с хлоридом железа (III)В каждую пробирку наливают по 1 мл раствора соответствующего фенола и прибавляют 1-2 капли раствора хлорида железа (III). Растворы фенола и резорцина дают при этом интенсивное фиолетовое окрашивание, раствор пирогаллола – буровато-красное. Раствор гидрохинона сначала зеленеет, затем буреет, а при стоянии из него выпадают красивые темно-зеленые кристаллы хингидрона. Окрашенные растворы, содержащие фенол, резорцин и пирогаллол делят каждый на две части; к одной части добавляют равный объем спирта, к другой – разбавленной соляной кислоты. Что наблюдаете? Из смеси, содержащей гидрохинон, отливают немного раствора, отстоявшегося над осадком, и добавляют к нему несколько капель ферроцианида калия К3[Fe(CN)6]. Образуется темно-синий осадок турнбулевой сини Fe3[Fe(CN)6]2. Многие фенолы и более сложные соединения, содержащие в молекуле фенольный гидроксил, дают с хлоридом железа (III) интенсивное окрашивание того или иного цвета, характерное для данного фенола. Окрашивание является результатом образования сильно диссоциированных комплексных фенолятов железа (III), образующихся по уравнению: 6 ArOH + FeCl3 → [(ArO)6Fe] 3- + 6H + + 3Cl — При введении кислоты, спирта, избытка хлорида железа(III) уменьшается степень диссоциации фенолята (а, следовательно, снижается концентрация окрашенных анионов) и окраска уничтожается. Одновременно хлорид железа (III) действует на фенолы и как окислитель. Гидрохинон окисляется им до хинона, из которого затем образуется хингидрон: (бесцветный) (желтый) (зеленый) Реагируя как окислитель, соль трехвалентного железа переходит в соль двухвалентного железа, что легко обнаруживается действием ферроцианида калия: Опыт № 7. Действие брома на фенол в водном растворе К 1 мл водного раствора фенола добавляют бромную воду по каплям. Образующаяся сначала муть при встряхивании исчезает. При дальнейшем прибавлении бромной воды (3-4 мл) выделяется обильный белый осадок трибромфенола с характерным аптечным запахом. Продолжают добавлять бромную воду при встряхивании до превращения белого осадка в светло-желтый. Бромирование фенола в водном растворе идет вначале быстро, и фенол количественно превращается в малорастворимый неокрашенный 2,4,6-трибромфенол: Но бромная вода является не только бромирующим агентом, но и окислителем вследствие происходящей реакции: Поэтому при действии избытка бромной воды трибромфенол окисляется до тетрабромфенола, представляющего собой 2,4,4,6 – тетрабромциклогексадиенон: Этот продукт окрашен в желтый цвет и плохо растворим в холодной воде. Опыт № 8. Окисление фенола К 0,5 мл раствора фенола добавляют равный объем раствора карбоната натрия и затем приливают по каплям при встряхивании раствор перманганата калия. Происходит обесцвечивание раствора и выделение оксида марганца (IV) при комнатной температуре. Окисление фенола протекает одновременно по различным направлениям и приводит к образованию сложной смеси веществ. Более легкая окисляемость фенола по сравнению с бензолом обусловлена влиянием гидроксильной группы, резко повышающей подвижность атомов водорода при атомах углерода бензольного кольца, особенно в положениях 2,4,6. Контрольные вопросы по теме «Оксисоединения: спирты, фенолы» источники: http://acetyl.ru/o/z61b1i2b3b4b4i5b6b.php http://pdnr.ru/a10893.html |

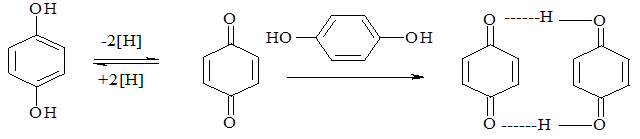 гидрохинон п-хинон хингидрон
гидрохинон п-хинон хингидрон