Карбонат натрия: способы получения и химические свойства
Карбонат натрия Na2CO3 — соль щелочного металла натрия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 105,99; относительная плотность для тв. и ж. состояния d = 2,539; tпл = 851º C;
Способ получения
1. Карбонат натрия можно получить путем взаимодействия оксида натрия и углекислого газа:
2. В результате взаимодействия концентрированного раствора гидроксида натрия и углекислого газа образуется карбонат натрия и вода:
3. При взаимодействии гидрокарбоната натрия и концентрированного раствора гидроксида натрия образуется карбонат натрия и вода:
Качественная реакция
Качественная реакция на карбонат натрия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат натрия образует хлорид натрия, углекислый газ и воду:
2. Взаимодействуя с серной кислотой, карбонат натрия образует углекислый газ и воду, а также сульфат натрия:
Химические свойства
1. Карбонат натрия может реагировать с простыми веществами :
1.1. Карбонат натрия при 900–1000º C реагирует с углеродом . При этом образуется натрий и угарный газ:
Na2CO3 + 2C(кокс) = Na + 3CO
1.2. С хлором концентрированный и горячий раствор карбоната натрия реагирует с образованием хлорида натрия, хлората натрия и углекислого газа:
2. Карбонат натрия вступает в реакцию со многими сложными веществами :
2.1. Насыщенный карбонат натрия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната натрия:
2.2. Карбонат натрия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида натрия и карбоната кальция:
2.3. При взаимодействии с разбавленной хлороводородной кислотой карбонат натрия образует хлорид натрия, углекислый газ и воду:
2.4. Карбонат натрия реагирует с разбавленной плавиковой кислотой . Взаимодействие карбоната натрия с плавиковой кислотой приводит к образованию фторида натрия, воды и углекислого газа:
2.5. Концентрированный раствор карбоната натрия взаимодействует с оксидом серы . При этом образуются карбонат натрия и углекислый газ:
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Опыт № 9. Ознакомление со свойствами карбонатов и гидрокарбонатовЗадания. 1. Проведите качественную реакцию на карбо-нат-ион. 2. Осуществите превращения гидрокарбоната кальция в карбонат кальция и наоборот. 3. Изучите гидролиз карбоната натрия. 4. Проведите реакцию между растворами карбоната натрия и хлорида кальция. Исследуйте продукты реакции с помощью азотной кислоты. Соблюдайте правила техники безопасности при проведении опытов! Оборудование. Лабораторный штатив, штатив с пробирками, детали прибора для разложения гидрокарбоната натрия, нагревательный прибор. Вещества. Растворы азотной и соляной кислот (10%-е), карбоната натрия и хлорида кальция (10% -е), фенолфталеина, известковой воды, гидрокарбоната кальция; кристаллический гидрокарбонат натрия, кусочек мела или мрамора. 1. В одну пробирку поместите небольшой кусочек мела или мрамора, в другую налейте 1 мл раствора карбоната натрия. В обе пробирки добавьте (не более 1 мл) раствора соляной кислоты. Что вы наблюдаете? Внесите в обе пробирки зажженные спички. Наличие какого газа вы обнаружили? Напишите полные и сокращенные ионные уравнения реакций и сделайте вывод, какое вещество может быть использовано для обнаружения карбонат-иона. 2. а) Налейте в пробирку 2 мл раствора гидрокарбоната кальция и добавьте к нему немного известковой воды. Что вы наблюдаете? Составьте полное и сокращенное ионные уравнения этой реакции.б) Соберите прибор, как показано на рисунке 22.8. Насыпьте в пробирку гидрокарбонат натрия. Закройте ее пробкой с газоотводной трубкой и закрепите прибор в штативе так, чтобы отверстие пробирки было ниже ее дна, а конец газоотводной трубки почти доставал дна пробирки с известковой водой. Начинайте нагревать гидрокарбонат натрия в пробирке. Наблюдайте за изменениями, происходящими в обеих пробирках. Как только известковая вода помутнеет, поднимите лапку штатива вместе с пробиркой и газоотводной трубкой вверх и только после этого прекратите нагревание. Объясните необходимость такого порядка действий при проведении данного опыта. Какие вещества образуются при нагревании гидрокарбоната натрия? Составьте уравнение данной реакции и сделайте вывод о химизме превращения гидрокарбонатов в карбонаты. 3. В пробирку налейте по 1 мл раствора карбоната натрия и добавьте по 2—3 капли фенолфталеина. Что вы наблюдаете? Объясните с помощью ионных уравнений реакций результат опыта. 4. В пробирку налейте 1 мл раствора карбоната натрия, столько же раствора хлорида кальция. Что вы наблюдаете? Ответ поясните ионными уравнениями реакций. К получившемуся осадку прилейте немного (0,5 мл) раствора азотной кислоты. Какой газ выделяется? Объясните причину его выделения с помощью ионных уравнений реакции. Проведем несколько опытов: Выпадает белый осадок. Вывод: карбонаты можно получить, прокаливая гидрокарбонаты. 3. Мел плохо растворяется, и в пробирке ничего не происходит. источники: http://acetyl.ru/o/nca11h1c1o32.php http://5terka.com/node/10061 |

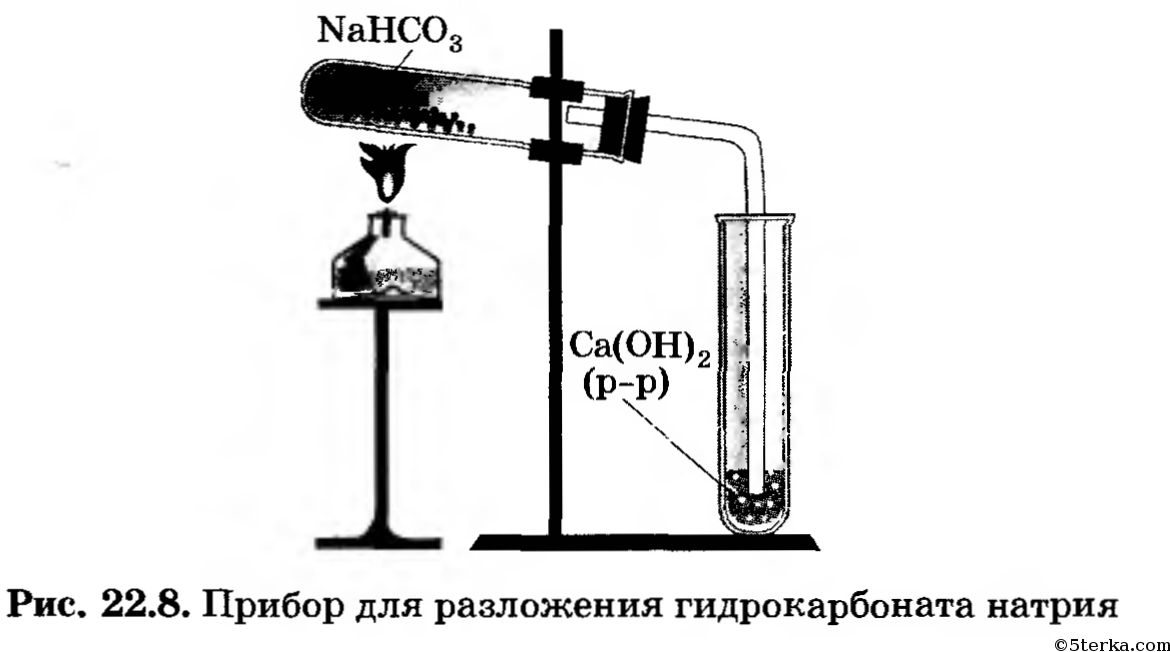


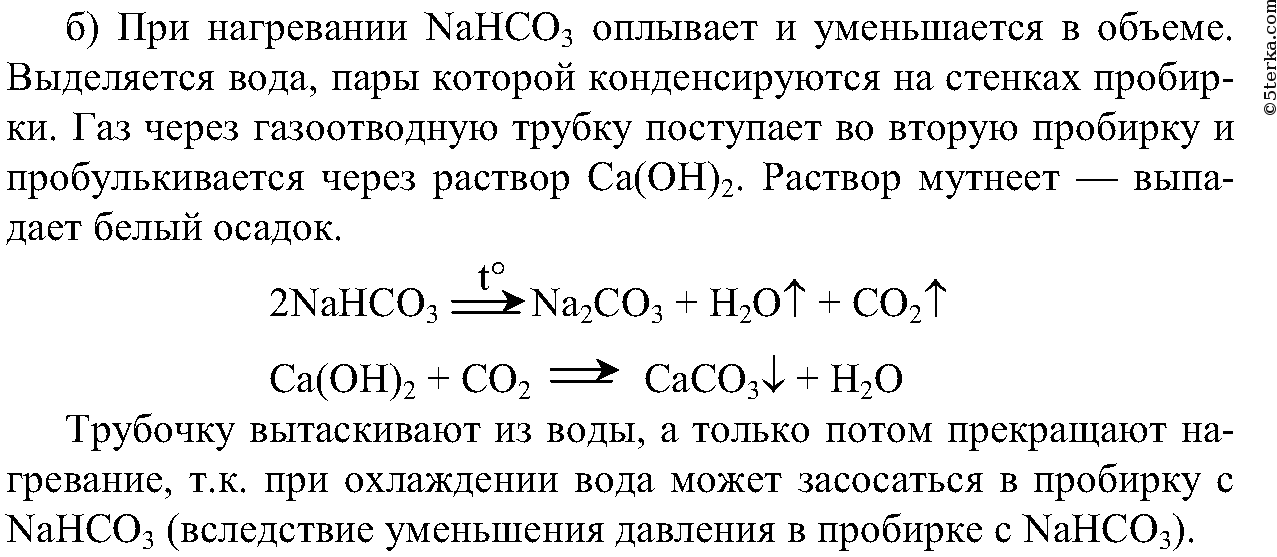


 Решебник по химии за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),
Решебник по химии за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),