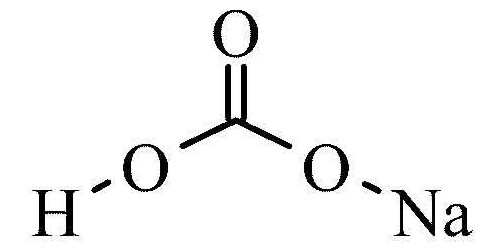
Гидрокарбонат натрия
| Гидрокарбонат натрия | |
|---|---|
 | |
 | |
| Систематическое наименование | гидрокарбонат натрия |
| Традиционные названия | пищевая (питьевая) сода, сода двууглекислая, двууглекислый натрий, бикарбонат натрия, кислый углекислый натрий |
| Хим. формула | CHNaO₃ |
| Рац. формула | NaHCO3 |
| Состояние | твёрдое |
| Молярная масса | 84,0066 г/моль |
| Плотность | 2,159 г/см³ |
| Т. разл. | 60—200 °C |
| Растворимость в воде | 9,59 г/100 мл |
| ГОСТ | ГОСТ 2156-76 ГОСТ 4201-79 ГОСТ 32802-2014 |
| Рег. номер CAS | 144-55-8 |
| PubChem | 516892 |
| Рег. номер EINECS | 205-633-8 |
| SMILES | |
| Рег. номер EC | 205-633-8 |
| Кодекс Алиментариус | E500(ii) |
| RTECS | VZ0950000 |
| ChEBI | 32139 |
| ChemSpider | 8609 |
| ЛД50 | 4220 мг/кг |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гидрокарбонат натрия (лат. Natrii hydrocarbonas ), другие названия: бикарбонат натрия, чайная сада, питьевая или пищевая сода, двууглекислый натрий — неорганическое соединение, натриевая кислая соль угольной кислоты с химической формулой NaHCO3.
В обычном виде — мелкокристаллический порошок белого цвета.
Используется в промышленности, пищевой промышленности, в кулинарии, в медицине как нейтрализатор химических ожогов кожи и слизистых оболочек концентрированными кислотами и для снижения кислотности желудочного сока. Также применяется в буферных растворах.
Содержание
- 1 Химические свойства
- 1.1 Реакция с кислотами
- 2 Термическое разложение
- 3 Получение
- 4 Применение
- 4.1 В химической промышленности
- 4.2 В кулинарии
- 4.3 В медицине
- 4.3.1 Противопоказания к применению в медицинских целях
- 4.4 Пожаротушение
- 4.5 В быту
- 4.6 В транспорте
- 5 Производство
- 6 Хранение
- 7 Безопасность
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Проявляет все свойства соли сильного основания и слабой кислоты. В водных растворах имеет слабощелочную реакцию. В широком диапазоне концентраций в водном растворе pH раствора изменяется незначительно, на этом основано применение раствора вещества в качестве буферного раствора.
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами с образованием соответствующей кислоте соли, например, хлорида натрия, сульфата натрия и угольной кислоты, которая в процессе реакции распадается на углекислый газ и воду, при этом углекислый газ выделяется из раствора в виде пузырьков:
В быту обычно применяется реакция «гашения соды» уксусной кислотой, с образованием ацетата натрия или гашение лимонной кислотой с образование цитрата натрия, реакция с уксусной кислотой:
Термическое разложение
При температуре выше 60 °C гидрокарбонат натрия начинает распадаться на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C, при более высоких температурах карбонат натрия начинает распадаться на оксид натрия и углекислый газ):
При этом процессе выделения воды в виде водяного пара и углекислого газa масса исходного продукта уменьшается примерно на 37 %.
Получение
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
Применение
Двууглекислый натрий (бикарбонат) применяется в химической, пищевой, лёгкой, медицинской, фармацевтической промышленности, цветной металлургии, в быту. Зарегистрирован в качестве пищевой добавки E500 (ii), входит в состав пищевой добавки E500.
В химической промышленности
Применяется для производства красителей, пенопластов и других органических продуктов, фторорганических соединений, продуктов бытовой химии, наполнителей в огнетушителях, Реагент для отделения диоксида углерода, сероводорода из газовых смесей, например, отходящих газов топливосжигающих установок. В этом процессе углекислый газ поглощается раствором гидрокарбоната натрия при повышенном давлении и пониженной температуре, далее поглощённый углекислый газ выделяется из раствора при подогреве и снижении давления;
В лёгкой промышленности — в производстве резины для подошв обуви и в производстве искусственных кож, кожевенном производстве при дублении и нейтрализации кожи после кислого дубления, текстильной промышленности при отделке шёлковых и хлопчатобумажных тканей;
В пищевой промышленности — в хлебопечении, производстве кондитерских изделий, приготовлении газированных напитков.
В кулинарии
Основное применение пищевой соды в пищевой промышленности и в быту — кулинария, где применяется, преимущественно, в качестве основного или дополнительного разрыхлителя в составе кислого и пресного теста. При добавлении питьевой соды в кислое тесто происходит реакция с молочной кислотой, продуцированной при заквашивании дрожжевыми микроорганизмами, при этой реакции выделяется углекислый газ, вспучивающий тесто.
При добавлении в пресное тесто углекислый газ выделяется при выпечке из-за термического разложения.
При применении соды в чистом виде важно соблюсти правильную дозировку, так как она оставляет в продукте карбонат натрия, дающий определённый привкус. Порядок замешивания для теста: соду — в муку, кислые компоненты (уксус, кефир и пр.) — в жидкость.
В медицине
Традиционно раствор питьевой соды используется для дезинфекции зубов и дёсен при зубных болях и полости рта и горла, при сильном кашле, ангине, фарингите, а также как общепринятое средство от изжоги и болей в желудке.
Применяется при заболеваниях, сопровождающиеся выраженным ацидозом (при диабете, инфекциях и др), для борьбы с ацидозом при хирургических вмешательствах (назначается 3-5 г. внутрь).
Применяется в качестве антиаритмического средства.
Как антацидное средство (как и все другие щелочи) применяется при язвенной болезни желудка, и двенадцатиперстной кишки, при повышенной кислотности желудочного сока.
Имеются так же данные о применении препарата (в виде капельных и внутривенных вливаний) при гипертонической болезни, симптоматической почечной гипертонии, и хронической почечной недостаточности. Эффект связан с увеличением выделения ионов натрия и хлора и возрастанием осмотического диуреза.
В виде свечей применяется против укачивания при морской и воздушной болезнях
Применяется в качестве отхаркивающего средства, т.к. повышая щелочные резервы крови, сдвигает в щелочную сторону реакцию бронхиальной слизи, делая мокроту менее вязкой.
При ринитах, конъюнктивитах, стоматитах, ларингитах и т.п. применяют для полосканий, промываний, ингаляций 0,5 — 2% р-ры гидрокарбоната натрия.
Применяется внутривенно с целью быстрого устранения метаболического ацидоза во время реанимационных мероприятий, заболеваниях почек.
Нужно иметь ввиду, что в результате применения может возникнуть т.н. кислотный рикошет (при реакции содой с соляной кислотой происходит выделение CO2, который оказывает раздражающее действие на стенку желудка, усиливая выделение гастрина).
В альтернативной медицине питьевая сода иногда заявляется как «лекарство» от рака, однако, никакой экспериментально подтверждённой эффективности применения такого «лечения» не существует.
Противопоказания к применению в медицинских целях
Индивидуальная гиперчувствительность; состояния, сопровождающиеся развитием алкалоза; гипокальциемия, при приеме внутрь усиливает алкалоз и повышает риск развития тетанических судорог, гипохлоремия — снижение концентрации в крови ионов Cl — , в том числе вызванная рвотой, или снижением всасывания в желудочно-кишечном тракте, может привести к тяжёлому алкалозу.
Является источником натрия, тем самым увеличивая объём циркулирующей крови, усугубляя отёки и повышая артериальное давление. Применение при сниженной скорости клубочковой фильтрации может привести к метаболическому алкалозу.
Пожаротушение
Гидрокарбонат натрия вместе с карбонатом аммония используется в качестве наполнителя в огнетушителях с сухим наполнением и в стационарных системах сухого пожаротушения. Это применение обусловлено тем, что от воздействия высокой температуры в очаге горения вещество выделяет углекислый газ, атмосфера которого затрудняет доступ кислорода воздуха в очаг горения.
В быту
Применяется как безопасное для здоровья средство для чистки поверхностей столовой и кухонной посуды, поверхностей кухонных столов, иных поверхностей, соприкасающихся с пищей, путем протирки их с помощью влажной тряпки с сухим порошком питьевой соды.
В транспорте
Применяется для нейтрализации следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцовых аккумуляторов насыщенным водным раствором питьевой соды.
Производство
В Российской Федерации двууглекислый натрий выпускается в соответствии с требованиями и техническими условиями, выпускается на предприятиях АО «Башкирская содовая компания» в г. Стерлитамак, Республика Башкортостан, а также на Крымском содовом заводе в г. Красноперекопск, Крымский полуостров.
Хранение
Гидрокарбонат натрия хранят в закрытых упаковках, в сухом месте вдали от источников огня. Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления. Срок годности не ограничен.
Безопасность
Вещество нетоксично, пожаро- и взрывобезопасно.
Имеет солоноватый, мыльный вкус. При попадании пыли вещества на слизистые оболочки глаз и носа вызывает лёгкое раздражение. При частой работе в атмосфере, загрязнённой пылью двууглекислого натрия, может возникнуть раздражение верхних дыхательных путей. Предельно допустимая концентрация пыли бикарбоната натрия в воздухе производственных помещений 5 мг/м 3 .
- ГОСТ 2156-76. Натрий двууглекислый. Технические условия (с Изменениями № 1, 2, 3, 4).
- ГОСТ 32802-2014. Добавки пищевые. Натрия карбонаты E500. Общие технические условия.
Растворяется ли пищевая сода в воде? Свойства и применение соды
Некоторые вещества, имеющиеся в любом доме, таят в себе множество полезных и не всегда общеизвестных свойств. Например, обыкновенная сода, которая есть у любой хозяйки. Каковы её свойства, растворяется ли пищевая сода в воде, как её можно применять? Ниже мы ответим на эти вопросы.
Общие сведения
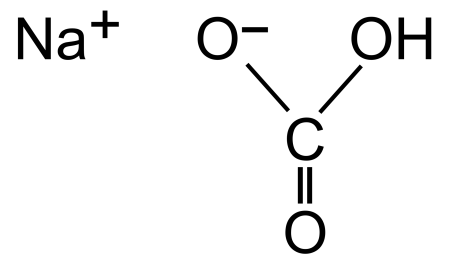
Сода — это общее название для всех натриевых солей угольной кислоты. Химическое название пищевой соды – бикарбонат натрия, гидрокарбонат натрия, питьевая сода, натрий двууглекислый (не путать с карбонатом натрия – кальцинированной содой с формулой Na2CO3). Формула соды питьевой — NaHCO3. Она представляет собой порошок из мельчайших кристаллов белого цвета с солоноватым вкусом.
Природную соду добывают из минерала трона, а также из воды некоторых озёр. Однако содовых озер, равно как и минерала, из которого её получают, мало. В наше время большая часть двууглекислого натрия производится на заводах. Началось искусственное изготовление пищевой соды с 1861 года.
Некоторые химические свойства соды
Несмотря на щёлочные свойства раствора соды, например, нейтрализацию кислот, химически она является солью (кислая соль натрия и угольной кислоты). Она взрывобезопасна, не воспламеняется при обычных условиях, не обладает токсичностью. В растворах кислот сода разлагается на новые кислые соли, углекислый газ и воду.
Растворяется ли пищевая сода в воде
Как уже было сказано, в кислотах сода не растворяется полностью, а превращается в другие вещества. А растворяется ли пищевая сода в воде? Ответ – да, хорошо растворяется с образованием других веществ. Вообще лучше взаимодействует сода с горячей водой, в холодной она мало растворима. У водного раствора двууглекислого натрия слабощелочная реакция. Характерный шипящий звук при растворении соды происходит из-за выделения углекислого газа. Формула реакции соды с водой: NaHCO3 + H2O ↔ H2CO3 (H2O + CO2) + NaOH. То есть при взаимодействии с водой двууглекислый натрий распадается на гидроксид натрия, который и придает щёлочность воде, и угольную кислоту, которая, в свою очередь, сразу же распадается на воду и углекислый газ.
Ниже приведены значения растворимости гидрокарбоната натрия в воде разной температуры в процентах (условно взят 1 грамм соды на 100 граммов воды):
- 6,9 — 0°C;
- 8,2 — 10°C;
- 9,6 — 20°C;
- 10,4 — 25°C;
- 11,1 — 30°C;
- 12,7 — 40°C;
- 16,4 — 60°C;
- 20,2 — 80°C;
- 24,3 — 100°C.
Опыты с содой
В домашних условиях можно провести ряд познавательных опытов с содой, демонстрирующих её свойства. Они будут интересны и детям, и взрослым любителям химии. Понадобятся пищевая сода и кислота (раствор лимонной кислоты — 1-2 чайные ложки на стакан воды или 9% столовый уксус).
- На одну треть заполнить кислотой бутылку. Засыпать в воздушный шарик соду, это можно сделать с помощью воронки. На горлышко бутылки надеть шарик и начать высыпать из него соду в кислоту. Шарик станет надуваться углекислым газом из бутылки, образующимся в результате взаимодействия соды и кислоты.
- Налить в стеклянную емкость горячую воду, насыпать туда побольше соды (например, 15 ложек на стакан) и размешивать, пока она не закончит растворяться. Привесить на нитку любой небольшую вещь, закрепить нитку снаружи, а предмет погрузить в приготовленный раствор. Примерно через сутки предмет начнет покрываться содовыми кристаллами.
- Взять пачку соды (или чуть больше) и пену для бритья, тщательно их перемешать. Должна получиться не очень липкая, но держащая форму масса. Из этого «искусственного снега» можно слепить снеговичка или любые другие новогодние декорации. При высыхании он становится рассыпчатым, поэтому, если свойства массы нужно сохранить подольше, её хранят в холодильнике.
Применение соды в быту
Конечно, главное применение пищевая сода в домашнем хозяйстве находит в приготовлении пищи. Соду, гашенную уксусом, используют для выпечки – тесто получается пышное и мягкое. С её помощью можно приготовить и домашний лимонад.
Но есть и другие способы её использования, так как двууглекислый натрий обладает дезинфицирующими свойствами и способен устранить неприятные запахи.
- Чтобы очистить и избавить от бактерий холодильник, можно изнутри мыть его теплым раствором соды (столовая ложка на литр теплой воды).
- Чтобы дезинфицировать сантехнику, сода наносится на её поверхности. Затем следует протереть их влажной тканью или губкой, и сполоснуть водой.
- Существует рецепт пасты с содой, очищающей предметы и поверхности от жира и въевшейся грязи, а также известкового налета. Необходимо взять 50 грамм детского мыла (в брусках), 550 миллилитров воды, полторы столовые ложки горчичного порошка и столько же соды. Мыло натереть на крупной терке и налить в него немного горячей воды. Помешивать, нагревая и вливая постепенно оставшуюся воду, пока мыло не растворится. Туда же насыпать соду. Когда раствор чуть остынет, добавить горчичный порошок и взбить смесь.
- Чтобы очистить стены от плесени и грибка, нужно помыть пораженные поверхности концентрированным раствором соды. Выдержать некоторое время, затем смыть раствор чистой водой. После стену сушат и заново красят.
- Чтобы почистить алюминиевую посуду, нужно добавить чайную ложку соды в литр воды и залить этим раствором посуду. Промывать после чистки теплой водой.
- Загрязненные участки эмалированной посуды протирают сухим порошком соды при помощи губки. Нужно помнить, что сода может оставлять мелкие царапины на эмали.
- Обезжиривающий эффект соды используют при мытье жирной посуды её водным раствором. Также она способна устранять чайный налет.
Для чистки деревянных изделий соду не используют, потому что дерево под её действием становится красноватого оттенка.
Применение соды для лечения
Лечебные свойства соды пищевой основаны на свойственных ей дезинфекции и нейтрализации кислот.
Несмотря на всю полезность соды, использовать её нужно с осторожностью. Постоянное употребление её внутрь ведет к нарушениям работы желудочно-кишечного тракта. Двууглекислый натрий нейтрализует кислоты, следовательно, снижает кислотность желудочного сока, в результате чего возникают проблемы с перевариванием и усвоением пищи, и все вытекающие отсюда последствия. Некоторые употребляют соду для похудения, но в данном случае оно будет сопряжено с ухудшением здоровья. А введения раствора соды в виде инъекций тем более опасно для человека и совершенно недопустимо.
Рецепты домашней медицины
- При боли в горле применяют полоскание раствором соды (чайная ложка на 250 грамм теплой воды). При воспалениях десен, слизистой полости рта и боли в зубах также можно облегчить симптомы этим средством.
- Фурункулы лечат при помощи примочек с концентрированным содовым раствором, а мозоли – ванночками из соды и горячей воды.
- Если кашицу из соды и воды нанести на укушенное насекомыми место, то уменьшится зуд. Вода должна быть прохладной, так как на вопрос: «Растворяется ли пищевая сода в воде?» уже был дан ответ, что в горячей и теплой воде она растворяется хорошо, и кашица в таком случае не получится.
- Для избавления от изжоги размешивают соду в теплой воде из расчета 1 чайная ложка на стакан. Выпивают залпом. Злоупотреблять этим не нужно, и если есть другие антацидные средства, лучше принять их. Как крайне редкий, но имевший место побочный эффект описывают разрыв желудка, произошедший в результате резкого высвобождения газов после приема соды (как было сказано выше, в результате взаимодействия соды с водой и кислотами выделяется углекислый газ). Поэтому может быть и отрыжка после приема содового раствора.
Рецепты для красоты
Также двууглекислый натрий используют в косметологических целях.
- Для пилинга лица и очищения кожных пор небольшое количество соды добавляется в привычную порцию средства для умывания, которое наносят на кожу круговыми движениями, не втирая. Средство сразу смывается теплой водой. В результате отшелушиваются ороговевшие клетки кожи.
- Чтобы сделать скраб для тела, нужно смешать две столовые ложки соды с увлажняющим средством (молочком, лосьоном). На мокрую кожу при помощи мочалки нанести смесь на тело. Это средство смягчает кожу и успокаивает раздражения от бритья.
- Содовый раствор способен устранить отечность и круги под глазами. Смоченные им ватные диски кладут на веки и выдерживают около 15 минут.
- От угрей и прыщей применяют маску: смешивают столовую ложку муки, пол чайной ложки соды и немного воды так, чтобы получилась кашица. Полученную смесь наносят на лицо на 10-20 минут, затем смывают теплой водой.
- Волосы станут мягкими и блестящими, если их шампунем или кондиционером с добавлением в бутылку столовой ложки соды.
Применение пищевой соды в промышленности
Кроме повседневного домашнего использования, соду применяют в химической промышленности, где с её помощью производят краски, пенопласт, реактивы, бытовую химию, огнетушители. В лёгкой промышленности она участвует в изготовлении резиновых подошв, искусственной кожи, а также обработке натуральной кожи, в отделке шелка и хлопчатобумажных тканей. В медицине и фармацевтике сода используется для понижения кислотности желудочного сока и нейтрализации при ожогах кожи кислотами.
В пищевой промышленности, как и в домашней кулинарии, её добавляют в хлебобулочные и кондитерские изделия, а также при изготовлении напитков.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://fb.ru/article/360576/rastvoryaetsya-li-pischevaya-soda-v-vode-svoystva-i-primenenie-sodyi http://acetyl.ru/o/qy50.php |