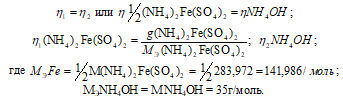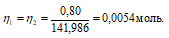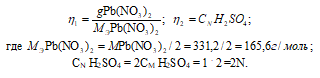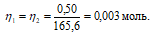Гидроксид аммония + серная кислота?
Химия | 1 — 4 классы
Гидроксид аммония + серная кислота.
В результате реакции гидроксида аммония (NH4OH) с серной кислотой (H2SO4) образуется сульфат аммония ((NH4)2SO4) и вода (H2O).
Что общего между сернистой кислотой и гидроксидом аммония?
Что общего между сернистой кислотой и гидроксидом аммония.
Напишите уравнения осуществимых реакций между ; а) селикатом натрия и хлоридом кальция б) сульфидом натрия и серной кислотой в) гидроксидом меди (II) и серной кислотой г) оксидом меди (II) и соляной к?
Напишите уравнения осуществимых реакций между ; а) селикатом натрия и хлоридом кальция б) сульфидом натрия и серной кислотой в) гидроксидом меди (II) и серной кислотой г) оксидом меди (II) и соляной кислотой д) нитратом калия и гидроксидом натрия е) нитратом аммония и азотной кислотой.
Напишите молекулярное и ионно — молекулярное уравнение реакции взаимодействия :ортофосфорной кислоты с одним моль гидроксида калия ;гидроксида калия с ортофосфорной кислотой ;серной кислоты с хлоридом?
Напишите молекулярное и ионно — молекулярное уравнение реакции взаимодействия :
ортофосфорной кислоты с одним моль гидроксида калия ;
гидроксида калия с ортофосфорной кислотой ;
серной кислоты с хлоридом бария ;
серной кислоты с гидроксидом аммония ;
сульфата меди с гидроксидом натрия ;
нитрата серебра и хлорида натрия.
GaOHSO4 + H2SO4 = N2O5 + Ca(OH)2 = SnO + NaOH = сульфид лития + серная кислота = сероводород + гидроксид аммония = нитрат цинка + серная кислота = гидроксосульфат хрома (III) + серная кислота = уксусн?
GaOHSO4 + H2SO4 = N2O5 + Ca(OH)2 = SnO + NaOH = сульфид лития + серная кислота = сероводород + гидроксид аммония = нитрат цинка + серная кислота = гидроксосульфат хрома (III) + серная кислота = уксусная кислота + гидроксид аммония = помогите плизззз.
С образованием осадка протекает реакция между растворами : А) сульфата аммония и гидроксида натрия Б) хлорида бария и нитрата серебра В) гидроксида натрия и серной кислоты Г) карбоната натрия и азотно?
С образованием осадка протекает реакция между растворами : А) сульфата аммония и гидроксида натрия Б) хлорида бария и нитрата серебра В) гидроксида натрия и серной кислоты Г) карбоната натрия и азотной кислоты.
Рассчитайте массовые доли элементов, входящих в состав : а)серной кислоты б)ортофосфорной кислоты в)гидроксида меди 2 г)бромида аммония?
Рассчитайте массовые доли элементов, входящих в состав : а)серной кислоты б)ортофосфорной кислоты в)гидроксида меди 2 г)бромида аммония.
1 гидроксид кальция + соляная кислота — 2 фосфорная кислота + гидроксид калия — 3 гидроксид железа (III) + соляная кислота — 4 гидроксид цынка + серная кислота — 5 серная кислота + гидроксид алюминия ?
1 гидроксид кальция + соляная кислота — 2 фосфорная кислота + гидроксид калия — 3 гидроксид железа (III) + соляная кислота — 4 гидроксид цынка + серная кислота — 5 серная кислота + гидроксид алюминия — 6 гидроксид магния + фосфорная кислота — 7 серная кислота + гидроксид лития -.
Все соли аммония одинаковым образом реагируют с раствором : а) нитрата серебра б) гидроксида натрия в) хлорида бария г) серной кислоты?
Все соли аммония одинаковым образом реагируют с раствором : а) нитрата серебра б) гидроксида натрия в) хлорида бария г) серной кислоты.
Напишите молекулярные и ионные уравнения между растворами?
Напишите молекулярные и ионные уравнения между растворами.
1)гидроксида лития и серной кислоты.
2)бромида аммония и гидроксида натрия.
3)нитрата алюминия и гидроксида калия.
4)карбоната лития и азотной кислоты.
Напишите молекулярные и ионные уравнения между растворами?
Напишите молекулярные и ионные уравнения между растворами.
1)гидроксида лития и серной кислоты.
2)бромида аммония и гидроксида натрия.
3)нитрата алюминия и гидроксида калия.
4)карбоната лития и азотной кислоты.
На этой странице вы найдете ответ на вопрос Гидроксид аммония + серная кислота?. Вопрос соответствует категории Химия и уровню подготовки учащихся 1 — 4 классов классов. Если ответ полностью не удовлетворяет критериям поиска, ниже можно ознакомиться с вариантами ответов других посетителей страницы или обсудить с ними интересующую тему. Здесь также можно воспользоваться «умным поиском», который покажет аналогичные вопросы в этой категории. Если ни один из предложенных ответов не подходит, попробуйте самостоятельно сформулировать вопрос иначе, нажав кнопку вверху страницы.
Na2O2 + 2Na = 2Na2O Na2O + H2O = 2NaOH FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl 2NaCl + BaSO4 = Na2SO4 + BaCl2 BACL2 + 2H2O = BA(OH)2 + 2HCL Fe(NO3)2 + Ba(OH)2 = Fe(OH)2 + Ba(NO3)2 Fe(OH)2 = FeO + H2O FeO + H2SO4(разб. ) = FeSO4 + H2O FeSO4 + H2 = H2SO4 + F..
А)по закону разбавлении w1m1 = w2m2 240·8 = x·274 x = 7% б) 1)Находим массу соли в исходном растворе 240·0, 08 = 19, 2г 2) масса соли в новым растворе , после добавлении карбоната калии 34 + 19, 2 = 53, 2 3) Общая масса нового раствора 240 + 34 = 274..
Mr(K3PO4) = 3 * 39 + 31 + 4 * 16 = 212 W(K) = 117 / 212 = 0. 55 = 55%.
С основными оксидами.
BaO не реагирует с основными оксидами и с основаниями.
2Na + CL2 = 2NaCL H2 + CL2 = 2HCL 2NaBr + CL2 = 2NaCL + Br2 2KI + CL2 = 2KCL + I2 2) 2Na + 2H2O = 2NaOH + H2 2NaOH + FeCL2 = Fe(OH)2 + 2NaCL Fe(OH)2 = FeO + H2O FeO + 2HCL = FeCL2 + H2O.
1) СН3 — СН(ОН) — СН(СН3) — С(СН3)(С2Н5) — СН2 — СН3 2) СН3 — СН(ОН) — СН(С2Н5) — СН(СН3) — СН2 — СН2 — СН3 3) СН3 — СН2 — С(СН3)(СН3) — СОН 4) СН3 — СН2 — СН(С2Н5) — СН2 — СН(С2Н5) — СОН 5) СН3 — СН(СН3) — СН(СН3) — С(СН3)(С2Н5) — СН2 — СООН 6) СН3 ..
В 1 моль ортофосфата натрия содержится 69 г натрия, то 23 г его будет содержаться в 1 / 3 моль данного вещества.
Наверное так) удачи ).
Пожалуйста здесь электронный бананс можно ещё электонно — ионный написать.
Исследование сульфат железа(II)-диаммония и нитрата свинца
Осаждение сульфат железа(II)-диаммония
Задача 139.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество (NH4)2Fe(SO4)2, навеска массой 0,80г; осадитель NH4OH, концентрация 2М.
Решение:
Схема реакции осаждения:
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то
Согласно закону равенства эквивалентов:
Теперь рассчитаем объём раствора NH4OH, теоретически необходимый для осаждения 0,80г (NH4)2Fe(SO4)2 из пропорции:
1000 : 2 = х : 0, 0054;
х = (0,0054 . 1000)/2 = 2,7см 3 .
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём NH4OH, необходимый для осаждения:
V(NH4OH) = (1,5 . 2,7) = 4,05см 3 .
Условия осаждения:
Определение осложняется тем, что Fe(OH)2 — аморфное соединение, склонено к уплотнению, что затрудняет последующее отмывание осадка, кроме того при стоянни увеличивается количество примесей, адсорбированных развитой поверхностью аморфного осадка. Fe(OH)2 на воздухе быстро окисляется до Fe(OH)3, поэтому его отфильтровывают сразу же после осаждения и кратковременного отстаивания.
Необходимые условия осаждения:
- Осаждение ведут в присутствии подходящего электролита-коагулятора (обычно это соли аммония), из нагретого анализируемого раствора нагретым раствором осадителя.
- Осаждение ведут из достаточно кон¬центрированного исследуемого раствора концентрированным раствором осадителя.
- Медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка.
- Повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(NH4OH) = 4,05см 3 .
Осаждение нитрата свинца
Задача 140.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество Pb(NO3)2, навеска массой 0,50г; осадитель H2SO4, концентрация 1М.
Решение:
Уравнение реакции осаждения:
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то n1 = n2.
Согласно закону равенства эквивалентов:
Теперь рассчитаем объём раствора H2SO4, теоретически необходимый для осаждения 0.50г Pb(NO3)2 из пропорции:
1000 : 2 = х : 0,003;
х = (0.003 . 1000)/2 = 1,5см 3 .
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём H2SO4, необходимый для осаждения:
V(H2SO4) = (1,5 . 1,5) = 2,25см 3 .
Условия осаждения:
Определение осложняется тем, что PbSO4 склонен к образованию очень мелких кристаллов, проходящих через поры фильтра, что затрудняет фильтрование и приводит к потерям. Поэтому в начале осаждения создают условия, обеспечивающие получение крупных кристаллов:
- медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка;
- при осаждении PbSO4 к раствору добавляют небольшое количество НС1, что повышает растворимость осадка;
- повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Соли аммония: получение и химические свойства
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
http://buzani.ru/zadachi/analiticheskaya-khimiya/1471-gidroksid-ammoniya-i-sernaya-kislota-kak-osaditeli-zadachi-139-140
http://chemege.ru/soli-ammoniya/