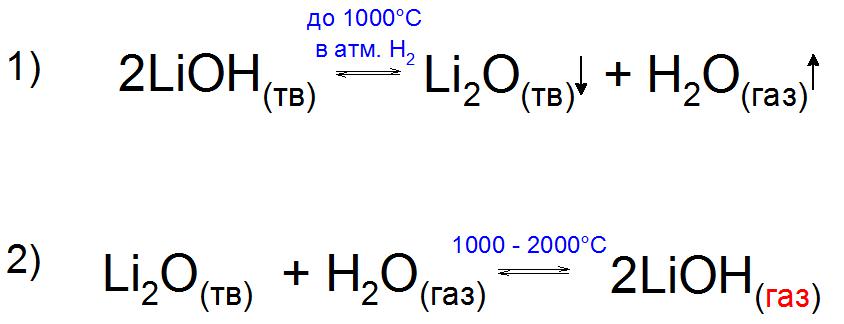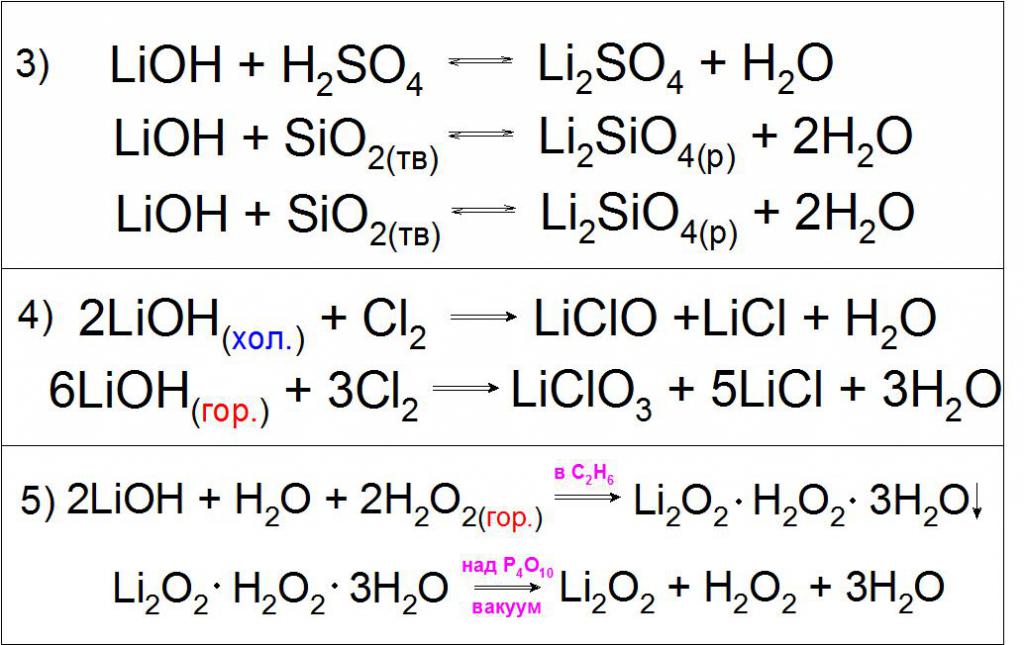Гидроксид лития: способы получения и химические свойства
Гидроксид лития при стандартных условиях представляет собой бесцветные кристаллы. Растворяется в воде.
Относительная молекулярная масса Mr = 23, 95; относительная плотность для тв. и ж. состояния d = 1, 46; tпл = 471◦ C;
Способы получения
1. Гидроксид лития получают электролизом раствора хлорида лития :
2LiCl + 2H2O → 2LiOH + H2 + Cl2
2. При взаимодействии лития, оксида лития, гидрида лития и пероксида лития с водой также образуется гидроксид лития:
2Li + 2H2O → 2LiOH + H2
Li2O + H2O → 2LiOH
2LiH + 2H2O → 2LiOH + H2
3. Карбонат лития при взаимодействии с гидроксидом кальция образует гидроксид лития:
Качественная реакция
Качественная реакция на гидроксид лития — окрашивание фенолфталеина в малиновый цвет .
Химические свойства
1. Гидроксид лития реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2. Гидроксид лития реагирует с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3. Гидроксид лития реагирует с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
4. С кислыми солями гидроксид лития также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
5. Гидроксид лития взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и водорода:
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида лития:
Сера взаимодействует с гидроксидом лития только при нагревании:
6. Гидроксид лития взаимодействует с амфотерными металлами , кроме железа и хрома. При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2LiOH + 2Al + 6Н2О = 2Li[Al(OH)4] + 3Н2
7. Гидроксид лития вступает в обменные реакции с растворимыми солями .
Хлорид меди (II) реагирует с гидроксидом лития с образованием хлорида лития и осадка гидроксида меди (II):
2LiOH + CuCl2 = Cu(OH)2↓+ 2LiCl
Также с гидроксидом лития взаимодействуют соли аммония .
Например , при взаимодействии хлорида аммония и гидроксида лития образуются хлорид лития, аммиак и вода:
NH4Cl + LiOH = NH3 + H2O + LiCl
8. Гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Гидроксид лития проявляет свойства сильного основания. В воде практически полностью диссоциирует , образуя щелочную среду и меняя окраску индикаторов.
LiOH ↔ Li + + OH —
10. Гидроксид лития в расплаве подвергается электролизу . При этом на катоде восстанавливается сам литий, а на аноде выделяется молекулярный кислород:
4LiOH → 4Li + O2 + 2H2O
Гидроксид кальция оксид лития уравнение
Вопрос по химии:
Напишите уравнения возможных реакций :
1)гидроксид кальция+оксид лития
2)гидроксид бария +оксид фосфора (V)
3)гидроксид калия+оксид алюминия
4)гидроксид натрия +сульфат бария
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Гидроксид лития. Примеры химических реакции, а также физические свойства щелочи и ее особенности
Что такое гидроксид лития? Это соединение является одним из важнейших термоустойчивых соединений, используемых в производстве для получения различных солей лития. Ионы этого элемента обладают рядом характерных особенностей, которые нашли свое широкое применение в химическом производстве.
Особенности строения атома лития
Литий (Li) является элементом I группы основной подгруппы 2-го периода, и относится к группе щелочных металлов. Его часто называют переходным к щелочноземельным элементам, поскольку он имеет немного меньшую активность, чем следующие представители этой группы, например, натрий (Na) или калий (K).
Атом лития обладает самым маленьким радиусом среди всех щелочных металлов, что обуславливает его химическую активность. Также особую роль играет предшествующая валентному электрону 2s 1 устойчивая электронная оболочка 1s 2 типа гелия, которая создает высокую поляризуемость частицы.
Это свойство лития характеризует возникновение электромагнитных или дипольных полей вокруг атома, что позволяет создавать прочные комплексные ионы вроде [Li(NH3)n] + . Стоит отметить, что при таких свойствах сам атом не подвержен поляризации, что объясняет термическую неустойчивость некоторых его солей, в особенности с комплексными анионами.
Все вышеперечисленные факты объясняют некоторые особенности в физических и химических свойствах гидроксида лития (LiOH).
Физические свойства
Чистый LiOH – очень едкое вещество, способное разрушить стекло и фарфор, поэтому его хранят в парафинированных сосудах. В расплавленном состоянии его можно получить только в никелевых или серебряных сосудах, так как он окисляет большинство металлов и сплавов. Золото является одним из немногих веществ, устойчивых к влиянию подобного соединения.
Само основание, по сравнению с окисью Li2O, химически неустойчиво и уже ближе к 1000 °C в атмосфере водорода H2 разлагается на составляющие (пример 1).
Оксид лития и гидроксид лития в химически чистом состоянии являются твердыми веществами, относительно растворимы в воде, но менее (почти в 5 раз), чем аналогичные соединения следующих представителей группы. Высшая точка растворения у описываемого основания приходится при 100 °C – 17,5 г/100 г растворителя, тогда как, например, у гидроксида натрия (NaOH) — 337 г/100 г и продолжает расти с повышением температуры. В то же время растворимость гидроксида лития практически в 100 раз больше растворимости гашеной извести (Ca(OH)2), у которой такая способность снижается с повышением температуры.
Интересно, что экспериментально удалось получить газообразный LiOH в присутствии паров воды. Его получают путем нагревания оксида Li до 2000 °C, когда после рубежа в 1000 °C давление пара этого соединения увеличивается за счет образования устойчивого родственного основания (пример 2).
Химические свойства
Гидроксид лития кислотой не считается, так как не является амфотерным элементом и не проявляет способности к распаду по типу MeOH ↔ MeO — + H + (где, Me — любой металл I или II группы основной подгруппы), как и другие представители щелочных металлов. Про такие соединения говорят, что они являются очень сильными основаниями, так как константа их диссоциации по принципу MeOH ↔ Me + + OH — очень высокая (Кb, LiOH = 6,75 · 10 -1 ).
Поскольку подобное соединение проявляет сильные основные свойства, оно может вступать в реакции нейтрализации с кислотами, кислотными оксидами и обмена с различными солями (пример 3).
Также характерной реакцией является взаимодействие холодных и горячих концентрированных растворов гидроксида лития с газообразным хлором с образованием гипохлоритов и хлоратов лития (пример 4).
Особенностью данного основания является взаимодействие с горячим раствором перекиси водорода H2O2 с образованием кристаллогидрата перекисного лития Li2O2 в среде этанола, разделяемый в вакууме (пример 5).
Получение
LiOH получают различными способами, одним из которых является непосредственное взаимодействие металла или его оксида с водой по схеме литий → оксид лития → гидроксид лития.
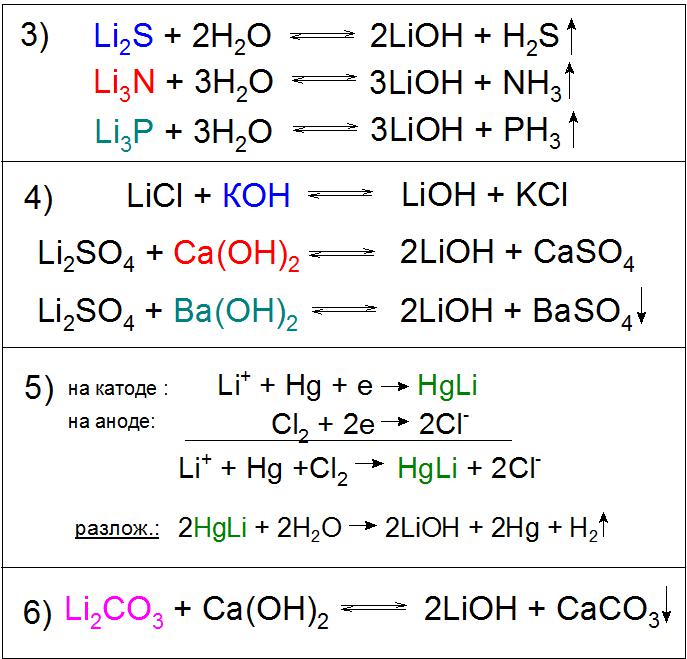
Также применяется гидролиз сульфида, нитрида, фосфидов и других соединений (пример 3).
Реакции обмена растворов солей лития возможны практически с любыми основаниями, например гидроксидом калия (KOH), кальция (Ca(OH)2) и бария (Ba(OH)2), причем с последним реагентом химическое взаимодействие идет практически до конца с сульфатом Li. В первом и втором случае реакция будет оправдана за счет плохой растворимости получаемых солей в растворе LiOH (пример 4), а в третьем — к этому прибавится нерастворимое в воде BaSO4 (пример 4). Стоит отметить, что последний вариант не используется на производстве по экономическим соображениям.
Еще одним примечательным методом получения данного соединения является электролиз раствора хлорида лития LiCl на ртутном катоде. При этом образуется амальгама HgLi, интересная тем, что температура ее плавления гораздо выше (609 °C), чем любого ее компонента. В процессе разложения водой полученного соединения образуется необходимое основание (пример 5).
Особенное промышленное значение имеет реакция разложения карбоната лития гашеной известью, в ходе которого химическое равновесие искусственно сдвигается в правую сторону для более высокого выхода основного продукта (пример 6).
Применение
Гидроксид лития используется при получении стеаратов этого металла для производства водоупорных морозо- и термостойких смазочных материалов. Также применяется в качестве катализатора при изготовлении полимерных материалов и как компонент электролита в различных аккумуляторах.
В пожарной и военной практике гидроксид лития используется как поглотитель углекислого газа (CO2) в противогазах.
http://online-otvet.ru/himia/5cea9d1496f4e19a2952a07c
http://www.syl.ru/article/379807/gidroksid-litiya-primeryi-himicheskih-reaktsii-a-takje-fizicheskie-svoystva-schelochi-i-ee-osobennosti