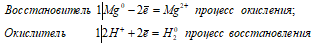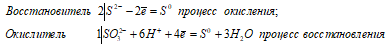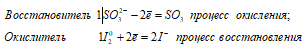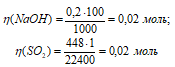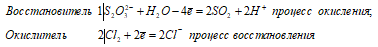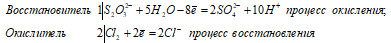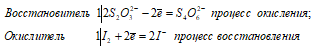Гидроксид магния: способы получения и химические свойства
Гидроксид магния Mg(OH)2 — неорганическое соединение. Белый, при нагревании разлагается. Не растворяется в воде. Проявляет основные свойства.
Относительная молекулярная масса Mr = 58,32; относительная плотность для тв. и ж. состояния d = 2,39.
Способы получения
1. Гидроксид магния получают в результате взаимодействия хлорида магния и разбавленного раствора гидроксида натрия, на выходе образуется хлорид натрия и гидроксид магния :
MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl
2 . При взаимодействии магния с горячей водой образуется гидроксид магния и водород:
3. Нитрат магния при взаимодействии с разбавленным раствором гидроксида натрия образует нитрат натрия и гидроксид магния:
4. Сульфат магния взаимодействует с разбавленным раствором гидроксида натрия, образуя гидроксид магния и сульфат натрия:
Качественная реакция
Качественная реакция на гидроксид магния — окрашивание фенолфталеина в малиновый цвет .
Химические свойства
1. Гидроксид магния взаимодействует со сложными веществами :
1.1. Гидроксид магния реагирует с кислотами:
1.1.1. В результате реакции между гидроксидом магния и разбавленной соляной кислотой образуется хлорид магния и вода:
1.2. Гидроксид магния взаимодействует с оксидами:
В результате взаимодействия твердого гидроксида магния и углекислого газа при комнатной температуре образуется гидроксокарбонат магния и вода:
1.3. Гидроксид магния реагирует с солями :
Гидроксид магния взаимодействует с концентрированным и горячим раствором хлорида аммония , образуя хлорид магния, аммиак и воду:
2. Гидроксид магния разлагается при температуре 350 — 480º С, образуя на выходе оксид магния и воду:
Характеристика окислительно-восстановительных свойств сернистой кислоты
Задача 863.
Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при ее взаимодействии: а) с магнием; б) с сероводородом; в) с йодом? Какой из входящих в ее состав ионов обусловливает эти свойства в каждом из указанных случаев?
Решение:
а) Mg + H2SO3 ↔ MgSO3 + H2↑
Уравнения ионно-молекулярного баланса:
Mg 0 + 2H + = Mg 2+ + H2 0
Таким образом, сернистая кислота проявляет свойства окислителя, уменьшая степень окисления водорода от +2 до 0.
2S 2- + SO3 2 — + 6H + ↔ 3S 0 + 3H2O
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая свою степень окисления серы от -2 до 0.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая степень окисления серы от +4 до +6.
Тиосульфат натрия
Задача 864.
Через 100 мл 0,2 н. раствора NаОН пропустили 448 мл SO2 (условия нормальные). Какая соль образовалась? Найти ее массу.
Решение:
Уравнение реакции имеет вид:
Находим количество NaOH и SO2:
Из уравнения реакции вытекает, что из 2 молей NaOH и 1 моля SO2 образуются 1 моль Na2SO3, значит , NaOH взято в недостатке, поэтому расчет массы Na2SO3 производим по количеству NaOH. Исходя из этих рассуждений в результате реакции из 0,02 моль NaOH образовалось 0,01 моль Na2SO3.
Рассчитаем массу Na2SO3, учитывая, что М( Na2SO3) равна 126 г/моль, получим:
m( Na 2SO 3) = M( Na 2SO 3) . n( Na 2SO 3) = 126 . 0,01 = 1,26 г.
Ответ: m( Na 2SO 3) = 126 г.
Тетратионовая кислота
Написать уравнения реакций взаимодействия тиосульфата натрия: а) с хлором (при его недостатке и при его избытке); б) с йодом.
Решение:
а) Взаимодействие тиосульфата натрия с хлором (при его недостатке):
S2O3 2- + 2Cl2 0 + H2O ↔ 2SO 2 ↑ + 4Cl — + 2H +
Na 2 S 2 O 3 + 2Cl 2 + H 2 O ↔ 2NaCl + 2SO 2 ↑ + 2HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от -2 до +4.
б) Взаимодействие тиосульфата натрия с хлором (при его избытке):
S2O3 2- + 4Cl2 0 + 5H2O ↔ 2SO4 2- + 8C l- + 10H +
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O ↔ + 2H 2 SO 4 + 2NaCl + 6HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
в) Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Взаимодействие тиосульфата натрия с йодом:
2 Na 2 S 2 O 3 + I 2 ↔ Na 2 S 4 O 6 + 2NaI
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4.
Под действием слабого окислителя йода тиосульфат натрия окисляется до соли тетратионовой кислоты H 2 S 4 O 6 .
Составьте сокращенное ионно — молекулярное уравнение реакции гидроксида магния с раствором серной кислоты?
Химия | 5 — 9 классы
Составьте сокращенное ионно — молекулярное уравнение реакции гидроксида магния с раствором серной кислоты.
Сумма коэффициентов перед формулами ионов в уравнении равна : а)3 б)4 в)2 г)5.
Я это уже решила, но у меня ответы расходятся с интернетом.
Mg(OH)2 + H2SO4 = MgSO4 + H2O
Mg(OH)2 + 2H + + (SO4)2 — = Mg2 + + (SO4)2 — + H2O
Mg(OH)2 + 2H + = Mg2 + + H2O
. Составьте молекулярное и ионное уравнения реакции, протекающей при сливании растворов нитрата бария и сульфата натрия?
. Составьте молекулярное и ионное уравнения реакции, протекающей при сливании растворов нитрата бария и сульфата натрия.
В ответе укажите сумму коэффициентов левой части сокращенного ионного уравнения реакции.
Составьте молекулярные полные и сокращенные ионные уравнения реакций между растворами следующих веществ 2?
Составьте молекулярные полные и сокращенные ионные уравнения реакций между растворами следующих веществ 2.
Нитрат магния и гидроксид натрия.
Помогите пожалуйста))) №1?
Помогите пожалуйста))) №1.
Составьте уравнения реакций в молекулярной и ионной формах между : а) серной кислотой и гидроксидом натрия б) соляной кислотой и гидроксидом бария в) азотной кислотой и гидроксидом железа (III) №2.
Запишите два молекулярных уравнения реакций, сущность которых выражается сокращенным ионным уравнением Н( + ) + ОН( — ) = Н2О №3.
Составьте молекулярное и ионное уравнения реакции гидроксида бария и серной кислоты.
Составьте сокращенные ионно — молекулярное уравнение реакции углекислого газа с раствором гидроксида натрия?
Составьте сокращенные ионно — молекулярное уравнение реакции углекислого газа с раствором гидроксида натрия.
Сумма коэффициентов перед формулами ионов в уравнении равна : а) 5 ; б) 3 ; в) 2 ; г) 4 ;
Составьте молекулярное и ионное уравнения реакции, протекающей между раствором гидрокарбоната магния и соляной кислотой?
Составьте молекулярное и ионное уравнения реакции, протекающей между раствором гидрокарбоната магния и соляной кислотой.
В ответе укажите сумму коэффициентов левой части сокращенного ионного уравнения реакции.
Составьте сокращенное ионно — молекулярное уравнение реакции раствора серной кислоты с гидроксидом алюминия?
Составьте сокращенное ионно — молекулярное уравнение реакции раствора серной кислоты с гидроксидом алюминия.
Сумма коэффициентов перед формулами ионов в уравнении равна
1. Напишите молекулярное, полное и сокращенное ионные уравнения реакций между раствором Гидроксида Бария и Азотной Кислоты?
1. Напишите молекулярное, полное и сокращенное ионные уравнения реакций между раствором Гидроксида Бария и Азотной Кислоты.
2. Напишите молекулярное, полное и сокращенное ионные уравнения между растворами следующих веществ :
а) Сульфат Цинка и Нитрат Бария
б) Нитрат Магния и Гидроксид Натрия
Составьте по данным сокращенным ионным уравнениям молекулярное и полное ионное уравнения :
Напишите молекулярное и ионное уравнения реакции взаимодействия азотной кислоты с карбонатом магния?
Напишите молекулярное и ионное уравнения реакции взаимодействия азотной кислоты с карбонатом магния.
В ответе приведите сумму коэффициентов со¬кращенного ионного уравнения.
Составьте молекулярную и сокращенное ионное уравнения реакции серной кислоты и гидроксида железа 3?
Составьте молекулярную и сокращенное ионное уравнения реакции серной кислоты и гидроксида железа 3.
Напишите молекулярное, полное и сокращенное ионные уравнения реакций между следующими растворами : гидроксидом натрия и серной кислотой?
Напишите молекулярное, полное и сокращенное ионные уравнения реакций между следующими растворами : гидроксидом натрия и серной кислотой.
Если вам необходимо получить ответ на вопрос Составьте сокращенное ионно — молекулярное уравнение реакции гидроксида магния с раствором серной кислоты?, относящийся к уровню подготовки учащихся 5 — 9 классов, вы открыли нужную страницу. В категории Химия вы также найдете ответы на похожие вопросы по интересующей теме, с помощью автоматического «умного» поиска. Если после ознакомления со всеми вариантами ответа у вас остались сомнения, или полученная информация не полностью освещает тематику, создайте свой вопрос с помощью кнопки, которая находится вверху страницы, или обсудите вопрос с посетителями этой страницы.
FeCl3 + NaOH = FeOH + NaCl3 K2CO3 + HNO3 = K2NO3 + H2CO3 BaCl2 + Na2SO4 = BaSO4 + NaCl2.
Селен назван в честь Луны.
HCl ; H2SO4 ; — кислоты ; Cu(NO3)2 ; FeCl3 ; — соли ; Na2O ; BaO ; Mg(OH)2 — основные оксиды ; СО2 — кислотный оксид ; KOH — основание( гидроксид калия).
Ответ второй и четвертый.
BaCl2 + 2H2O — > Cl2 + H2 + Ba(OH)2 Ba(OH)2 + H2SO4 — > BaSO4 + 2H2O.
Рассчитывается по числу молекул. Здесь будет 5 ионов.
CO2 + H2O H2CO3 (реакция обратимая, так как кислота неустойчива) Не уверена.
http://buzani.ru/zadachi/khimiya-glinka/1282-sernistaya-kislota-zadachi-863-865
http://himia.my-dict.ru/q/576419_sostavte-sokrasennoe-ionno-molekularnoe-uravnenie-reakcii/