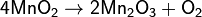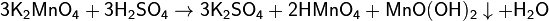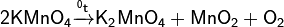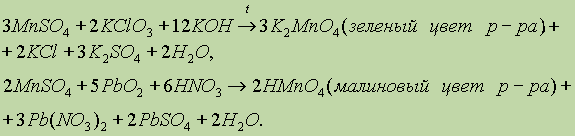Напишите уравнения реакции в ионном и молекулярном виде получения всех возможных солей, используя гидроксид марганца (2) и соляной кислоты?
Химия | 5 — 9 классы
Напишите уравнения реакции в ионном и молекулярном виде получения всех возможных солей, используя гидроксид марганца (2) и соляной кислоты.
Назовите полученные соли.
Mn(OH) + 2HCl = MnCl2 + 2H2O
Mn( + 2) + OH( — ) + 2H( + ) + 2Cl( — ) = Mn( + 2) + 2Cl( — ) + 2H2O.
Записать уравнение реакций получения всех возможных солей при взаимодействии :1) Угольной кислоты и гидроксида алюминия2) Сернистой кислоты и гидроксида магния?
Записать уравнение реакций получения всех возможных солей при взаимодействии :
1) Угольной кислоты и гидроксида алюминия
2) Сернистой кислоты и гидроксида магния.
Запишите уравнения возможных реакций между цинком соляной кислотой нитратом серебра гидроксидом натрия в молекулярном и ионном виде?
Запишите уравнения возможных реакций между цинком соляной кислотой нитратом серебра гидроксидом натрия в молекулярном и ионном виде.
Хлорид аммония 1)получение соли 2)3 уравнения реакции в молекулярном и ионном виде?
Хлорид аммония 1)получение соли 2)3 уравнения реакции в молекулярном и ионном виде.
Пожалуйста?
1 напишите уравнения реакций образования солей серной кислоты 2.
Напишите уравнения реакций получения 5 солей, которые может образовать гидроксид натрия.
Уравнение реакции получения возможных солей (их названия) при взаимодействии гидроксида кальция и ортофосфорной кислоты?
Уравнение реакции получения возможных солей (их названия) при взаимодействии гидроксида кальция и ортофосфорной кислоты.
Уравнения реакции с помощью которых кислые и основные соли можно перевести в средние.
Допишите схемы реакций получения солей и составьте уравнения реакций в молекулярной ионной и сокрошонной ионной формах я на 1КУРСЕ?
Допишите схемы реакций получения солей и составьте уравнения реакций в молекулярной ионной и сокрошонной ионной формах я на 1КУРСЕ.
Напишите уравнение реакции оксида и гидроксида с соляной кислотой в молекулярном и ионном виде?
Напишите уравнение реакции оксида и гидроксида с соляной кислотой в молекулярном и ионном виде.
Уравнение реакции получения солей при взаимодействии гидроксида цинка с соляной кислоты?
Уравнение реакции получения солей при взаимодействии гидроксида цинка с соляной кислоты.
Напишите ионно — молекулярные и молекулярные уравнения гидролиза по I ступени и укажите реакцию среды (рН) водного раствора соли хлорида марганца (II)?
Напишите ионно — молекулярные и молекулярные уравнения гидролиза по I ступени и укажите реакцию среды (рН) водного раствора соли хлорида марганца (II).
Назовите полученное соединение.
3. Напишите реакции взаимодействия соли с кислотой, соли с солью и соли со щелочью?
3. Напишите реакции взаимодействия соли с кислотой, соли с солью и соли со щелочью.
Составьте уравнения в молекулярном и ионном виде.
На этой странице сайта размещен вопрос Напишите уравнения реакции в ионном и молекулярном виде получения всех возможных солей, используя гидроксид марганца (2) и соляной кислоты? из категории Химия с правильным ответом на него. Уровень сложности вопроса соответствует знаниям учеников 5 — 9 классов. Здесь же находятся ответы по заданному поиску, которые вы найдете с помощью автоматической системы. Одновременно с ответом на ваш вопрос показаны другие, похожие варианты по заданной теме. На этой странице можно обсудить все варианты ответов с другими пользователями сайта и получить от них наиболее полную подсказку.
Вода – слабый электролит, диссоциирующий на ионы H + и OH — — анионы. Этому процессу соответствует константа диссоциации воды : д * [H2O] = К H2O = [H + ] [OH — ] – ионное произведение воды, К H2O = 1 * 10 — 14 (при 25° С) К H2O – величина постоянна..
1. Литий — Li + 3 Li )2ē )1ē ē = 3, p = 3, n = 4 Находится в I группе, А подгруппе, II периоде. 2. Металл 3. Li Be 5. Высший оксид — Li2O — основный 6. Высший гидроксид — LiOH — щелочь 7. Летучего водородного соединения не образует..
Нет, там за каждый элемент ставится определенное кол — во баллов. На Решу ОГЭ вариант открой, после внизу страницы нажми «сохранить», далее будет написано, как оценивается каждое задание из 2 части.
2. Дано : ω(Е) = 91, 18% Знайти : Е — ? Ω(Н) = 100% — 91, 18% = 8, 82% Загальна формула сполуки ЕН3 Мг(ЕН3) = 3 / 0, 0882 = 34 Аг(Е) = 34 — 3 = 31⇒Р — Фосфор 2. Дано : m(Me(NO3)3 = 42. 6 r m(Me(OH)3 = 15. 6 r Знайти : Ме — ? Формула солі — ? 42..
Химия — это наука о веществах и их превращениях в другие вещества.
2Fe2O3 + 3C = 4Fe + 3CO2 реакция замещения Fe2O3 + 6HCl = 2FeCl3 + 3H2O реакция обмена H2CO3 = H2O + CO2 реакция разложения 3Mg + N2 = Mg3N2 реакция соединения.
HCl + NH3 = NH4Cl n(HCl) = n(NH4Cl) = 11200 дм3 / 22, 4 дм3 / моль = 500 моль m(NH4Cl) = 500 моль * 56, 5 г / моль = 28250 г = 28, 250 кг.
H2SO3 = H + HSO3 = 2H + SO3 AL(NO3)3 = AL + 3NO3.
Твердое ; желтого или зелено желтого цвета ; запах есть, непластичное и хрупкоев S8моноклинном виде и пластичное в S6 и S4 — пластические виды серы, получаются при нагревании ; в воде нерастворимо ; T кип = + 444 С Т плав = + 112С ; плотность = 2070 ..
A) Li + Cl2 = LiCl2 b)Li + S = v) g)Li + O2 = LiO2 d)Li + 2HCl = LiCl + H2.
Оксиды и гидроксиды марганца
Получение марганца
Алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита:
Химические свойства
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде:
Марганец при нагревании разлагает воду, вытесняя водород:
При этом слой образующегося гидроксида марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.
C соляной и серной кислотами реагирует по уравнению:
С концентрированной серной кислотой реакция идёт по уравнению:
С разбавленной азотной кислотой реакция идёт по уравнению:
В щелочном растворе марганец устойчив.
Оксиды и гидроксида марганца
| Оксиды | MnO | Mn2O3 | MnO2 | (MnO3) | Mn2O7 |
| Свойства | ярко выраженные основные | основные | амфотерные | кислотные | Сильно кислотные |
| Гидроксиды | Mn(OH)2 | Mn(OH)3 | Mn(OH)4 H2MnO3 | H2MnO4 | HMnO4 |
| Свойства | ярко выраженные основные | основные | амфотерные | кислотные | сильно кислотные |
| Названия | гидроксид марганца (II); солиMn(II) | гидроксид марганца (III); солиMn(III) | гидроксид марганца (IV); манганаты(IV) | Марганцевая (VI) кислота; манганаты(VI) | марганцевая (VII)кислота;перманганаты |
Оксиды и гидроксиды марганца
Соединения марганца (II).Оксид и гидроксид марганца (II) проявляют только основные свойства. Они нерастворимы в воде, но легко растворяются в кислотах с образованием солей двухвалентного марганца.
Большинство солей двухвалентного марганца хорошо растворимы в воде и подвергаются гидролизу по катиону. К труднорастворимым солям относятся средние соли – сульфид, фосфат и карбонат.
В кристаллическом состоянии соли марганца (II) имеют слабо розовую окраску, в водных растворах – практически бесцветны.
Гидроксид двухвалентного марганца образуется косвенным путём – действием щёлочи на растворы солей. В момент образования образуется белый осадок (чаще наблюдаемый как телесный), который на воздухе постепенно буреет под действием кислорода воздуха:
Оксид марганца (II) MnO — твердое вещество зеленого цвета — можно получить восстановлением оксида марганца (IV) в токе водорода:
MnO2+Н2=MnO+Н2О
MnO — типичный основной оксид, с водой в реакцию не вступает. Ему соответствует гидроксид марганца (II), Mn(ОН)2, представляющий собой слабое основание. В виде осадка телесного цвета выпадает при взаимодействии щелочей с солями марганца (II):
MnСl2+2NaOH=Mn(OH)2¯+2NaCl
Mn(OH)2+2HCl=MnСl2+2H2O
Соли марганца (II), как правило, хорошо растворимы в воде, кроме Mn3(PO4)2, MnS, MnCO3.
Соединения марганца (III).Соли трёхвалентного марганца окрашены в тёмный цвет и склонны к образованию комплексных солей (ацидокомплексов). Все соли марганца (III) малоустойчивы. В кислом растворе они легко восстанавливаются до солей марганца (II). В нейтральном растворе простые соли легко гидролизуются с образованием гидроксида Mn(III), который быстро переходит на воздухе в гидроксид марганца (IV). Гидроксид марганца (III) –Mn2O3 ּН2О или MnО(OH) встречается в природе в виде минерала манганита(бурая марганцевая руда).
• В природе встречаются минералы браунит, курнакит и биксбиит — оксид марганца с различными примесями.
• Окисление оксида марганца(II):
• Восстановление оксида марганца(IV):
Соединения марганца (IV).Оксид Mn(IV) наиболее устойчивое при обычных условиях кислородное соединение марганца.MnO2 и соответствующий ему гидроксид практически нерастворимы в воде.
Получение оксида марганца 4:
· В лабораторных условиях получают термическим разложением перманганата калия.
· но реакция, в действительности, следует по уравнению:
· Также можно получить реакцией перманганата калия с пероксидом водорода.
· При температуре выше 100 °C перманганат калия восстанавливается водородом:
Химические свойства
1)При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:
2) Хлорид марганца(II) – в безводном состоянии представляет собой листочки светло-розового света и получается при обработке марганца, его оксида или карбоната сухим хлороводородом
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (по этой реакции в лабораториях получают хлор)
3) MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O (реакция идет при сплавлении)
Гидроксид марганца (IV) проявляет амфотерный характер– кислотный и основной в равн Диоксид марганца в лаборатории можно получить прокаливанием на воздухе Mn(NO3)2:
Соединения марганца (VI).Оксид шестивалентного марганца в свободном виде не выделен. Гидроксид марганца (VI) проявляет кислотный характер. свободная марганцевая (VI) кислота неустойчива и диспропорционирует в водном растворе по схеме:
Манганаты (VI) образуются при сплавлении диоксида марганца со щёлочью в присутствии окислителей и имеют изумрудно-зелёную окраску. В сильно щелочной среде манганаты (VI) довольно устойчивы. При разбавлении щелочных растворов происходит гидролиз, сопровождающийся диспропорционированием:
Манганаты (VI) – сильные окислители, восстанавливающиеся в кислой среде доMn(II), а в нейтральной и щелочной средах – доMnO2. Под действием сильных окислителей манганаты (VI) могут быть окислены доMn(VII):
При нагревании выше 500 о С манганат (VI) распадается на продукты:
манганат (IV) и кислород:
Соединения марганца (VII).Оксид марганца (VII) – Mn2O7 выделяется в виде темно-зеленой маслянистой жидкости при действии концентрированной серной кислоты на перманганат калия:
Оксид марганца (VII) устойчив до 10 о С и разлагается со взрывом по схеме:
При взаимодействии Mn2O7с водой образуется марганцовая кислотаHMnO4, которая имеет фиолетово-красную окраску:
Безводную марганцовую кислоту получить не удалось, в растворе она устойчива до концентрации 20 %. Это очень сильная кислота, кажущаяся степень диссоциации в растворе концентрации 0,1 моль/дм 3 равна 93 %.
Марганцовая кислота – сильный окислитель.Еще энергичнее взаимодействуетMn2O7, горючие вещества при соприкосновении с ним воспламеняются. Оксид марганца(VII) Mn2O7 – марганцевый ангидрид представляет собой зелено-бурое тяжелое масло, получающееся при действии концентрированной серной кислоты на твердый перманганат калия:
1)Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция:
2) При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия):
3) Под действием сильных окислителей ион Mn 2+ переходит в ион MnO4 − :

4) Перманганат калия применяется как антисептическое средство. Водные растворы его различной концентрации от 0,01 до 0,5% применяются для дезинфекции ран, полоскания горла и других антивоспалительных процедурах. Успешно 2 – 5% растворы перманганата калия употребляются при ожогах кожи (кожа подсушивается, и пузырь не образуется). Для живых организмов перманганаты являются ядами (вызывают коагуляцию белков). Их обезвреживание производят 3 %-ным раствором Н2О2, подкисленным уксусной кислотой:
5)Перманганаты как в кислой, так и в щелочной средах окисляют органические вещества:
7) Все соли марганца (II) в ОВР, протекающих в растворах, являются восстановителями:
8) Соли марганца (II) не гидролизуются, образуя прочные аквакомплексы:
9) Mn(CN)2 – нерастворимое соединение белого цвета, за счет комплексообразования растворяется в присутствии KCN:
4KCN + Mn(CN)2 = K4[Mn(CN)6] гексоцианоманганат калия
Применение цветов:
Лабораторная работа по химии на тему «Марганец и его соединения»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Марганец и его соединения
Цель работы: изучение методов получения и свойств соединений марганца; формирование навыков выполнения химического эксперимента.
Задание: экспериментально получить гидроксид марганца(II) и изучить его свойства; экспериментально изучить свойства солей марганца(II) и оксида марганца(IV); экспериментально изучить свойства перманганата калия.
Опыт 1. Получение гидроксида марганца (II) и его свойства.
А) Реакцией раствора хлорида марганца ( II ) с раствором гидроксида натрия был получен желто-розовый студенистый осадок гидроксида марганца ( II )
MnCl 2 + 2NaOH = Mn(OH) 2 ↓ + 2NaCl
Mn 2+ + 2Cl — + 2Na + + 2OH — = Mn(OH) 2 + 2Na + + 2Cl —
Mn 2+ + 2 OH — = Mn ( OH )2
Б) Часть жидкости с осадком отлили в другую пробирку и оставили стоять на воздухе, вследствие чего вещество постепенно переменило свой цвет на бурый. Причиной тому явилось окисление гидроксида марганца ( II ) кислородом воздуха в гидроксид марганца ( IV )
Mn +2 (OH) 2 + 2H 2 O – 2e = Mn +4 (OH) 4 + 2H + 4 2; Mn +2 – восстановитель ;
O 2 0 + 2H 2 O + 4e = 4O -2 H — 1; O 2 0 – окислитель .
В) К полученному в опыте А осадку гидроксида марганца ( II ) были раздельно прилиты раствор соляной кислоты и избыток раствора гидроксида натрия. В случае использования соляной кислоты наблюдалось растворение осадка
Mn ( OH )2 + 2 HCl = MnCl 2 + 2 H 2 O
Mn(OH) 2 + 2H + + 2Cl — = Mn 2+ +2Cl — + 2H 2 O
Mn ( OH )2 + 2 H + = Mn 2+ + 2 H 2 O
В случае использования гидроксида натрия видимых признаков реакции не наблюдалось. Теоретически возможно протекание реакции с образованием комплексного соединения – тетрагидроксоманганата ( II ) натрия, однако такая реакция возможна лишь в определенных жестких условиях (при использовании NaOH концентрации выше 50%, при кипении в атмосфере азота)
Mn(OH) 2 + 2Na + + 2OH — = 2Na + + [Mn(OH) 4 ] 2-
На основании проведенного опыта можно сказать, что гидроксид марганца ( II ) проявляет преимущественно основные свойства.
Г) К небольшому количеству осадка гидроксида марганца (II) была прилита бромная вода, вследствие чего наблюдалось обесцвечивание жидкости и образование темно-коричневого осадка. В ходе взаимодействия имеет место окислительно-восстановительная реакция, в которой гидроксид марганца ( II ) окисляет бромная вода. В окислительно-восстановительных реакциях гидроксид марганца ( II ) проявляет восстановительные свойства.
Mn +2 ( OH )2 – 2 e = Mn +4 O 2 + 2 H + 2 1; Mn +2 – восстановитель;
Br 2 0 + 2 e = 2 Br — 1; Br 2 0 – окислитель.
Опыт 2. Свойства солей марганца (II).
В пробирку налили 1 мл. раствора хлорида марганца и добавили к нему такой же объем раствора сульфида натрия. Наблюдалось образование светло-розового аморфного осадка сульфида марганца.
MnCl 2 + Na 2 S = MnS ↓ + 2 NaCl
Mn 2+ + 2Cl — + 2Na + + S 2- = MnS + 2Na + + 2Cl —
При стоянии на воздухе осадок буреет вследствие окисления сульфида марганца ( II ) кислородом воздуха с образованием бурого нерастворимого гидроксида марганца ( IV ). Также заметно выделение светло-желтого вещества – в ходе реакции образуется сера.
Mn +2 S -2 + 4 H 2 O – 4 e = Mn +4 ( OH )4 + S 0 + 4 H + 4 1; Mn +2 – восстановитель; S -2 – восстановитель;
O 2 0 + 2 H 2 O + 4 e = 4 O -2 H — 1; O 2 0 – окислитель.
MnS + 4H 2 O + O 2 + 2H 2 O = Mn(OH) 4 + 4OH — + 4H + + S;
Опыт 3. Взаимодействие оксида марганца (IV) с серной кислотой.
К нескольким крупинкам оксида марганца (IV) добавили 0,5 мл. концентрированной серной кислоты, пробирку со смесью нагрели, вследствие чего наблюдалась интенсивное выделение бесцветного газа. Тлеющая лучинка, внесенная в пробирку с собранным газом, разгоралась сильнее, что указывает на то, что образовавшийся газ — кислород. В ходе взаимодействия концентрированной серной кислоты с оксидом марганца ( IV ) имеет место окислительно-восстановительная реакция, в которой оксид марганца ( IV ) проявляет окислительные свойства
Mn +4 O 2 + 4 H + + 2 e = Mn +2 + 2 H 2 O 2 1; Mn +4 – окислитель;
Mn +4 O 2 -2 – 2 e = Mn +2 + O 2 0 1; O -2 – восстановитель.
Опыт 4. Свойства перманганата калия.
А) Разложение перманганата калия при нагревании.
В пробирку поместили небольшое количество кристаллов перманганата калия и нагрели пробирку на пламени спиртовки. В ходе взаимодействия выделялся бесцветный газ, который через газоотводную трубку был собран в колбу, тлеющая лучинка, внесенная в ее горло, разгоралась сильнее, что указывает на то, что выделяющийся газ — кислород. Нагревание продолжали до прекращения выделения газа.
Mn +7 + e = Mn +6 1; Mn +7 – окислитель;
Mn +7 + 3 e = Mn +4 4
2 O -2 – 4 e = O 2 0 1; O -2 – восстановитель.
После завершения реакции пробирка была охлаждена, после чего продукты реакции были растворены в воде. Сначала раствор приобрел зеленый цвет, обусловленный наличием в растворе ионов MnO 4 2- , однако, постепенно окраска раствора стала сменяться с зеленой на фиолетовую. Также наблюдалось образование темно-коричневого осадка. Манганаты устойчивы только в растворах, характеризующихся сильнощелочной средой, в иных случаях они взаимодействуют с водой с образованием перманганатов и оксида марганца ( IV )
Mn +6 O 4 2- — e = Mn +7 O 4 — 2 2; Mn +6 – восстановитель;
Mn +6 O 4 2- + 2 e + 2 H 2 O = Mn +4 O 2 + 4 OH — 1; Mn +6 – окислитель.
Б) Окислительные свойства перманганата калия. В две пробирки налили по 2 мл. раствора перманганата калия и по 2 мл. раствора серной кислоты. В первую пробирку прилили раствор сульфата железа ( II ), вследствие чего наблюдалось обесцвечивание жидкости в пробирке
Mn +7 O 4 — + 8H + + 5e = Mn +2 + 4H 2 O 10 2; Mn +7 – окислитель ;
2 Fe +2 – 2 e = 2 Fe +3 5; Fe +2 – восстановитель.
2MnO 4 — + 16H + + 10Fe 2+ = 2Mn 2+ + 8H 2 O + 10Fe 3+
Во вторую пробирку добавили раствор щавелевой кислоты. Пробирку нагрели, наблюдалось обесцвечивание раствора и выделение бесцветного газа, не поддерживающего горение
Mn +7 O 4 — + 8H + + 5e = Mn +2 + 4H 2 O 10 2; Mn +7 – окислитель ;
C 2 +3 O 4 2- – 2 e = 2 C +4 O 2 5; C 2 +3 O 4 – восстановитель.
В три пробирки налили по 2 мл. раствора перманганата калия. В первую пробирку добавили 2 мл. дистиллированной воды, во вторую – 2 мл. раствора серной кислоты, в третью – 2 мл. концентрированного раствора гидроксида натрия. В каждую пробирку добавили раствор сульфита натрия.
В первой пробирке наблюдалось обесцвечивание раствора и образование темно-коричневого осадка оксида марганца ( IV )
Mn +7 O 4 — + 2H 2 O + 3e = Mn +4 O 2 + 4OH — 6 2; Mn +7 – окислитель ;
S +4 O 3 2- + H 2 O – 2e = S +6 O 4 2- + 2H + 3; S +4 – восстановитель .
2MnO 4 2- + 4H 2 O + 3SO 3 2- + 3H 2 O = 2MnO 2 + 8OH — + 3SO 4 2- + 6H + ;
Во второй пробирке наблюдалось обесцвечивание раствора
Mn +7 O 4 — + 8H + + 5e = Mn +2 + 4H 2 O 10 2; Mn +7 – окислитель ;
S +4 O 3 2- + H 2 O – 2e = S +6 O 4 2- + 2H + 5; S +4 – восстановитель .
2MnO 4 2- + 16H + + 5SO 3 2- + 5H 2 O = 2Mn 2+ + 8H 2 O + 5SO 4 2- + 10H + ;
2MnO 4 2- + 6H + + 5SO 3 2- = 2Mn 2+ + 3H 2 O + 5SO 4 2- ;
В третьей пробирке раствор переменил свой цвет с фиолетового на зеленый
Mn +7 O 4 — + e = Mn +6 O 4 2- 2 2; Mn +7 – окислитель ;
S +4 O 3 2- + 2OH — – 2e = S +6 O 4 2- + H 2 O 1; S +4 – восстановитель .
В пробирку налили раствор хлорида марганца ( II ) и добавили по каплям раствор перманганата калия. Наблюдалось обесцвечивание раствора и образование темно-коричневого осадка оксида марганца ( IV ). В пробирку было добавлено несколько капель лакмуса, вследствие чего раствор окрасился в красный цвет, что указывает на кислую среду раствора.
Mn +7 O 4 — + 2H 2 O + 3e = Mn +4 O 2 + 4OH — 6 2; Mn +7 – окислитель ;
Mn +2 + 2 H 2 O – 2 e = Mn +4 O 2 + 4 H + 3; Mn +2 – восстановитель.
2MnO 4 — + 4H 2 O + 3Mn 2+ + 6H 2 O = 5MnO 2 + 8OH — + 12H + ;
2MnO 4 — + 4H 2 O + 3Mn 2+ + 6H 2 O = 5MnO 2 + 8H 2 O + 4H + ;
2MnO 4 — + 2H 2 O + 3Mn 2+ = 5MnO 2 + 4H + ;
В разных средах продуктами восстановления перманганата калия являются разные вещества: в нейтральной среде – оксид марганца ( II ), в кислой среде – соли марганца Mn +2 , в щелочной среде – манганат калия.
В) Влияние кислотности среды на скорость окисления.
В две пробирки налили по 3 мл. раствора бромида калия. В первую пробирку добавили 2 мл. раствора серной кислоты, во вторую – 2 мл раствора уксусной кислоты. В каждую пробирку прилили по 1 мл. раствора перманганата калия.
В обеих пробирках наблюдались схожие изменения – цвет раствора менялся с фиолетового на желто-бурый, вследствие восстановления перманганата калия и окисления бромида калия с выделением молекулярного брома. При этом в пробирке с раствором серной кислоты видимые изменения происходили с большей скоростью, чем в пробирке с уксусной кислотой.
Серная кислота создает среду гораздо более кислую, чем уксусная кислота
pH (р-ра H 2 SO 4) = — lg [ H ] = — lg (2 C м( H 2 SO 4)) = — lg (0,67) = 0,17 (учитывая разбавление раствора)
pH (р-ра CH 3 COOH ) = — lg [ H ] = — lg = — lg (1,2*10 -5 ) = 4,9 (учитывая разбавление раствора)
Относительное повышение кислотности среды объясняет большую скорость окисления бромида калия в пробирке с серной кислотой.
Mn +7 O 4 — + 8H + + 5e = Mn +2 + 4H 2 O 10 2; Mn +7 – окислитель ;
2 Br — — 2 e = Br 2 0 5; Br — – восстановитель.
2MnO 4 2- + 16H + + 10Br — = 2Mn 2+ + 8H 2 O + 5Br 2 ;
10 KBr + 16 CH 3 COOH + 2 KMnO 4 = 5 Br 2 + 12 CH 3 COOK + 2 (CH 3 COO) 2 Mn + 8 H 2 O
Mn +7 O 4 — + 8H + + 5e = Mn +2 + 4H 2 O 10 2; Mn +7 – окислитель ;
2 Br — — 2 e = Br 2 0 5; Br — – восстановитель.
2MnO 4 2- + 16H + + 10Br — = 2Mn 2+ + 8H 2 O + 5Br 2 ;
10 KBr + 16 CH 3 COOH + 2 KMnO 4 = 5 Br 2 + 12 CH 3 COOK + 2 (CH 3 COO) 2 Mn + 8 H 2 O.
Применение именно серной и уксусной кислот объясняется тем, что при их использовании мала вероятность побочных реакций. Так, если бы вместо серной кислоты применялась бы сильная соляная кислота, возможной была бы реакция
2KMnO 4 + 16HCl = 2MnCl 2 + 2KCl + 5Cl 2 + 8H 2 O
Mn +7 O 4 — + 8H + + 5e = Mn +2 + 4H 2 O 10 2; Mn +7 – окислитель ;
2 Cl — — 2 e = Cl 2 0 5; Cl — – восстановитель.
2MnO 4 2- + 16H + + 10Cl — = 2Mn 2+ + 8H 2 O + 5Cl 2 ;
2KMnO 4 + 16HCl = 2MnCl 2 + 2KCl + 5Cl + H 2 O.
http://poisk-ru.ru/s11591t2.html
http://infourok.ru/laboratornaya-rabota-po-himii-na-temu-marganec-i-ego-soedineniya-4379891.html