Опыт №49. Образование и гидролиз алкоголятов
Читайте также:
|
| Название | Учебное пособие под редакцией профессора В. Н. Кошелева Москва 2009 г. Удк 547 |
| Анкор | практикум по химии нефти-W.doc |
| Дата | 24.12.2017 |
| Размер | 4.79 Mb. |
| Формат файла |  |
| Имя файла | практикум по химии нефти-W.doc |
| Тип | Учебное пособие #12761 |
| страница | 8 из 10 |
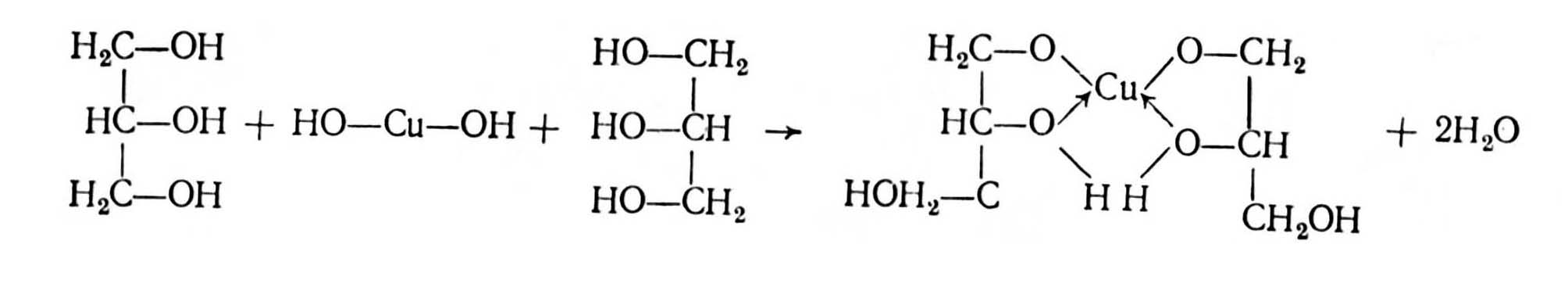
Подборка по базе: Оператор товарный — пособие.doc, ЮРИДИЧЕСКАЯ ПСИХОЛОГИЯ учебное пособие 2019.doc, Учебное пособие по английскому языку _ (ч. 1) _ учеб пособие _ И, Учебное пособие Теоретическая механика. Кинематика.PDF, Пневматика пособие.pdf, О. Ф. Алехина О. С. Гапонова основы менеджмента учебное пособие., Учебно-метод. пособие по истории 2021.pdf, учебное пособие профессиональная этика.pdf, учебное пособие по диагностике оппортунистов от 19.02.21 г..docx, Сагинова Уч пособие _zhylzhymaytyn_mulik_ekonomikasy (1).pdfОпыт 1 . Об p азование и гид p олиз алкоголятов В сухую пpобиpку помещают маленький кусочек металлического натpия. Добавляют 3 мл этилового спиpта и наблюдают за растворением натрия в спирте с выделением водорода. К образовавшемуся этилату натpия приливают в 2-3 мл дистиллиpованной воды, добавляют 1 каплю спиpтового pаствоpа фенолфталеина — появляется малиновое окpашивание. Алкоголяты — подобно солям очень слабых кислот пpи действии воды гидpолизуются с обpазованием спиpта и щелочи. Опыт 2 . Окисление этилового спи p та х p омовой смесьюОкисление спиpтов в лабоpатоpных условиях чаще всего осуществляют хpомовой смесью. В сухую пpобиpку помещают 2 мл этилового спиpта, добавляют 1 мл pаствоpа сеpной кислоты и 2 мл pаствоpа двухpомовокислого калия. Оpанжевый pаствоp нагpевают на пламени гоpелки до начала изменения окpаски на синевато-зеленую. Одновpеменно ощущается хаpактеpный запах уксусного альдегида. а) Растворимость фенола в воде В пробирку помещают 0,5 г фенола и 5 мл воды. Смесь встряхивают и дают отстояться. Наблюдается расслоение смеси, фенол полностью в воде не растворяется. Затем смесь встряхивают и нагревают на горячей водяной бане. Образующийся раствор разливают в две пробирки. б) Качественная реакция на фенол В пробирку с раствором фенола добавляют 2-3 капли раствора хлорного железа (FeCl3). Появляется фиолетовое окрашивание за счет образования комплексной соли: в) Получение трибромфенола В пробирку с раствором фенола добавляют по каплям раствор брома. При этом наблюдают появление белой мути за счет нерастворимого в воде трибромфенола. Опыт 4 . Окисление альдегидов оксидом сеpебpа (pеакция сеpебpяного зеpкала).
К pаствоpу альдегида пpиливают 1 мл свежепpиготовленного аммиачного pаствоpа окиси сеpебpа и добавляют 2-3 капли pазбавленного pаствоpа щелочи. Пpобиpку встpяхивают и ставят в штатив. Если сеpебpо не выделяется, пpобиpку нагpевают . В сухую чистую пробирку поместить несколько капель нафтеновых кислот. Прилить в пробирку 2 мл воды, хорошо взболтать содержимое пробирки. При перемешивании раствор становится мутным из-за образования эмульсии, которая после прекращения взбалтывания быстро расслаивается, образуя два слоя. Верхний слой – нафтеновые кислоты, нижний слой вода. Какова плотность нафтеновых кислот по отношению к воде? В пробирку с нафтеновыми кислотами и водой (опыт 5) добавить несколько капель 10%-ного раствора NaOH. Хорошо перемешать. Наблюдаем исчезновение органического слоя, что свидетельствует о том, что образуется растворимые в воде нафтенаты натрия: Соли нафтеновых кислот – нафтенаты легко разлагаются под действием сильных минеральных кислот. Точную навеску исследуемого образца (нефтепродукта или нафтеновых кислот), примерно 0,3-0,5 г, взвешенную на аналитических весах, растворяют в 25 мл спирто-бензольной смеси в колбе Эрленмейера и титруют из бюретки 0,1 н раствором КОН в присутствии фенолфталеина до появления малинового окрашивания. Записывают в рабочий журнал количество мл КОН, пошедшее на титрование. Расчет кислотного числа Кислотное число рассчитывают по формуле:
где: 5,6 – количество мг КОН в 1мл 0,1н раствора КОН; А – вес навески исследуемого образца, г; В – количество мл 0,1н раствора КОН, пошедших на титрование (нейтрализацию) взятой навески вещества; К – поправка к титру раствора КОН (получить у лаборанта).
Зная кислотное число исследуемой кислоты, можно вычислить ее молекулярную массу:
Меры безопасности
План отчета
проба №1: проба №2:
опыт №1: опыт №2:
Контрольные вопросы
3.3. Определение кислотного числа потенциометрическим методом на приборе «Ионометр И-135» Определение кислотного числа потенциометрическим методом основано на измерении величины рН среды раствора образца нефтяного продукта с помощью ионометра. Как и в случае определения кислотного числа методом объемно-метрического титрования, в данном методе навеску исследуемого образца титруют 0,1 N раствором КОН, но без индикатора. Определение необходимого для нейтрализации объема КОН проводится по изменению величины рН среды титруемого раствора. Для определения строится кривая титрования, которая представляет собой график зависимости величины рН от объема добавленного титранта (КОН). На оси абсцисс откладывают объем (в мл) КОН, а на оси ординат – значение рН среды. На кривой титрования наблюдается зона резкого изменения величины рН, называемая скачком титрования. В середине скачка титрования находится так называемая точка эквивалентности. Ее проекция на ось абсцисс соответствует объему раствора КОН, необходимого для нейтрализации навески. Установка по определению рН среды представлена на рис.11.
рис.11. Установка по определению рН среды: 1 – ионометр И-135; 2 – электроды, 3 – стакан, 4 – магнитная мешалка.
Построить график зависимости изменения рН среды от объема КОН. Определить на графике точку эквивалентности и по ней найти объем раствора КОН, пошедший на нейтрализацию навески. Рассчитать кислотное число по формуле: К.ч.= 5,6·В·К/m, где 5,6 – количество мг КОН в 1 мл 0,1 N раствора, В – количество мл 0,1 N раствора КОН пошедшие на титрование, К — поправка к титру раствора КОН.
Меры безопасности
План отчета
Контрольные вопросы:
IV. Исследование нефтяных дисперсных систем Одним из количественных методов определения дисперсности высокодисперсных систем – растворов нефти и нефтяных остатков – является метод турбидиметрии. В основе метода лежит явление светорассеяния на оптических неоднородностях среды, то есть на частицах дисперсной фазы НДС. Коллоидные растворы, размер дисперсных частиц которых меньше длины волны падающего света, подчиняются закону Рэлея. Зависимость светорассеяния в дисперсной системе от длины волны (закон Рэлея) в общем виде описывается уравнением вида Io – интенсивность падающего света, I – интенсивность прошедшего света, п — волновой экспонент, зависящий только от радиуса частиц дисперсной фазы, Используя калибровочную кривую n=f(r), где r — размер частиц, построенную независимым путем измерения размеров частиц методом электронной микроскопии, оказывается возможным оценить размер частиц исследуемой НДС. На рис. 15 приведена калибровочная кривая n=f(r), полученная на основе измерения оптической плотности латексов полистирола, истинный размер частиц которых определялся независимо методом электронной микроскопии. Рис. 15. Зависимость волнового экспонента «n» от размера частиц «r». Таким образом, измерение размеров частиц, рассеивающих падающий свет, сводится к определению волнового экспонента п на основе экспериментальных значений Dи λ.
4. В исходных НДС (до введения растворителя размеры частиц асфальтенов существенно больше по сравнению с определяемыми данным методом частицами наноразмеров, модифицированных введением растворителей в исходные НДС Экспериментальная часть. Лабораторная работа № 16 Целью работы является определение дисперсности нефти или тяжелого нефтепродукта методом турбидиметрии. Готовят раствор нефти или нефтепродукта в соответствующем растворителе. В колбочку с помощью капельницы помещают 1 каплю (вещества) и добавляют растворитель (гексан : толуол = 4 : 1) в количестве 10 мл, тщательно перемешивают. Далее проводят определение оптической плотности приготовленного раствора на фотометре КФК. Кюветы перед каждым измерением следует тщательно промывать спирто-эфирной смесью. Нельзя касаться пальцами их рабочих поверхностей (широких граней). Одну кювету заполняют «холостой пробой» – растворителем с помощью бюретки, другую – исследуемым раствором из колбочки. Кюветы с холостой пробой и исследуемым раствором устанавливают в кюветное отделение. Кювету с «холостой пробой» помещают в дальнее гнездо кюветодержателя, а кювету с исследуемым раствором – в ближнее гнездо. Ручку перемещения кювет переводят в крайнее левое положение, при этом в световой пучок вводится кювета с «холостой пробой». Закрывают крышку кюветного отделения. Для фотометра КФК-3-01 клавишей выбора режима «D» («С») выбирают режим измерения «τ — КОЭФФИЦИЕНТ ПРОПУСКАНИЯ» («А -ОПТИЧЕСКАЯ ПЛОТНОСТЬ». Заметим, что оптическая плотность в описании прибора обозначена буквой «А». Нажимают клавишу с изображением решетки. На нижнем индикаторе на верхней строке должно отображается надпись «ГРАДУИРОВКА», через 3-5 с. данная надпись исчезает и вместо нее отображается надпись «ИЗМЕРЕНИЕ», на нижней строке – τ = 100,0 ± 0,2 % («А=0,000 ± 0,002). Если значение 100 («0,000») отобразилось с большим отклонением, повторно нажимают клавишу с изображением решетки. Далее ручку перемещения кювет устанавливают вправо до упора. При этом в световой поток вводится кювета с исследуемым раствором. На нижнем индикаторе отображается значение коэффициента пропускания в % (оптической плотности) исследуемого раствора. Операцию повторяют три раза. Значение коэффициента пропускания (оптической плотности) исследуемого раствора определяют как среднее арифметическое из полученных отсчетов. Проводят измерение значения оптической плотности раствора на светофильтре с длиной волны, равной 540 нм и 590 нм. С помощью рефрактометра определяют показатель преломления Использованные растворы сливают в слив, из бюретки оставшимся растворителем промывают кюветы и колбочку. Загрязненный растворитель сливают в емкость для слива растворителей. На основе полученных данных определяют величину волнового экспонента п по формуле: В случае истинного рассеяния света значения волнового экспонента лежат в интервале 0 4, то в указанной области длин волн происходит поглощение света. Затем для соответствующего значения п рассчитывают характеристический параметр Z по следующим формулам: источники: http://chemer.ru/services/hydrolysis/salts/C2H5ONa http://topuch.ru/uchebnoe-posobie-pod-redakciej-professora-v-n-kosheleva-moskva/index8.html |
 2 С2H5ОH + 2 Na 2 C2H5ONa + H2
2 С2H5ОH + 2 Na 2 C2H5ONa + H2


 ,
, .
. .
.






 для раствора. Если при определении показателя преломления температура не была равна 20°С, то необходимо внести температурную поправку. Для большинства органических жидкостей при повышении температуры на 1°С показатель преломления в среднем понижается на величину 0,00045.
для раствора. Если при определении показателя преломления температура не была равна 20°С, то необходимо внести температурную поправку. Для большинства органических жидкостей при повышении температуры на 1°С показатель преломления в среднем понижается на величину 0,00045.