Сложные эфиры салициловой кислоты
Из группы лекарственных веществ, производных сложных эфиров салициловой кислоты, будет рассмотрена кислота ацетилсалициловая, представляющая собой сложный эфир салициловой и уксусной кислот.
Промышленный способ получения кислоты ацетилсалициловой основан на нагревании смеси салициловой кислоты, уксусного ангидрида и концентрированной серной кислоты:
Кислота ацетилсалициловая (табл. 35.1) — кристаллическое вещество. Она мало растворима в воде, но легко растворима в растворах гидроксидов щелочных металлов, этаноле, хлороформе.
35.1. Свойства кислоты ацетилсалициловой
| Лекарственное вещество | Химическая структура | Описание |
| Acetylsalicylic acid— кислота ацетилсалициловая |  салициловый эфир уксусной кислоты салициловый эфир уксусной кислоты | Бесцветные кристаллы или белый кристаллический порошок без запаха или со слабым запахом. Т. пл. 133–138°C |
Подлинность кислоты ацетилсалициловой подтверждают по ИК-спектру в области 4000-400 см –1 (в дисках с бромидом калия). Он должен полностью совпадать с полосами поглощения прилагаемого к ФС спектра. УФ-спектр 0,007%-ного раствора кислоты ацетилсалициловой в хлороформе имеет в области 260-350 нм максимум поглощения при 278 нм, а УФ-спектр 0,001%-ного раствора в 0,1 М растворе серной кислоты в области 220-350 нм — два максимума при 228 и 276 нм и один минимум поглощения при 257 нм.
Для испытания подлинности используют реакцию гидролиза в кислой или щелочной среде с последующей идентификацией продуктов гидролиза. Кислоту ацетилсалициловую подвергают гидролизу в щелочной среде:
Затем подкисляют разведенной серной кислотой и наблюдают образование белого кристаллического осадка салициловой кислоты:
К фильтрату, содержащему уксусную кислоту, прибавляют этанол и концентрированную серную кислоту — образуется уксусноэтиловый эфир, имеющий характерный запах:
Салициловую кислоту, содержащуюся в осадке, растворяют в этаноле и идентифицируют с помощью хлорида железа (III) по образованию фиолетового окрашивания.
Кислоту ацетилсалициловую можно подвергнуть и кислотному гидролизу. При добавлении концентрированной серной кислоты и воды ощущается запах уксусной кислоты. Если затем добавить раствор формальдегида, то появляется розовое окрашивание (цветная реакция на салициловую кислоту).
Кислота ацетилсалициловая при взаимодействии с 2%-ными растворами 4-аминоантипирина и гексацианоферрата (III) калия приобретают желтое окрашивание (хлороформное извлечение).
При испытании на чистоту устанавливают содержание примеси свободной салициловой кислоты (не более 0,05%) фотоколориметрическим методом, с использованием в качестве реактива железоаммониевых квасцов, измеряя светопоглощение при длине волны 520 нм. Расчёты выполняют по РСО кислоты салициловой. Обнаруживают также органические примеси и вещества, нерастворимые в растворе карбоната натрия.
Кислоту ацетилсалициловую количественно можно определить цериметрическим методом, основанным на окислении сульфатом церия (IV) до образования глутаровой, муравьиной и других алифатических кислот. Химизм и методика определения сходна с цериметрическим определением резорцина (см. ч. 2, гл. 31).
Для количественного определения кислоты ацетилсалициловой может быть использована реакция щелочного гидролиза. Для этого берут избыток 0,5 М раствора гидроксида натрия (не содержащего карбонатов) и гидролизуют при нагревании на кипящей водяной бане с обратным холодильником (химизм указан при описании испытания на подлинность). Избыток титрованного раствора гидроксида натрия оттитровывают 0,5 М раствором хлороводородной кислоты.
Для определения кислоты ацетилсалициловой ФС рекомендован способ, основанный на её нейтрализации без предварительного гидролиза:
Кислоту ацетилсалициловую растворяют в нейтрализованном и охлажденном до 8–10 °C этаноле и титруют 0,1 М раствором гидроксида натрия (индикатор фенолфталеин).
В результате исследования УФ-спектров поглощения растворов кислоты ацетилсалициловой и других сложных эфиров салициловой кислоты в различных растворителях (вода, этанол, хлороформ, дихлорэтан, 0,1 М раствор гидроксида натрия) разработаны методики их спектрофотометрического определения непосредственным и дифференциальным методами (С.Г. Тираспольская).
Описан УФ-спектрофотометрический способ определения кислоты ацетилсалициловой, основанный на предварительном ее гидролизе в щелочной среде до салицилата натрия в присутствии пероксида водорода. Последний ускоряет процесс гидролиза, окончание которого наступает через 15 мин. Затем измеряют оптическую плотность раствора на спектрофотометре в максимуме поглощения (290 нм).
Кислоту ацетилсалициловую хранят в сухом месте, в хорошо укупоренной таре. Она устойчива в сухом воздухе, во влажном — постепенно гидролизуется с образованием кислот уксусной и салициловой.
Кислоту ацетилсалициловую применяют внутрь в качестве противоревматического, противовоспалительного, болеутоляющего и жаропонижающего средства по 0,25–0,5 г 3–4 раза в день. Исследования последних лет показали, что кислота ацетилсалициловая в малых дозах оказывает также антитромботическое действие, так как угнетает агрегацию тромбоцитов.
Кислоту ацетилсалициловую называют лекарством XX века. Считают, что указанным её «лечебный потенциал» не исчерпан. Однако она не лишена побочных явлений, т.к. раздражает слизистую оболочку желудка, может вызвать кровотечение, аллергические реакции и др.
Фрагмент урока химии в 11 классе Практическая работа «Гидролиз ацетилсалициловой кислоты»
«Гидролиз ацетилсалициловой кислоты»
— Итак, какие выводы мы сделали из первой части работы?
— Ацетилсалициловая кислота бесцветное кристаллическое вещество, плохо растворимое в воде.
— В чем причина плохой растворимости?
— Анализируя строение молекулы можно сделать вывод, что она неполярная, содержит карбоксильную группу, фенольный гидроксил связанный сложноэфирной с метильным радикалом. Значит, в полярном растворителе воде будет растворяться плохо.
— Молодцы! В фармакологии сейчас стоят остро две основные проблемы. Первая это фальсификация лекарственных препаратов, а вторая легкомыслие потребителя, то есть нас с вами. Как часто мы выбираем лекарственный препарат, руководствуясь советами друзей, рекламой. Пренебрегаем такими жесткими характеристиками как срок годности препарата. Поэтому следующим этап нашей работы пройдет в режиме телевизионной программы «Знак якост і»
Вашему вниманию представлены четыре образца растворов ацетилсалициловой кислоты. Я предлагаю вам экспериментальным путем проверить качество предложенных образцов в качестве контрольного реактива используя водный раствор Феррум (ІІІ) хлорида. Полученные результаты незабудьте внести в таблицу.
— Ну, что? Какие выводы напрашиваються?
— В пробирке №4 мы наблюдаем появление интенсивного фиолетового окрашивания, что свидетельствует о наличии в образце фенокислоты, скорее всего это салициловая кислота, которая могла образоваться в результате гидролиза по сложноэфирной связи молекулы ацетилсалициловой кислоты. В пробирке под номером два мы наблюдаем незначительное окрашивание, что свидетельствует о частичном гидролизе. В пробирках под номером один и три изменения окраски не произошло
В пробирке №1 был свежеприготовленный раствор аспирина производства Луганського хим-фарм завода, второй донецкого объединения «Стирол», третий киевского завода «Дарница». В пробирке под №4 был раствор аспирина Луганського хим-фарма, срок годности которого истек 2 месяца назад.
— Почему не изменился цвет в первой и третьей пробирке?
— Аспирин не дает цветной реакции с Феррум (ІІІ) хлоридом, так как у него фенольный гидроксил закрыт ацетильной группой
— Запишите себе в тетради уравнение гидролиза ацетилсалициловой кислоты.
— Аспирин, синтезированный еще в 1869 году и сейчас является одним из самых известных, дешевых и широко используемых лекарственных препаратов. Уже достаточно хорошо понятны механизмы противовоспалительного и жаропонижающего действия аспирина. Кто может в двух словах объяснить этот механизм?
— Происходит блокировка выработки простагландинов.
— Так же следует отметить, что аспирин обладает мощным антипроботическим действием, то есть, попросту говоря, разжижает кровь. Наиболее эффективным, с этой точки зрения, является препарат аналог кардиомагнил, в состав действующего вещества которого входит 80% ацетилсалициловой кислоты и 20% магний гидроксида.
— Проанализировав состав молекулы, прокомментируйте рекомендации врача принимать аспирин только после еды.
— Безусловно, следует придерживаться данных рекомендаций. Так как в противном случае салициловая и уксусная кислоты которые образуются в результате в ходе расщепления молекулы могут раздражать слизистую желудка. Так же следует быть осторожным в при приеме аспирина людям с хроническим гастритом и язвенной болезнью.
1. Растираем таблетку аспирина в ступке.
2. Помещаем образец (на кончике штапеля) в пробирку с водой. Перемешиваем стеклянной палочкой.
3. Отбираем 1-2 мл надосадочной жидкости и добавляем 1-2 капли 1% раствора ферум(ІІІ) хлорида.
4. Запишите наблюдения в сравнительную таблицу.
Алгоритм анализа лекарственных препаратов:
1. Находим в фармакологическом справочнике химическое название и структурную формулу интересующего вас лекарства.
2. Определяем, к какому классу органических соединений оно относится, и какие функциональные группы имеет.
3. Устанавливаем химические свойства вещества, с какими реагентами оно будет вступать во взаимодействие.
4. Из этого перечня реакций отбираем те, результат которых можно наблюдать визуально ( появление осадка, мути, цветного продукта)
Изучение химических свойств гетерофункциональных соединений
Цель работы: изучить кислотно-основные и хелатообразующие свойства a-гидроксикислот.
Реактивы: салициловая кислота, ацетилсалициловая кислота, винная кислота, 5 %-ный раствор гидроксида калия, 10 %-ный раствор гидроксида натрия, 5 %-ный раствор сульфата меди; насыщенный раствор гидрокарбоната натрия, бромная вода, 5 %-ный раствор фенола; 1 %-ный раствор хлорида железа (III); молочная кислота.
Опыт 1. Получение и свойства солей винной кислоты.
Опыт 1.1и 1.2. В пробирку помещают 0,5 мл 15 %-ного раствора винной кислоты и 0,5 мл 5 %-ного раствора гидроксида калия, интенсивно встряхивают и наблюдают постепенное выделение белого кристаллического осадка гидротартрата калия.
К полученному раствору добавить 10% — ный раствор гидроксида натрия до полного его растворения. Образующийся раствор двойной калий-натриевой соли винной кислоты (сегнетовой соли) используют далее в опыте 1.3.
 |
Опыт 1.3. В пробирку помещают несколько капель 5 %-ного раствора сульфата меди, добавляют раствор гидроксида натрия до выпадения голубого осадка. К образовавшемуся осадку гидроксида меди (II) добавляют раствор сегнетовой соли, полученной в оп.1.2 . Отмечают изменение окраски раствора.
 |
Опыт 2. Свойства салициловой кислоты.
Опыт 2.1. На предметное стекло помещают несколько кристаллов салициловой кислоты и добавляют одну каплю насыщенного раствора гидрокарбоната натрия. Наблюдают выделение газа.
 |

Опыт 2.2. В сухую пробирку помещают 0,5 г салициловой кислоты и осторожно нагревают нижнюю часть пробирки. Происходит декарбоксилирование салициловой кислоты с образованием фенола, который обнаруживают по характерному запаху.
 |
Опыт 2.3. В две пробирки помещают по 0,5 г салициловой и ацетилсалициловой кислот, добавляют по 1 мл воды и к полученному раствору добавляют 1 — 2 капли бромной воды. Отмечают наблюдаемые изменения в каждой пробирке.
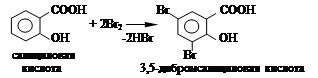
Опыт 3. Гидролиз ацетилсалициловой кислоты.
В две пробирки помещают по нескольку кристалликов ацетилсалициловой и салициловой кислоты, добавляют в каждую пробирку по 0,5 мл воды и 1 — 2 капли раствора хлорида железа (III), отмечают окраску раствора в каждой пробирке. Раствор нагревают до кипения, отмечают изменение окраски.
Опыт 4. Качественная реакция a-гидроксикислот с хлоридом железа (III).
В пробирку помещают 0,5 мл 5 %-ного раствора фенола и добавляют 1 — 2 капли 1 %-ного раствора хлорида железа (III). Раствор приобретает фиолетовую окраску. При добавлении к нему 1 — 2 капель молочной кислоты происходит изменение окраски раствора до зеленовато – желтой: кислота вытесняет фенол из комплексного фенолята с образованием лактата железа.
 |
Контрольные вопросы
1. Наличие какого фрагмента в молекуле винной кислоты доказывает реакция образования фелинговой жидкости?
2. Наличие какой функциональной группы в салициловой кислоте доказывает реакция декарбоксилирования?
3. Напишите схему гидролиза ацетилсалициловой кислоты. Какое применение в медицинской практике находит ацетилсалициловая кислота и продукт её гидролиза?
4. Образует ли салициловая кислота окрашенный комплекс с катионом железа? А бензойная кислота? Ответ поясните.
5. В чём отличие реакций разложения от реакций отщепления (элиминирования)? Как выглядел бы продукт взаимодействия молочной и серной кислот, если бы реакция проходила в других условиях и серная кислота выступала бы в роли водоотнимающего средства?
http://pandia.ru/text/79/490/27463.php
http://poisk-ru.ru/s11251t3.html





