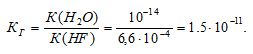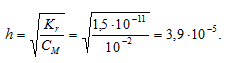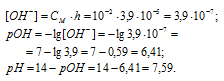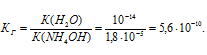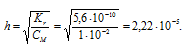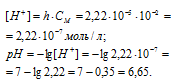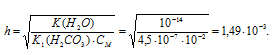Гидролиз фторида калия
KF — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Молекулярное уравнение
KF + HOH ⇄ HF + KOH
Полное ионное уравнение
K + + F — + HOH ⇄ HF + K + + OH —
Сокращенное (краткое) ионное уравнение
F — + HOH ⇄ HF + OH —
Среда и pH раствора фторида калия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Вычисление константы гидролиза, определение степени гидролиза соли
Задача 588.
Вычислить константу гидролиза фторида калия, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Решение:
K(HF) = 6,6 . 10 -4 .
KF — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
Константа гидролиза соли определяется константой диссоциации образовавшейся кислоты HF и определяется по формуле:
Теперь рассчитаем концентрацию образовавшихся ионов OH — :
Ответ: КГ = 1,5 . 10 -11 ; h = 3,9 . 10 -5 ; pH = 7,59.
Задача 589.
Вычислить константу гидролиза хлорида аммония, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Решение:
K(NH4OH) = 1,8 . 10-5.
NH4Cl — соль слабого основания и сильной кислоты гидролизуется по катиону:
Константа гидролиза соли определяется константой диссоциации образовавшегося основания NH4OH и определяется по формуле:
Теперь рассчитаем концентрацию образовавшихся ионов H + :
Ответ: КГ = 5,6 . 10 -10 ; h = 2,4 . 10 -4 ; pH = 6,65.
Задача 590.
Определить рН 0,02 н. раствора соды Na2CO3, учитывая только первую ступень гидролиза.
Решение:
K1(H2CO3) = 4,5 . 10 -7 .
Na2CO3 — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
Здесь h — степень гидролиза соли, показывает долю гидролизованных ионов.
Теперь рассчитаем концентрацию образовавшихся ионов OH — :
Фторид калия: способы получения и химические свойства
Фторид калия KF — соль щелочного металла калия и плавиковой кислоты. Белое вещество, плавится без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 58,10; относительная плотность для тв. и ж. состояния d = 2,48; tпл = 857º C
Способ получения
1. Фторид калия можно получить путем взаимодействия при комнатой температуре калия и фтора:
2K + F2 = 2KF
2. В результате взаимодействия разбавленной плавиковой кислоты и разбавленного раствора гидроксида калия, образуется фторид калия и вода:
KOH + HF = KF + H2O
3. Карбонат калия взаимодействует с разбавленной плавиковой кислотой, образуя фторид калия, воду и углекислый газ:
4. При 310–400º C гидродифторид разлагается на фторид калия и фтороводородную кислоту:
K(HF2) = KF + HF
Качественная реакция
Качественная реакция на фторид калия — взаимодействие его с хлоридом кальция, в результате реакции происходит выпадение белого осадка:
1. При взаимодействии с хлоридом кальция , фторид калия образует фторид кальция и хлорид калия:
2KF + CaCl2 → 2KCl + CaF2↓
Химические свойства
1. Фторид калия вступает в реакцию со сложными веществами :
1.1. Фторид калия вступает во взаимодействие с кислотами:
1.1.1. При кипении в результате взаимодействия с концентрированной серной кислотой фторид калия образует сульфат калия и газ фтороводород:
1.1.2. В реакции с концентрированной фтороводородной кислотой фторид калия образует гидродифторид калия:
KF + HF = K(HF2)
1.2. Фторид калия реагирует с основаниями :
1.2.1. При кипении насыщенный раствор гидроксида лития реагирует со фторидом калия с образованием гидроксида калия и осадка фторида лития:
http://buzani.ru/zadachi/khimiya-glinka/1198-konstanta-gidroliza-soli-zadachi-537
http://chemege.ru/ftorid-kaliya/