Необратимый гидролиз бинарных соединений.
Бинарные соединения – соединения, образованные двумя химическими элементами.
Бинарные соединения делят на ионные и ковалентные.
Ионными называют такие бинарные соединения, которые образованы атомами металла и неметалла.
Ковалентными называют бинарные соединения, образованные двумя неметаллами.
Общая информация по гидролизу бинарных соединений
Многие бинарные соединения способны разлагаться под действием воды. Такая реакция бинарных соединений с водой называется необратимым гидролизом.
Необратимый гидролиз практически всегда протекает с сохранением степеней окисления всех элементов. В результате взаимодействия бинарных соединения с водой всегда:
✓ элемент в отрицательной степени окисления переходит в состав водородного соединения;
✓ элемент в положительной степени окисления переходит в состав соответствующего гидроксида.
Напомним, что гидроксид неметалла – это ни что иное, как соответствующая кислородсодержащая кислота. Так, например, гидроксид серы (VI) — это серная кислота H2SO4.
Так, например, попробуем записать уравнение необратимого гидролиза фосфида кальция Ca3P2, опираясь на информацию, представленную выше.
В фосфиде кальция мы имеем кальций в степени окисления «+2» и фосфор в степени окисления «-3». Как уже было сказано, в результате взаимодействия с водой должно образоваться водородное соединение элемента в отрицательной степени окисления (т.е. фосфора) и соответствующий гидроксид элемента в положительной степени окисления.
Также сказано, что в результате реакции гидролиза практически всегда сохраняются степени окисления элементов.
Это значит, что в образующемся водородном соединении фосфор будет иметь ту же степень окисления, что и в исходном фосфиде, т.е. «-3», исходя из чего легко записать формулу самого водородного соединения – PH3 (газ фосфин).
В то же время, кальций, как элемент в положительной степени окисления, должен перейти в состав соответствующего гидроксида с сохранением степени окисления «+2», т.е. в Ca(OH)2.
Таким образом, без расстановки коэффициентов реакция будет описываться следующей схемой:
Расставив коэффициенты получаем уравнение:
Используя аналогичный алгоритм, запишем уравнение гидролиза пентахлорида фосфора PCl5.
В данном соединении мы имеем фосфор в степени окисления «+5» и хлор в степени окисления «-1».
Очевидно, что водородным соединением хлора с хлором в степени окисления «-1» будет HCl.
В свою очередь, поскольку элемент в положительной степени окисления относится к неметаллам, его гидроксидом будет кислородсодержащая кислота с фосфором в той же степени окисления «+5».
При условии, что вы знаете формулы всех неорганических кислот, несложно догадаться, что данным гидроксидом является фосфорная кислота H3PO4.
Само уравнение при этом после расстановки коэффициентов будет иметь вид:
Как видите, если вам дали формулу бинарного соединения и попросили записать уравнения его гидролиза, то ничего сложного в этом нет.
Какие ионные бинарные соединения способны вступать в реакцию необратимого гидролиза?
Для успешной сдачи ЕГЭ нужно запомнить, что из ионных бинарных соединений в реакцию необратимого гидролиза водой вступают:
1) нитриды щелочных металов (ЩМ), щелочноземельных металлов (ЩЗМ) и магния:
2) фосфиды ЩМ, ЩЗМ и магния:
3) силициды ЩМ, ЩЗМ и магния:
4) карбиды ЩМ, ЩЗМ и магния. Знать нужно формулы только двух карбидов — Al4C3 и CaC2 и, соответственно, уметь записывать уравнения их гидролиза:
5) сульфиды алюминия и хрома:
6) гидриды ЩМ, ЩЗМ, Mg, Al:
Гидролиз гидридов металлов – редкий пример окислительно-восстановительного гидролиза. Фактически, в данной реакции объединяются ионы водорода H + и анионы водорода H — , в следствие чего образуются нейтральные молекулы H2 с водородом в степени окисления, равной 0.
Какие ковалентные бинарные соединения вступают в реакцию гидролиза?
Из ковалентных бинарных соединений, способных вступать в реакцию необратимого гидролиза, нужно знать про:
1) галогениды фосфора III и V.
2) галогениды кремния:
Гидролиз бинарных соединений действием растворов кислот и щелочей
Помимо обычного гидролиза водой существует также вариант гидролиза, при котором бинарное соединение обрабатывают водным раствором щелочи или кислоты.
Как в таком случае записать уравнение гидролиза?
Для того, чтобы записать уравнение гидролиза бинарного соединения водным раствором щелочи или кислоты, нужно:
1) в первую очередь, представить, какие продукты образовались бы при обычном гидролизе водой.
Например, мы хотим записать уравнение щелочного гидролиза соединения PCl5 действием водного раствора KOH.
Тогда, согласно этому пункту, мы должны вспомнить какие продукты образуются при обычном гидролизе. В нашем случае это HCl и H3PO4
2) посмотреть на отношение этих продуктов к средообразователю (кислоте или щелочи) – реагируют они или нет. Если продукты обычного гидролиза реагируют со средообразователем, то запомнить продукты этого взаимодействия.
Возвращаясь к нашему случаю с PCl5, мы должны посмотреть на то, как относятся к щелочи продукты обычного гидролиза, т.е. HCl и H3PO4. Оба данных соединения в водном растворе являются кислотами, в связи с чем существовать в щелочной среде не могут. В частности, с гидроксидом калия они прореагируют, образуя соответственно соли KCl и K3PO4
3) в конечном уравнении в качестве продуктов записать то, что получается при взаимодействии со средообразователем. Воду при этом мы пока не пишем, вывод о том, писать ее или нет, делаем после попытки уравнивания реакции без нее.
Таким образом, следуя этому принципу, запишем:
Уже до начала расстановки коэффициентов очевидно, что есть необходимость в записи в качестве одного из продуктов реакции воды, поскольку в левой части присутствует водород, а в правой его нет.
Таким образом, суммарная схема реакции будет иметь вид:
А само уравнение после расстановки коэффициентов будет выглядеть так:
Следует отметить, что щелочной гидролиз ионных соединений чаще всего не отличается от обычного гидролиза действием воды, поскольку чаще всего ни один продукт обычного гидролиза с щелочью не взаимодействует.
Аналогично, можно сказать, что кислотный гидролиз ковалентных бинарных соединений не будет отличаться от водного.
В связи с этим имеет смысл более детально рассмотреть кислотный гидролиз ионных бинарных соединений и щелочной гидролиз ковалентных бинарных соединений.
Кислотный гидролиз ионных бинарных соединений
Со всеми перечисленными ионными бинарными соединениями, участвовавшими в реакциях обычного гидролиза водой, можно записать соответствующие уравнения их кислотного гидролиза. Возьмем в качестве примера водный раствор соляной кислоты:
Обратите внимание, что вместо водородного соединения в случае нитридов металлов образуется продукт его взаимодействия с соляной кислотой (NH3 + HCl = NH4Cl). Следует отметить, что нитриды металлов – единственный случай, когда при кислотном гидролизе ионного бинарного соединения не выделяется газообразное водородное соединение. Связано это с тем, что по сравнению с другими водородными соединениями неметаллов, только у аммиака основные свойства выражены в значительной степени.
Как можно заметить, кислотный гидролиз гидридов металлов также относится к окислительно-восстановительным реакциям. В результате этой реакции образуется простое вещество водород. Связано это с тем, что водород с кислотами не реагирует.
Щелочной гидролиз ковалентных бинарных соединений
Щелочному гидролизу среди ковалентных соединений подвержены все те же бинарные соединения, что и обычному гидролизу водой, то есть галогениды фосфора и кремния:
Щелочной гидролиз галогенидов фосфора III в ЕГЭ не встретится из-за специфических свойства фосфористой кислоты.
Тем не менее, для тех, кто хочет, ниже предоставляю пример такого рода уравнений с пояснением:
Поскольку фосфористая кислота является двухосновной, то несмотря на наличие трех атомов водорода, при ее реакции с щелочью на атомы металла способны заместиться только два атома водорода.
научная статья по теме ГИДРОЛИЗ ГИДРИДА МАГНИЯ В ПРИСУТСТВИИ СОЛЕЙ АММОНИЯ Химия
Цена:
Авторы работы:
Научный журнал:
Год выхода:
Текст научной статьи на тему «ГИДРОЛИЗ ГИДРИДА МАГНИЯ В ПРИСУТСТВИИ СОЛЕЙ АММОНИЯ»
ЖУРНАЛ НЕОРГАНИЧЕСКОЙ ХИМИИ, 2008, том 53, № 6, с. 928-931
СИНТЕЗ И СВОЙСТВА НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
ГИДРОЛИЗ ГИДРИДА МАГНИЯ В ПРИСУТСТВИИ СОЛЕЙ АММОНИЯ
© 2008 г. В. Д. Махаев, Л. А. Петрова, Б. П. Тарасов
Институт проблем химической физики РАН, Черноголовка E-mail: vim@icp.ac.ru Поступила в редакцию 04.05.2007 г.
Исследовано влияние природы солей аммония (NH4Cl, (NH4)2SO4, (NH4)HSO4, [(CH3)NH3]Cl) и концентрации их водных растворов на процесс гидролиза гидрида магния. Обнаружено, что наибольшая полнота и скорость гидролиза наблюдаются при концентрации солей аммония
7.5%. Наиболее эффективным активатором из изученных солей аммония является (NH4)HSO4.
Гидриды легких металлов содержат большое количество активного водорода (ЫЫ 12.7%, КаИ 4.2%, MgH2 7.66%) и рассматриваются как перспективные вещества для получения водорода, который может быть выделен из них различными методами, в частности, термолизом или гидролизом [1]. Использование гидридов щелочных металлов в гидролитических процессах генерации водорода затрудняется их чрезвычайно высокой реакционной способностью [2]. В то же время химическая активность гидрида магния варьирует в широких пределах в зависимости от способа получения 3. Полученный пиролизом магнийорганических соединений в виде мелкодисперсного порошка гидрид магния представляет собой химически чрезвычайно активное вещество, загорающееся при контакте с водой и быстро разлагающееся либо самовоспламеняющееся на воздухе [3, 4]. Гидрид магния, образующийся при прямом гидрировании металлического магния водородом при высокой температуре и давлении, представляет собой устойчивое на воздухе вещество, медленно гидролизующееся водой и быстро — кислотами [5]. При гидролизе MgH2 теоретически выделяется более 15 мас. % водорода в расчете на используемый гидрид магния:
MgH2 + 2Ы20 = Mg(OH)2 + 2Ы2. (1)
Магний — недорогой и доступный материал, а способ синтеза гидрида магния из элементов является эффективным и высокопроизводительным. Низкая активность синтезированного из элементов гидрида магния на воздухе определяет безопасность его использования. Поскольку применение кислот в процессах гидролитической генерации водорода во многих случаях нежелательно, представляет интерес поиск нейтральных реагентов, способствующих быстрому и эффективному гидролизу неактивированного устойчивого на воздухе полученного из элементов гидрида магния. Т.Н. Дымова с соавторами [5] показали, что 5%-ный раствор хлорида аммония быстро и количественно гидролизует полученный
из элементов гидрид магния. В то же время следует отметить, что зависимость параметров процесса гидролиза от концентрации хлорида аммония и от природы солей аммония не изучена [5]. Целью данной работы было изучение зависимости скорости и степени гидролиза MgH2 от природы и концентрации различных солей аммония.
В работе использовали порошкообразный гидрид магния, полученный гидрированием магния водородом в присутствии 4 мас. % железа и 4 мас. % V2O5 при механической активации в шаровой мельнице. Исследуемый образец содержал
75% MgH2 и 17% Mg. Товарные препараты кислот и солей аммония квалификации «х. ч.» или «ч. д. а.» использовали без дополнительной очистки. Для приготовления растворов HCl, H2SO4, H3PO4, NH4Cl, (NH4)2SO4, (NH4)HSO4, [(CH3)NH3]Cl определенной концентрации использовали дистиллированную воду.
Исследование гидролиза гидрида магния проводили в приборе для волюмометрического анализа при действии определенного количества раствора одного из указанных реагентов (20 мл) на навеску MgH2 (25—30 мг). Объем выделяющегося водорода определяли волюмометрически [1].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Действие 10%-ных растворов фосфорной, соляной или уксусной кислот на исследуемый образец приводило к быстрому выделению водорода, объем которого соответствовал содержанию 6.1 мас. % водорода в образце. Степень превращения (а) в реакциях гидролиза под действием других реагентов оценивали как отношение количества водорода, выделившегося при взаимодействии с водным раствором реагента, к указанному количеству водорода. Следует отметить, что реакция сильно экзотермична и при разложении
MgH2 небольшим избытком раствора (MgH2 : раствор — 1 : 10, 1 : 20) заметно сильное разогревание реакционной смеси. Поэтому во всех нижеописанных опытах использовали большой избыток водного раствора — 20 мл раствора на
Для сравнения с описанными ранее результатами [5] нами был изучен гидролиз образца гидрида магния дистиллированной водой без добавок солей аммония. Найдено, что за 30 мин степень гидролиза составляет
18%, а за сутки выделяется 57% водорода от его содержания в образце. Это заметно больше, чем было описано ранее для чистого гидрида магния (14.8% за сутки [5]) и может быть объяснено наличием примесей У205 и более высокой степенью дисперсности исследуемого образца. Увеличение реакционной способности MgH2 с увеличением степени его дисперсности неоднократно отмечалось ранее [6, 7]. Тем не менее исследуемый образец достаточно устойчив и после хранения на воздухе в течение месяца сохранил
85% исходного содержания водорода. Таким образом, гидролиз гидрида магния дистиллированной водой протекает медленно и не может быть использован для создания быстрого и контролируемого процесса генерации водорода.
Нами также была предпринята попытка ускорить гидролиз путем связывания образующихся в ходе реакции ионов магния добавленным к воде три-лоном Б, однако ускорения разложения не обнаружено.
Исследование гидролиза гидрида магния растворами хлорида аммония различной концентрации показало, что наличие в растворе даже небольшого количества КН4С1 (0.5%-ный раствор) существенно ускоряет процесс гидролиза (рис. 1, 2) — за 5 мин выделяется большее количество водорода, чем за сутки при действии чистой воды (60 и 57% соответственно). С увеличением концентрации КН4С1 от 0.5 до 7.5% скорость процесса гидролиза возрастает и степень превращения достигает в последнем случае 92% за 5 мин. При этом наблюдается и наибольшая степень гидролиза за сутки (а24) — 95.4% (рис. 2). Дальнейшее повышение концентрации раствора КН4С1 приводит к некоторому уменьшению скорости гидролиза и а24.
Влияние природы солей аммония исследовано нами на примере (МН4)2804, (КН4)Н804, [(СН3)КН3]С1. Сравнение рис. 1 и 3 показывает, что концентрация раствора (КН4)2804 оказывает на скорость гидролиза примерно такое же влияние, как и КН4С1. Поэтому нам представлялось интересным изучить взаимодействие с кислой солью аммония -(КН4)Н804. Можно было предположить, что для полного гидролиза гидрида магния будет достаточно стехиометрического количества (КН4)Н804, поскольку анион Н804 будет нейтрализовать образующиеся при гидролизе ионы гидроксила и тем са-
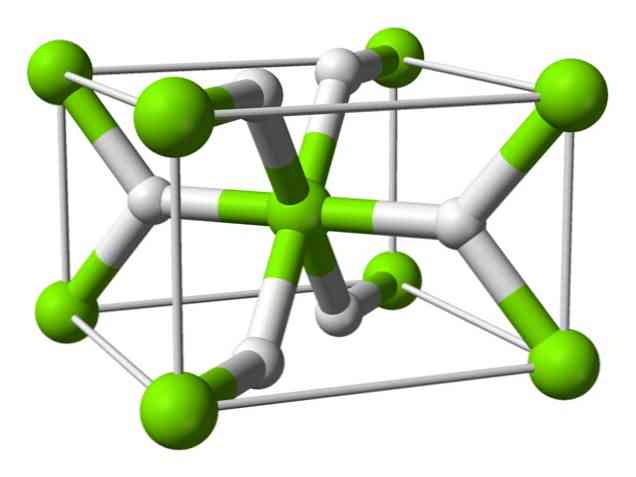
Формула гидрида магния, химическая структура и свойства
гидрид магния (MGH2 молекулярной формулы), представляет собой химическое соединение с содержанием по массе 7,66% водорода, встречающееся в природе в виде белого кристаллического твердого вещества. Он используется в основном для приготовления других химических веществ, хотя он также был изучен как потенциальный носитель водорода.
Он принадлежит к семейству солевых (или ионных) гидридов, определяемых отрицательно заряженным ионом H. Эти гидриды считаются такими, которые образуются из щелочных металлов и щелочноземельных металлов, но в случае магния (и бериллия) имеют ковалентные связи, в дополнение к ионам, которые характеризуют это семейство гидридов..
- 1 Приготовление и формула
- 2 Химическая структура
- 3 Физические и химические свойства
- 3.1 Физический
- 3.2 Химические вещества
- 4 использования
- 4.1 Хранение водорода
- 4.2 Реакции гидрирования и дегидрирования
- 4.3 Грязь
- 4.4 Топливные элементы
- 4.5 Транспорт и энергия
- 4.6 Алкилирование
- 5 рисков
- 5.1 Реакция с водой
- 5.2 Это пирофорный
- 6 Ссылки
Подготовка и формула
Гидрид магния образуется путем прямого гидрирования металлического магния (Mg) в условиях высокого давления и температуры (200 атмосфер, 500ºC) с катализатором MgI.2. Его реакция эквивалентна:
Производство MgH также было исследовано2 при более низких температурах с использованием нанокристаллического магния, получаемого в шаровых мельницах.
Существуют и другие способы получения, но они представляют собой более сложные химические реакции (гидрирование магния-антрацена, реакция между диэтилмагнием с литий-алюминиевым гидридом и как продукт комплекса MgH.2).
Химическая структура
Этот атом имеет структуру рутила при комнатной температуре, с тетрагональной кристаллической структурой. Он имеет по меньшей мере четыре различные формы в условиях высокого давления, и также наблюдается нестехиометрическая структура с недостатком водорода; последний встречается только в очень небольших количествах частиц при образовании.
Как упомянуто выше, связи, которые существуют в структуре рутила, имеют частично ковалентные свойства, а не являются чисто ионными, как другие солевые гидриды.
Это приводит к тому, что атом магния имеет сферическую форму, полностью ионизированную, но его гидрид-ион имеет удлиненную структуру.
Физико-химические свойства
физическое
- Внешний вид: белые кристаллы.
- Молярная масса: 26,3209 г / моль
- Плотность: 1,45 г / см 3
- Температура плавления: 285 ° C разлагается
- Растворимость: в воде разлагается.
Это химическое соединение имеет молекулярную массу 26,321 г / моль, плотность 1,45 г / см3 и температуру плавления 327 ° С..
химическая
- Прекурсор для изготовления других химических веществ.
- Хранение водорода, как возможный источник энергии.
- Восстановитель в органическом синтезе.
Важно указать, что это соединение нельзя довести до жидкого состояния, и когда его переносят или его температура плавления или вводят в воду, оно разлагается. Этот гидрид нерастворим в эфире.
Это очень реактивное и легковоспламеняющееся вещество, а также пирофорное, то есть оно может самовозгораться в воздухе. Эти три условия представляют риски для безопасности, которые будут упомянуты в последнем разделе этой статьи.
приложений
Хранение водорода
Гидрид магния легко реагирует с водой с образованием газообразного водорода посредством следующей химической реакции:
Кроме того, это вещество разлагается при температуре 287 ° С и давлении 1 бар следующим образом:
Поэтому было предложено использовать гидрид магния в качестве носителя для хранения водорода для его использования и транспортировки..
Гидрирование и дегидрирование некоторого количества металлического магния предлагается в качестве способа транспортировки количеств газообразного водорода, таким образом обеспечивая отсутствие утечки при его транспортировке и представляя более безопасный и практичный способ, чем при использовании сосудов высокого давления..
Реакции гидрирования и дегидрирования
Хотя температура разложения гидрида магния представляет собой ограничивающий фактор для его использования, были предложены способы для улучшения кинетики реакций гидрирования и дегидрирования. Одним из них является уменьшение размера частиц магния с помощью шаровых мельниц.
грязи
Кроме того, была предложена система, которая производит гидрид магния в форме грязи (более управляемой и безопасной, чем в порошке или других твердых частицах), которая будет реагировать с водой для получения желаемого водорода.
Предполагается, что ранее названный шлам будет образован тонко измельченным гидридом, защищен защитным слоем масел и суспендирован в диспергирующих агентах, чтобы гарантировать, что он сохраняет свою консистенцию без потери материала и что он не впитывает влагу из окружающей среды..
Преимущество этого ила состоит в том, что его можно перекачивать через любой обычный дизельный, бензиновый или водяной насос, что делает это экономическое предложение также эффективным.
Топливные элементы
Гидрид магния может быть использован в производстве современных топливных элементов, а также в создании аккумуляторов и накопителей энергии..
Транспорт и энергия
В течение последних десятилетий рассматривалось использование водорода в качестве источника энергии. Имплантация водорода в качестве топлива требует поиска безопасных и обратимых систем хранения и с большими объемными емкостями (количество водорода на единицу объема) и гравиметрическими (количество водорода на единицу массы).
алкилирование
Алкилирование (добавляют СН алкильные группы3R) органических соединений в основной среде, где присутствуют группы -ОН при низких концентрациях и температурах, превышающих температуру плавления гидрида.
В этом случае водороды присутствуют в гидриде магния (MgH2), присоединяются к группам -ОН, образующим воду. Свободный магний может получить галоген, который часто сопровождает алкильную молекулу, которая предназначена для связывания с углеводородной цепью.
риски
Реакция с водой
Как уже упоминалось, гидрид магния является веществом, которое очень легко и бурно реагирует с водой, демонстрируя способность взрываться при более высоких концентрациях..
Это происходит потому, что его экзотермическая реакция генерирует достаточно тепла, чтобы зажечь газообразный водород, выделяющийся в реакции разложения, что приводит к довольно опасной цепной реакции..
Это пирофор
Гидрид магния также пирофорен, что означает, что он может самопроизвольно воспламеняться в присутствии влажного воздуха и образует оксид магния и воду.
Его вдыхание не рекомендуется в твердом состоянии или в контакте с его парами: вещество в своем естественном состоянии и продукты его разложения могут вызвать серьезные травмы или даже смерть.
Он может генерировать коррозийные растворы при контакте с водой и ее загрязнении. Контакт с кожей и глазами не рекомендуется, а также вызывает раздражение слизистых оболочек.
Не было продемонстрировано, что гидрид магния может вызывать хронические последствия для здоровья, такие как рак, репродуктивные дефекты или другие физические или психические последствия, но рекомендуется использовать защитное оборудование при обращении с ним (особенно респираторы или маски, для его мелкий пыль характер).
При работе с этим веществом влажность воздуха должна поддерживаться на низком уровне, гасить все источники возгорания и транспортировать его в бочках или других контейнерных контейнерах..
Всегда следует избегать работы с большими концентрациями этого вещества, когда его можно избежать, так как вероятность взрыва значительно уменьшается.
В случае разлива гидрида магния рабочая зона должна быть изолирована, а пыль собирается пылесосом. Вы никогда не должны использовать сухой метод подметания; увеличивает шансы реакции с гидридом.
http://naukarus.com/gidroliz-gidrida-magniya-v-prisutstvii-soley-ammoniya
http://ru.thpanorama.com/articles/qumica/hidruro-de-magnesio-frmula-estructura-qumica-y-propiedades.html