УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10 КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИК


Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47, 48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22,23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3, 4, 5/2004
§ 7.3. Соли. Гидролиз
Взаимодействие ионов солей с водой – явление, широко распространенное в природе и играющее огромную роль как в технологии, так и в быту. От чего зависит рН океанских и речных вод, крови человека, газированной воды? Почему пекарные добавки поднимают тесто? Много других ответов поможет вам найти чтение этого раздела.
Водные растворы солей в зависимости от природы образующих их кислот и оснований могут быть кислотными, щелочными и нейтральными. Так, растворы хлорида аммония, хлорида железа или сульфата алюминия имеют кислотную среду. Растворы ацетата натрия, карбоната натрия (сода), ацетата кальция имеют основную (щелочную) реакцию. А растворы ацетата аммония, хлорида натрия (поваренная соль), сульфата натрия почти нейтральные. Почему? Кислотность раствора хлорида железа настолько велика, что в этом растворе цинк «растворяется» с выделением водорода, как в растворе соляной кислоты.
Кислотность или основность водных растворов солей объясняется протеканием в них реакций гидролиза. В широком понимании гидролиз – это любое взаимодействие вещества с водой. Сейчас мы будем изучать гидролиз как реакцию иона соли с водой.
Гидролиз – процесс, обратный нейтрализации (реакция между кислотой и основанием с выделением воды), а константа гидролиза записывается выражением, обратным выражению константы равновесия нейтрализации.
Большинство солей – сильные электролиты и находятся в водном растворе в виде ионов, поэтому уравнения реакции гидролиза следует записывать сокращенным молекульно-ионным способом, как реакцию между ионом и молекулами воды.
Характер протекания гидролиза, т. е. природа образующихся продуктов реакции, и среда получающегося раствора зависят от сочетания силы кислоты и силы основания, образующих соль. Возможны четыре варианта взаимодействия ионов соли в зависимости от ее природы.
1. Соль образована сильной кислотой и слабым основанием, например хлорид железа FeCl3, хлорид аммония NH4Cl, хлорид цинка ZnCl2, сульфат меди CuSO4.
Когда вас попросят написать уравнение реакции гидролиза соли (правильнее – гидролиз иона), обязательно напишите уравнение диссоциации соли на ионы. Например, обсудим гидролиз хлорида железа FeCl3. Уравнение диссоциации:
Далее следует (в уме) посмотреть, какой из ионов может реагировать с молекулой воды, помня, что молекула воды состоит из иона водорода Н + и гидроксид-иона ОН – . Возможна ли реакция иона железа с ионом водорода и хлорид-иона с гидроксид-ионом? Конечно, нет – ведь эти пары ионов имеют одинаковые заряды!
Возможна ли реакция между хлорид-ионом и молекулой воды (ее ионом водорода)? Реакция невозможна, т. к. образовалась бы молекула хлороводорода, которая в водном растворе является сильным электролитом и находится в состоянии исходных ионов.
Остается единственная возможность – реакция между ионом железа Fe 3+ и молекулой воды (ее гидроксид-ионом) с образованием слабого электролита – гидроксо-иона железа FeОН 2+ :
Fe 3+ + Н2О = FeОН 2+ + Н + .
Образующиеся ионы водорода обусловливают кислотную среду раствора (рН 2+ реагирует по второй ступени с еще одной молекулой воды:
Наконец, реакция проходит и по третьей ступени:
В водном растворе гидролиз по третьей ступени не проходит – из раствора хлорида железа не выпадает осадок гидроксида железа(III) Fe(ОН)3 из-за накопления ионов водорода Н + по первым двум ступеням, что смещает равновесие третьей ступени реакции гидролиза влево.
Чтобы реакция гидролиза прошла по третьей ступени, следует равновесие третьей ступени сместить вправо. Это можно сделать удалением ионов водорода Н + из сферы реакции, для чего достаточно ввести гидроксид-ионы приливанием раствора гидроксида натрия, что приводит к образованию слабого электролита – воды Н2О:
Таким образом, известная вам реакция образования осадка гидроксида железа(III) по реакции между хлоридом железа и гидроксидом натрия в водном растворе, обычно записываемая в других школьных учебниках уравнением
есть реакция гидролиза, смещенная вправо гидроксид-ионами. В тех же учебниках эта реакция называется реакцией обмена, что правильно только в том случае, если она проходит в кристаллическом состоянии (или в особых условиях в газовой фазе). В водном растворе нет хлорида железа, гидроксида натрия и хлорида натрия, а есть только составляющие их ионы.
Следовательно, реакцию гидролиза иона железа можно представить тремя уравнениями:
Fe 3+ + Н2О = FeОН 2+ + Н + ,
Реакцию гидролиза хлорида аммония NH4Cl, точнее иона аммония, записывают одним уравнением:

Образующийся ион водорода обусловливает кислотную среду раствора, т. е. рН + ]. Концентрацию иона аммония можно считать равной концентрации его соли, т. е. [
Тогда Кгидр = 

Второе преобразование. Умножим числитель и знаменатель на концентрацию того из ионов [Н + ] или [ОН — ], который с имеющейся в числителе концентрацией другого иона дает ионное произведение воды Кв. В данном случае умножим числитель и знаменатель на концентрацию гидроксид-ионов и получим новое выражение константы гидролиза:
Кгидр = 

Выражение 
NH4ОН = 
Косн =
Учитывая это, получаем новое выражение константы гидролиза:
Кгидр =
Это выражение показывает, что чем меньше константа диссоциации основания (или кислоты), тем больше константа гидролиза, тем сильнее смещено равновесие реакции гидролиза вправо и тем выше кислотность (основность) раствора, т. е. меньше (больше) значение рН.
Объединяем результаты двух преобразований выражения константы гидролиза:

Откуда [Н + ] = 
Пример. Рассчитать рН 0,01М раствора хлорида аммония. Константа диссоциации гидроксида аммония равна Косн = 1,79•10 -5 .
Воспользуемся приведенной выше формулой:
[Н + ] = 

pН = 5,6 (среда раствора кислотная).
Какой должна быть концентрация соляной кислоты, чтобы ее раствор имел такое же значение рН? Можно дать приближенный ответ.
Гидролиз
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Определение гидролиза
| Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». |
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
| Гидролиз солей — это реакция взаимодействия ионов соли с Н + и ОН − ионами воды, которая ведет к распаду исходного соединения. В результате такого ионного обмена образуется слабый электролит — кислотный, щелочной или нейтральный. |
Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
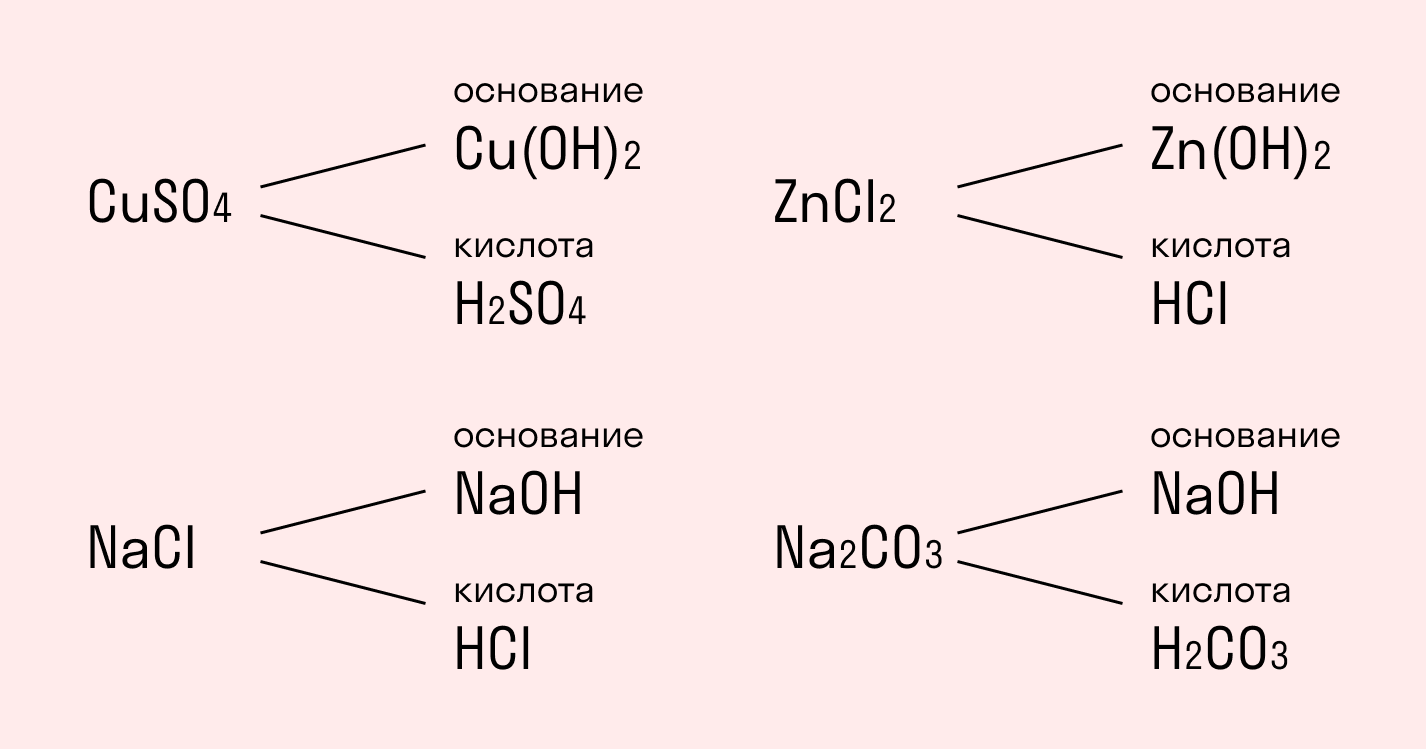
Начнем с того, что любая соль включает основание — амфотерный гидроксид, и кислотный остаток.
сульфат меди CuSO4состоит из основания Cu(ОН)2и кислоты H2SO4;
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
хлорид цинка ZnCl2состоит из основания Zn(ОН)2 и кислоты HCI;
карбонат натрия Na2CO3состоит из основания NaOH и кислоты H2CO3.
В жизни первым разрушается самое слабое, и гидролиз в химии действует по тому же принципу. В ходе этой реакции распадаются более слабые соединения (основания или кислотные остатки). Слабый катион или слабый анион вступают во взаимодействие с ионами воды и связывают один из них или оба. В растворе образуется избыток ионов H + или гидроксильная группа OH − .
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так:
XY + HOH ↔ XH + HOY
В данном случае:
XY — формула соли;
XH — кислотный остаток;
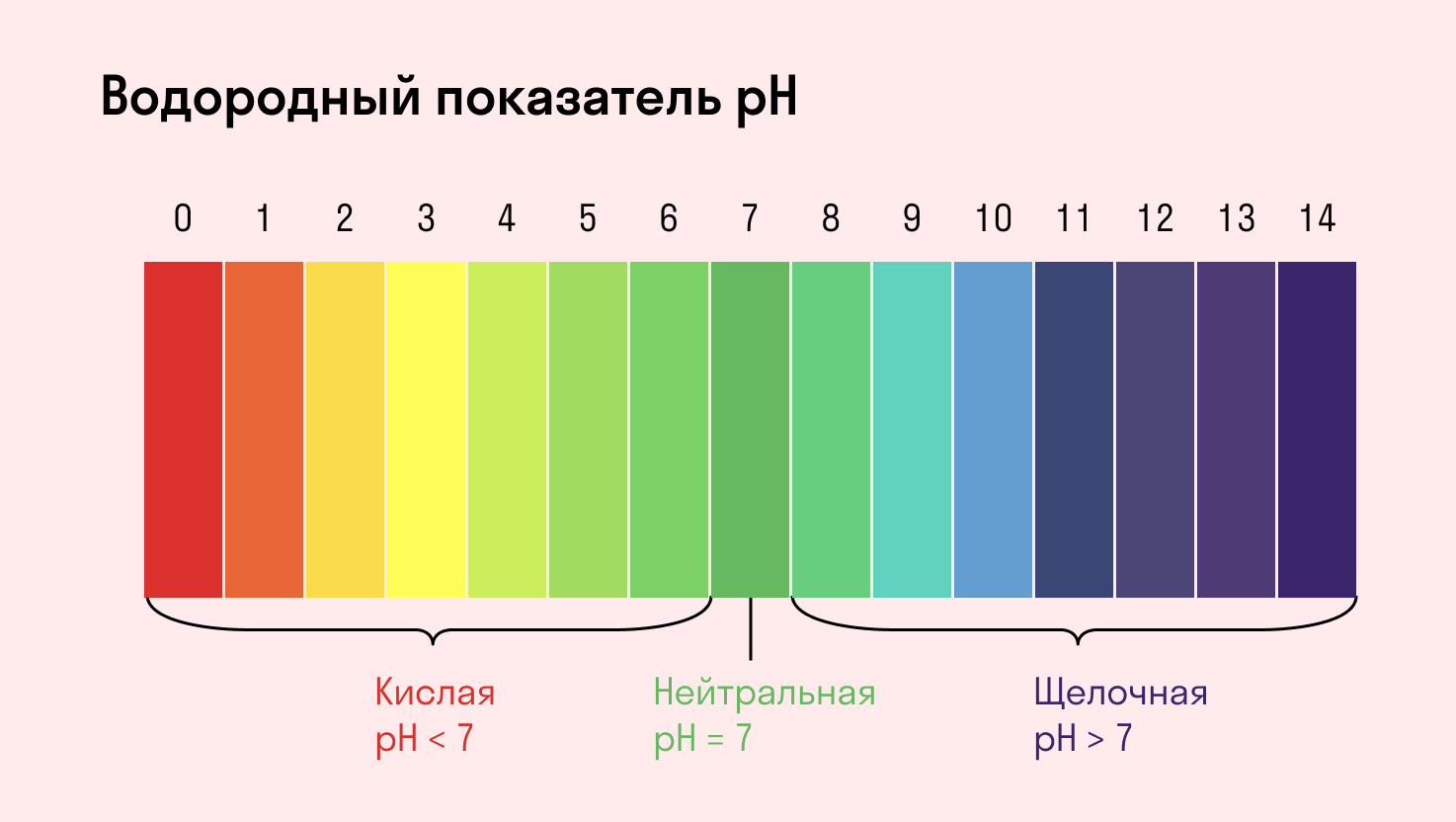
Индикаторы среды раствора
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
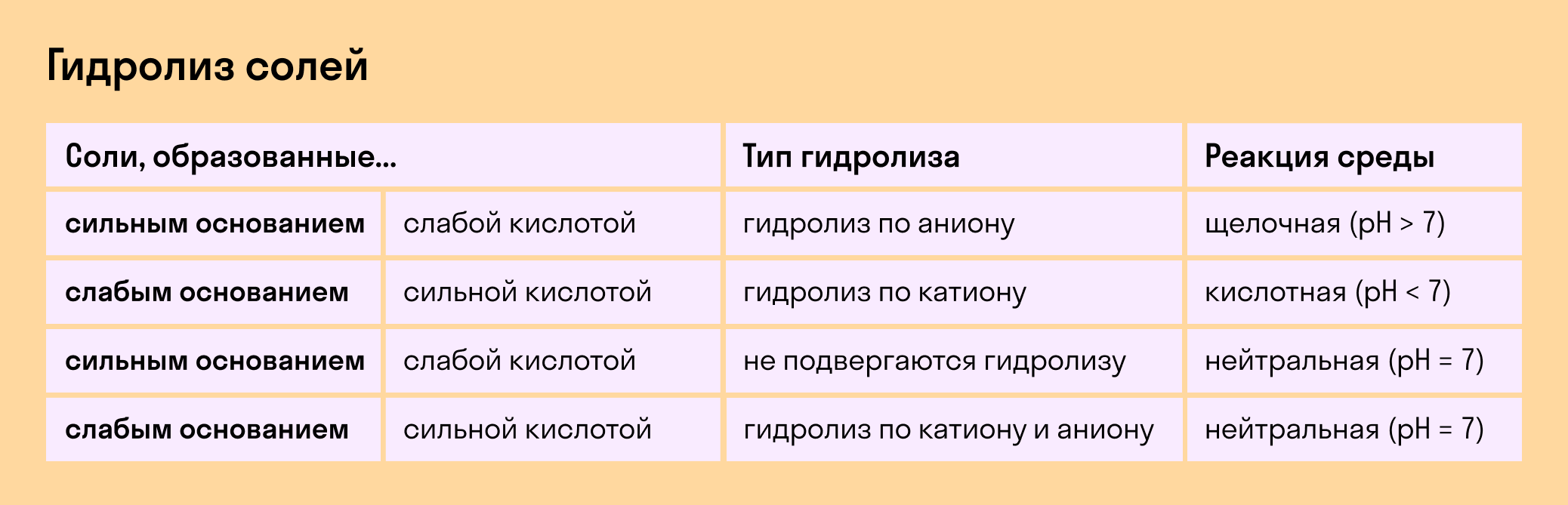
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Гидролиз по катиону. Как мы помним, гидролизация происходит только при наличии слабого иона, в данном случае — иона основания. Его катион вступает в реакцию и связывает гидроксид-ионы воды OH − . В итоге образуется раствор с избытком ионов водорода H + .
Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Нитрат аммония NH4NO3 состоит из слабого основания NH4OH и сильного кислотного остатка HNO3, поэтому он гидролизуется по катиону, то есть его катион NH4 + связывает ионы воды OH − .
Соль с сильным основанием и слабой кислотой
Гидролиз по аниону. Если слабым оказывается ион кислотного остатка, его отрицательно заряженная частица (анион) взаимодействует с катионом водорода H + в молекуле воды. В итоге получается раствор с повышенным содержанием OH − .
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Нитрат калия KNO2 отличается сильным основанием KOH и слабым кислотным остатком HNO2, поэтому он гидролизуется по аниону. Другими словами, анион кислоты NO2 − связывает ионы воды H + .
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K + + NO2 − + HOH ↔ HNO2 + K + + OH −
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH − а анион кислоты связывает ионы H +
Среда водного раствора: нейтральная, слабокислая или слабощелочная.
Реакция индикаторов: могут не изменить свой цвет.
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4 + + CN − + HOH ↔ NH4OH + HCN
Среда в данном случае будет слабощелочной.
Обобщим все эти сведения в таблице гидролиза солей.
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты;
если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания.
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: K2HCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Обратимый и необратимый гидролиз
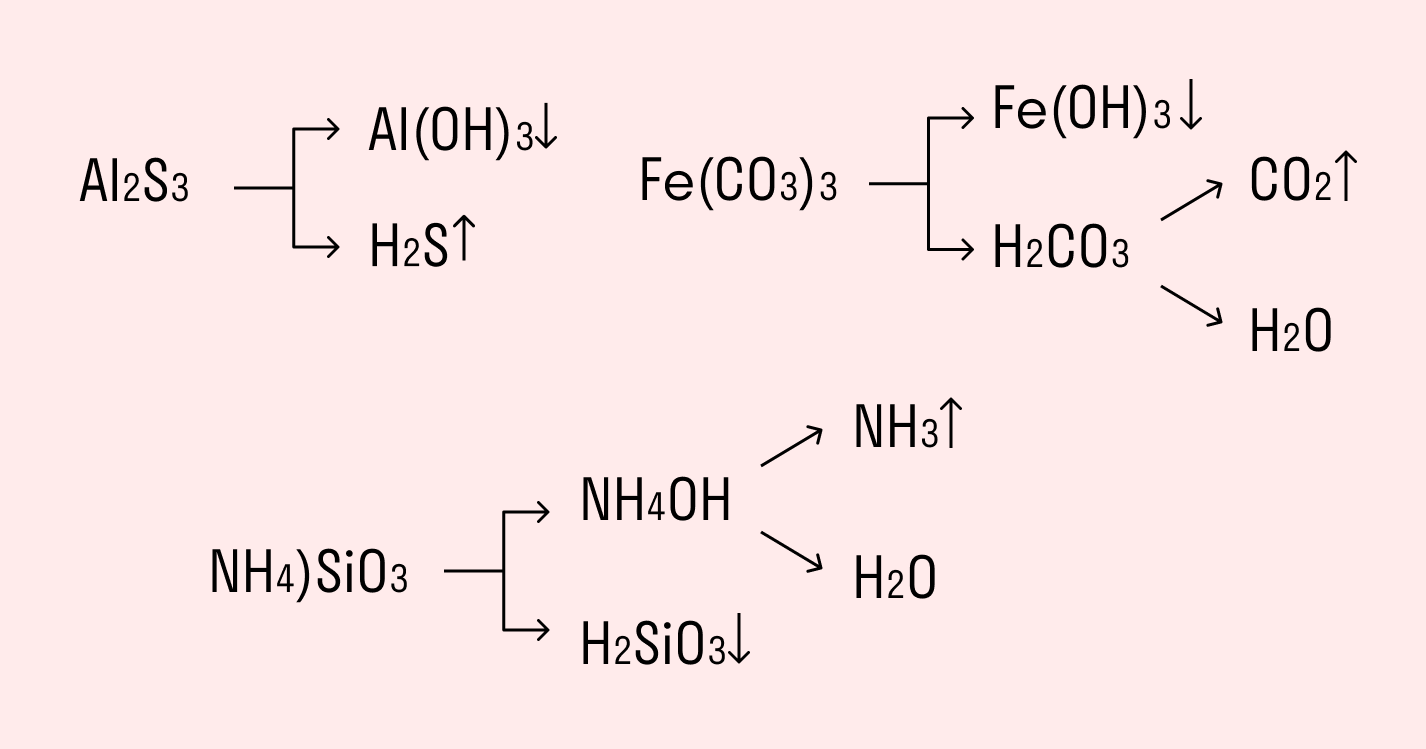
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
Например, полному гидролизу подвергается сульфид алюминия:
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимые реакции при взаимодействии с водой имеют место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h — степень гидролиза,
nгидр. — количество гидролизованного вещества,
nобщ. — общее количество растворенного в воде вещества.
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.
Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
Общая химия
Гидролиз солей
В общем случае гидролиз – это реакция обменного разложения вещества водой. Гидролизу подвержены соединения различных классов.
Гидролиз солей – процесс взаимодействия ионов, образовавшихся при диссоциации соли, с молекулами воды, сопровождающийся образованием слабых электролитов и изменением рН среды.
В реакции гидролиза вступают соли, образованные слабой кислотой и слабым основанием, или слабой кислотой и сильным основанием, или слабым основанием и сильной кислотой. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются
Растворы солей, образованных слабой кислотой и сильным основанием, имеют щелочную реакцию. Например при растворении в воде цианида калия он полностью диссоциирует (все соли сильные электролиты):
Образующиеся в результате диссоциации ионы калия соответствуют сильному электролиту КОН, а цианид-ионы — слабой циановодородной кислоте HCN. Ионы водорода, образовавшиеся в результате диссоциации молекул воды, связываются цианид-ионами в молекулы HCN, в результате в растворе накапливаются ионы гидроксила:
Обычно эти два процесса при записи объединяют, получая сокращенное ионное уравнение гидролиза:
рН этого раствора больше 7. Такой гидролиз называется гидролизом по аниону. Для него можно записать полное ионное:
K + + CN — + H2O =K + + HCN + OH —
и молекулярное уравнение:
Растворы солей, образованных слабым основанием и сильной кислотой, имеют кислую реакцию. Аналогично предыдущему примеру гидролиз хлорида аммония NH4Cl:
Диссоциация при растворении соли:
Слабому основанию — аммиаку — соответствует ион аммония NH4 + , он и будет взаимодействовать с молекулами воды образуя слабый электролит:
В растворе накапливаются ионы водорода, среда кислая, рН раствора меньше 7. Такой гидролиз называется гидролизом по катиону. Полное ионное уравнение:
Особенно глубоко протекает гидролиз солей, образованных слабой кислотой и слабым основанием. В этом случае происходит гидролиз по катиону и аниону. Пример — гидролиз сульфида аммония. Соль при растворении в воде диссоциирует:
Оба иона, образовавшиеся при диссоциации, соответствуют слабым элетролитам, поэтому протекает гидролиз по катиону:
Ионы водорода и гидроксила дают молекулы воды — среда не может быть одновременно кислотй и щелочной:
однако среда не будет нейтральной. Реакция среды будет определяться соотношением констант диссоциации кислоты и основания. Если больше константа диссоциации основания (основание сильнее кислоты), среда будет щелочной, если больше константа диссоциации кислоты (кислота сильнее основаниия) — кислой. В приведенном примере аммиак — более сильный электролит по сравнению с сероводородной кислотой, поэтому среда будет слабощелочной, рН > 7.
В редких случаях, когда константы диссоциации кислоты и основания практически одинаковы, например, при гидролизе ацетата аммония CH3COONH4, среда будет почти нейтральная.
Если соль образована многокислотным основанием или многоосновной кислотой, гидролиз протекает ступенчато. Пример — гидролиз хлорида железа(III). Диссоциация соли при растворении:
Ион Fe 3+ соответствует слабому трехкислотному основанию Fe(OH)3, он и подвергается ступенчатому гидролизу. I-я ступень:
Гидролиз по первой ступени всегда протекает в значительно большей степени, чем по второй. Кроме того, ионы, образующиеся при гидролизе по первой ступени (в рассмотренном примере — ионы H + ), способствуют смещению равновесия второйступени влево, т. е. также подавляют гидролиз по второй ступени. Поэтому в обычных условиях (комнатная температура, атмосферное давление) гидролизом по второй и последующим ступеням можно пренебречь.
Следующий пример — гидролиз карбоната натрия Na3CO3. Диссоциация:
Ион соответствует слабой двухосновной угольной кислоте, именно он и подвергается гидролизу. I-я ступень:
И опять в обычных условиях существенна только первая ступень гидролиза.
http://skysmart.ru/articles/chemistry/gidroliz
http://www.chem03.ru/index.php/data/index.php?id=33