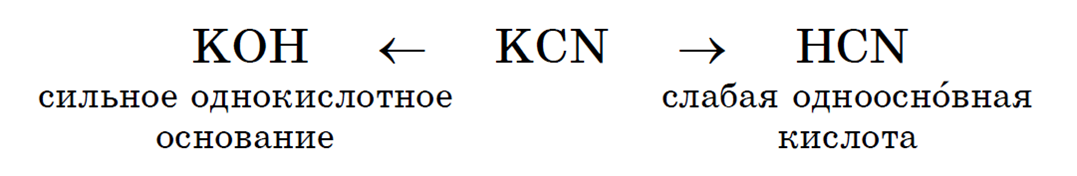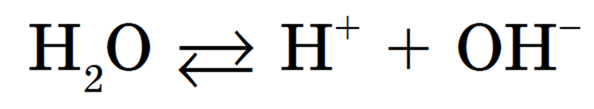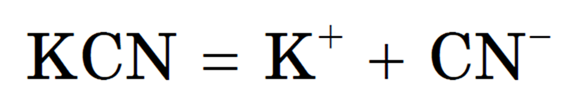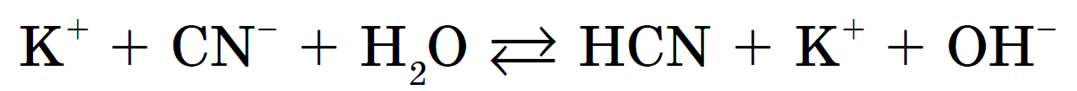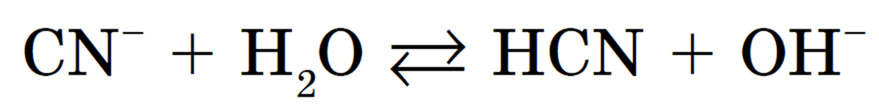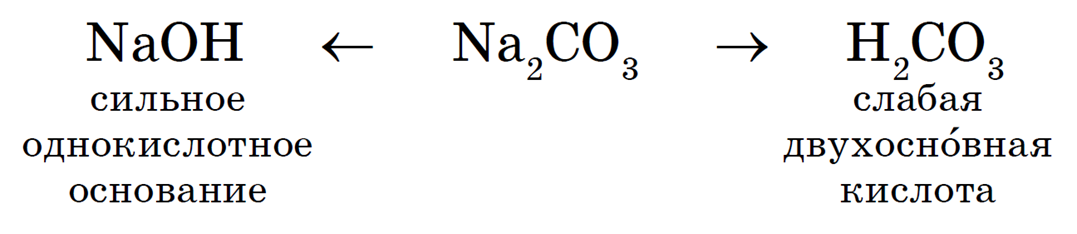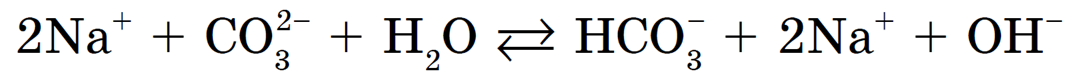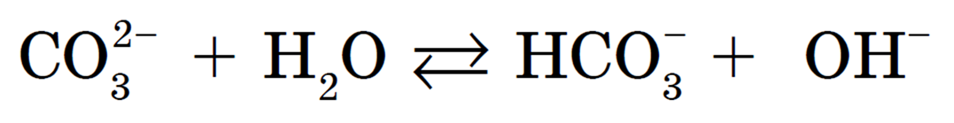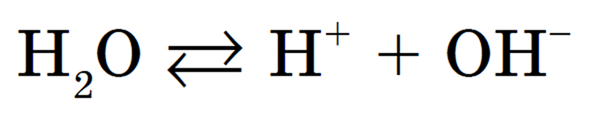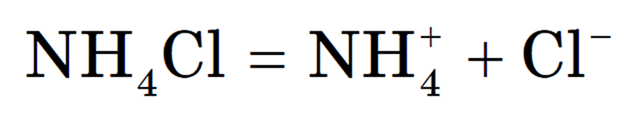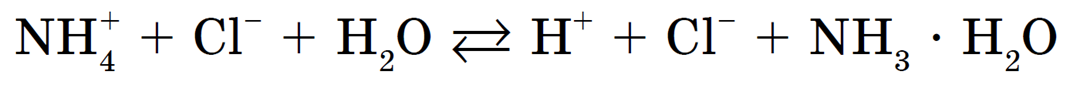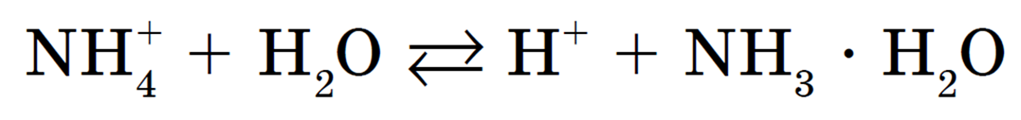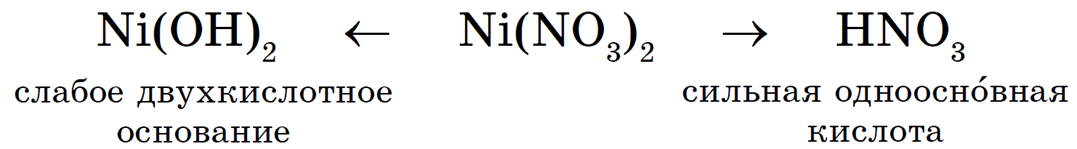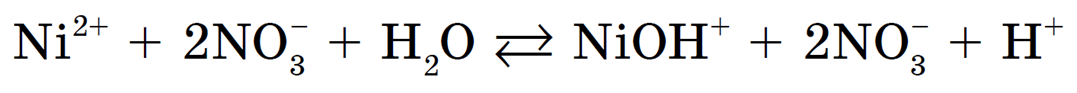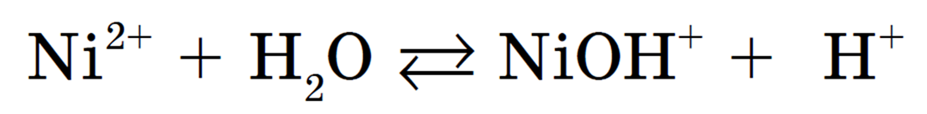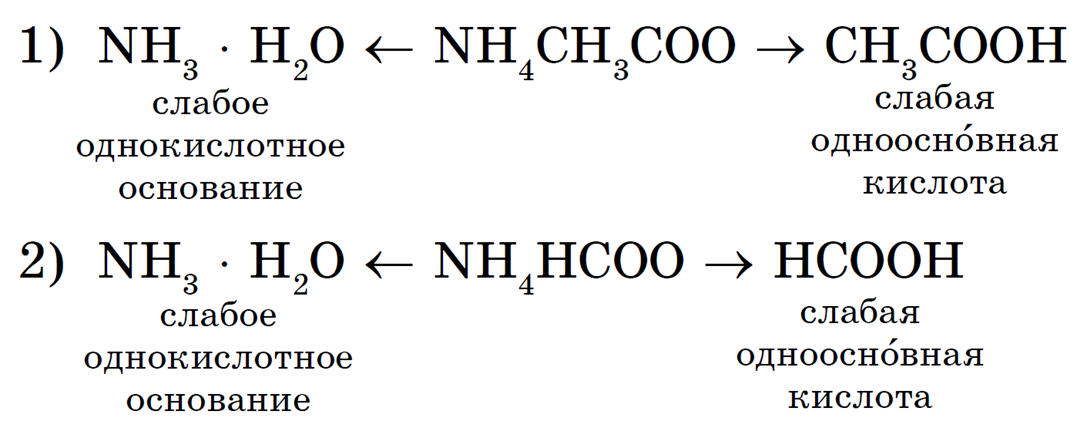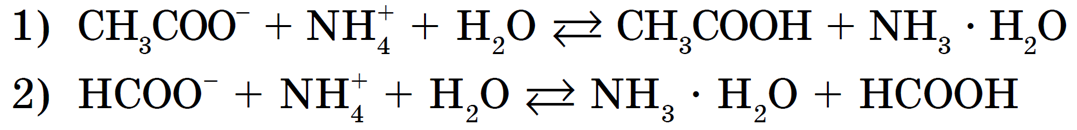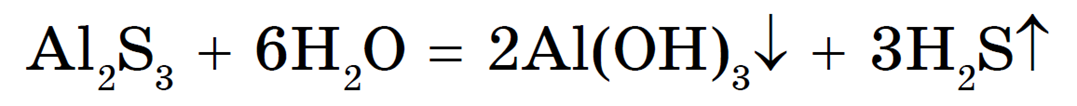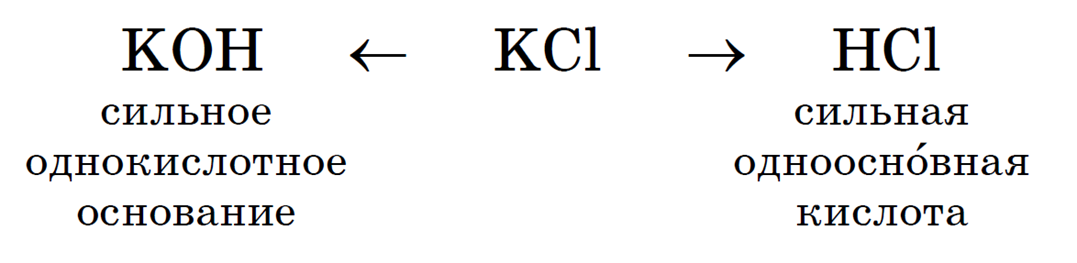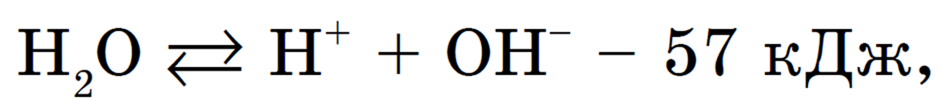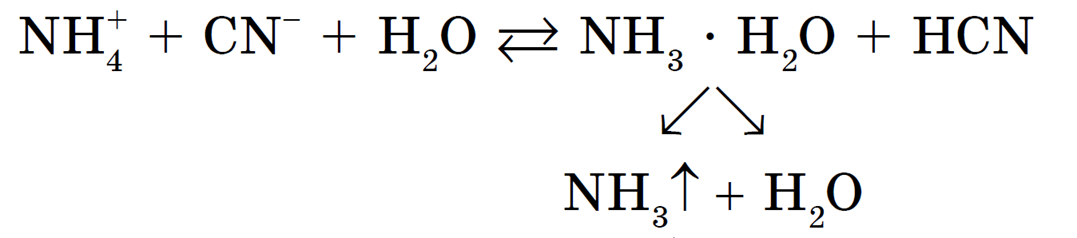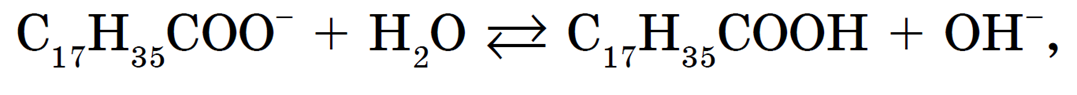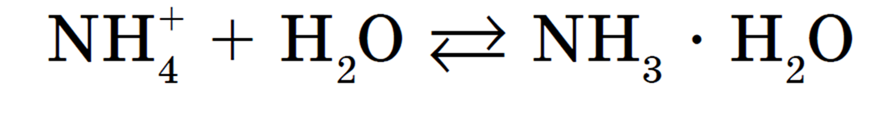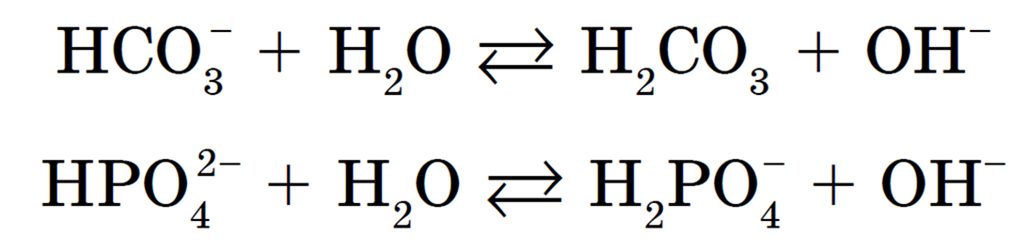Общая химия
Гидролиз солей
В общем случае гидролиз – это реакция обменного разложения вещества водой. Гидролизу подвержены соединения различных классов.
Гидролиз солей – процесс взаимодействия ионов, образовавшихся при диссоциации соли, с молекулами воды, сопровождающийся образованием слабых электролитов и изменением рН среды.
В реакции гидролиза вступают соли, образованные слабой кислотой и слабым основанием, или слабой кислотой и сильным основанием, или слабым основанием и сильной кислотой. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются
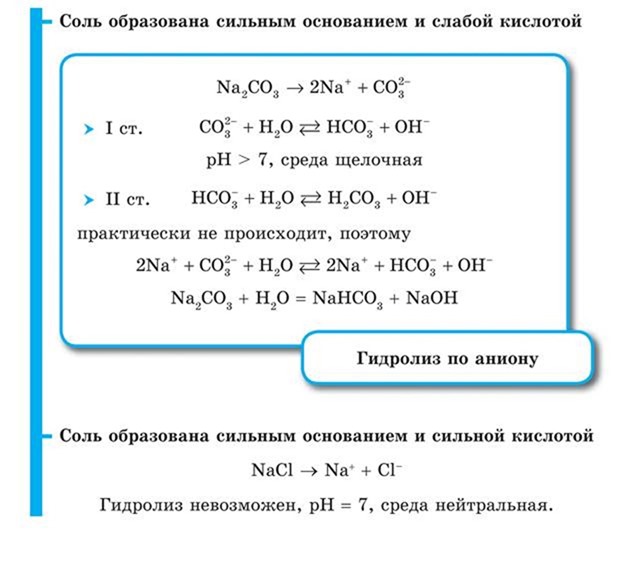
Растворы солей, образованных слабой кислотой и сильным основанием, имеют щелочную реакцию. Например при растворении в воде цианида калия он полностью диссоциирует (все соли сильные электролиты):
Образующиеся в результате диссоциации ионы калия соответствуют сильному электролиту КОН, а цианид-ионы — слабой циановодородной кислоте HCN. Ионы водорода, образовавшиеся в результате диссоциации молекул воды, связываются цианид-ионами в молекулы HCN, в результате в растворе накапливаются ионы гидроксила:
Обычно эти два процесса при записи объединяют, получая сокращенное ионное уравнение гидролиза:
рН этого раствора больше 7. Такой гидролиз называется гидролизом по аниону. Для него можно записать полное ионное:
K + + CN — + H2O =K + + HCN + OH —
и молекулярное уравнение:
Растворы солей, образованных слабым основанием и сильной кислотой, имеют кислую реакцию. Аналогично предыдущему примеру гидролиз хлорида аммония NH4Cl:
Диссоциация при растворении соли:
Слабому основанию — аммиаку — соответствует ион аммония NH4 + , он и будет взаимодействовать с молекулами воды образуя слабый электролит:
В растворе накапливаются ионы водорода, среда кислая, рН раствора меньше 7. Такой гидролиз называется гидролизом по катиону. Полное ионное уравнение:
Особенно глубоко протекает гидролиз солей, образованных слабой кислотой и слабым основанием. В этом случае происходит гидролиз по катиону и аниону. Пример — гидролиз сульфида аммония. Соль при растворении в воде диссоциирует:
Оба иона, образовавшиеся при диссоциации, соответствуют слабым элетролитам, поэтому протекает гидролиз по катиону:
Ионы водорода и гидроксила дают молекулы воды — среда не может быть одновременно кислотй и щелочной:
однако среда не будет нейтральной. Реакция среды будет определяться соотношением констант диссоциации кислоты и основания. Если больше константа диссоциации основания (основание сильнее кислоты), среда будет щелочной, если больше константа диссоциации кислоты (кислота сильнее основаниия) — кислой. В приведенном примере аммиак — более сильный электролит по сравнению с сероводородной кислотой, поэтому среда будет слабощелочной, рН > 7.
В редких случаях, когда константы диссоциации кислоты и основания практически одинаковы, например, при гидролизе ацетата аммония CH3COONH4, среда будет почти нейтральная.
Если соль образована многокислотным основанием или многоосновной кислотой, гидролиз протекает ступенчато. Пример — гидролиз хлорида железа(III). Диссоциация соли при растворении:
Ион Fe 3+ соответствует слабому трехкислотному основанию Fe(OH)3, он и подвергается ступенчатому гидролизу. I-я ступень:
Гидролиз по первой ступени всегда протекает в значительно большей степени, чем по второй. Кроме того, ионы, образующиеся при гидролизе по первой ступени (в рассмотренном примере — ионы H + ), способствуют смещению равновесия второйступени влево, т. е. также подавляют гидролиз по второй ступени. Поэтому в обычных условиях (комнатная температура, атмосферное давление) гидролизом по второй и последующим ступеням можно пренебречь.
Следующий пример — гидролиз карбоната натрия Na3CO3. Диссоциация:
Ион соответствует слабой двухосновной угольной кислоте, именно он и подвергается гидролизу. I-я ступень:
И опять в обычных условиях существенна только первая ступень гидролиза.
УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10 КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИК


Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47, 48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22,23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3, 4, 5/2004
§ 7.3. Соли. Гидролиз
Взаимодействие ионов солей с водой – явление, широко распространенное в природе и играющее огромную роль как в технологии, так и в быту. От чего зависит рН океанских и речных вод, крови человека, газированной воды? Почему пекарные добавки поднимают тесто? Много других ответов поможет вам найти чтение этого раздела.
Водные растворы солей в зависимости от природы образующих их кислот и оснований могут быть кислотными, щелочными и нейтральными. Так, растворы хлорида аммония, хлорида железа или сульфата алюминия имеют кислотную среду. Растворы ацетата натрия, карбоната натрия (сода), ацетата кальция имеют основную (щелочную) реакцию. А растворы ацетата аммония, хлорида натрия (поваренная соль), сульфата натрия почти нейтральные. Почему? Кислотность раствора хлорида железа настолько велика, что в этом растворе цинк «растворяется» с выделением водорода, как в растворе соляной кислоты.
Кислотность или основность водных растворов солей объясняется протеканием в них реакций гидролиза. В широком понимании гидролиз – это любое взаимодействие вещества с водой. Сейчас мы будем изучать гидролиз как реакцию иона соли с водой.
Гидролиз – процесс, обратный нейтрализации (реакция между кислотой и основанием с выделением воды), а константа гидролиза записывается выражением, обратным выражению константы равновесия нейтрализации.
Большинство солей – сильные электролиты и находятся в водном растворе в виде ионов, поэтому уравнения реакции гидролиза следует записывать сокращенным молекульно-ионным способом, как реакцию между ионом и молекулами воды.
Характер протекания гидролиза, т. е. природа образующихся продуктов реакции, и среда получающегося раствора зависят от сочетания силы кислоты и силы основания, образующих соль. Возможны четыре варианта взаимодействия ионов соли в зависимости от ее природы.
1. Соль образована сильной кислотой и слабым основанием, например хлорид железа FeCl3, хлорид аммония NH4Cl, хлорид цинка ZnCl2, сульфат меди CuSO4.
Когда вас попросят написать уравнение реакции гидролиза соли (правильнее – гидролиз иона), обязательно напишите уравнение диссоциации соли на ионы. Например, обсудим гидролиз хлорида железа FeCl3. Уравнение диссоциации:
Далее следует (в уме) посмотреть, какой из ионов может реагировать с молекулой воды, помня, что молекула воды состоит из иона водорода Н + и гидроксид-иона ОН – . Возможна ли реакция иона железа с ионом водорода и хлорид-иона с гидроксид-ионом? Конечно, нет – ведь эти пары ионов имеют одинаковые заряды!
Возможна ли реакция между хлорид-ионом и молекулой воды (ее ионом водорода)? Реакция невозможна, т. к. образовалась бы молекула хлороводорода, которая в водном растворе является сильным электролитом и находится в состоянии исходных ионов.
Остается единственная возможность – реакция между ионом железа Fe 3+ и молекулой воды (ее гидроксид-ионом) с образованием слабого электролита – гидроксо-иона железа FeОН 2+ :
Fe 3+ + Н2О = FeОН 2+ + Н + .
Образующиеся ионы водорода обусловливают кислотную среду раствора (рН 2+ реагирует по второй ступени с еще одной молекулой воды:
Наконец, реакция проходит и по третьей ступени:
В водном растворе гидролиз по третьей ступени не проходит – из раствора хлорида железа не выпадает осадок гидроксида железа(III) Fe(ОН)3 из-за накопления ионов водорода Н + по первым двум ступеням, что смещает равновесие третьей ступени реакции гидролиза влево.
Чтобы реакция гидролиза прошла по третьей ступени, следует равновесие третьей ступени сместить вправо. Это можно сделать удалением ионов водорода Н + из сферы реакции, для чего достаточно ввести гидроксид-ионы приливанием раствора гидроксида натрия, что приводит к образованию слабого электролита – воды Н2О:
Таким образом, известная вам реакция образования осадка гидроксида железа(III) по реакции между хлоридом железа и гидроксидом натрия в водном растворе, обычно записываемая в других школьных учебниках уравнением
есть реакция гидролиза, смещенная вправо гидроксид-ионами. В тех же учебниках эта реакция называется реакцией обмена, что правильно только в том случае, если она проходит в кристаллическом состоянии (или в особых условиях в газовой фазе). В водном растворе нет хлорида железа, гидроксида натрия и хлорида натрия, а есть только составляющие их ионы.
Следовательно, реакцию гидролиза иона железа можно представить тремя уравнениями:
Fe 3+ + Н2О = FeОН 2+ + Н + ,
Реакцию гидролиза хлорида аммония NH4Cl, точнее иона аммония, записывают одним уравнением:

Образующийся ион водорода обусловливает кислотную среду раствора, т. е. рН + ]. Концентрацию иона аммония можно считать равной концентрации его соли, т. е. [
Тогда Кгидр = 

Второе преобразование. Умножим числитель и знаменатель на концентрацию того из ионов [Н + ] или [ОН — ], который с имеющейся в числителе концентрацией другого иона дает ионное произведение воды Кв. В данном случае умножим числитель и знаменатель на концентрацию гидроксид-ионов и получим новое выражение константы гидролиза:
Кгидр = 

Выражение 
NH4ОН = 
Косн =
Учитывая это, получаем новое выражение константы гидролиза:
Кгидр =
Это выражение показывает, что чем меньше константа диссоциации основания (или кислоты), тем больше константа гидролиза, тем сильнее смещено равновесие реакции гидролиза вправо и тем выше кислотность (основность) раствора, т. е. меньше (больше) значение рН.
Объединяем результаты двух преобразований выражения константы гидролиза:

Откуда [Н + ] = 
Пример. Рассчитать рН 0,01М раствора хлорида аммония. Константа диссоциации гидроксида аммония равна Косн = 1,79•10 -5 .
Воспользуемся приведенной выше формулой:
[Н + ] = 

pН = 5,6 (среда раствора кислотная).
Какой должна быть концентрация соляной кислоты, чтобы ее раствор имел такое же значение рН? Можно дать приближенный ответ.
Тема №36 «Гидролиз солей»
Согласно теории электролитической диссоциации в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза.
Гидролиз солей
Оглавление
Реакция гидролиза
Согласно теории электролитической диссоциации в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза.
Гидролиз — это реакция обменного разложения вещества водой.
Гидролизу подвергаются различные вещества: неорганические — соли, карбиды и гидриды металлов, галогениды неметаллов; органические — галогеналканы, сложные эфиры и жиры, углеводы, белки, полинуклеотиды.
Водные растворы солей имеют разные значения рН и различные типы сред — кислотную (рН 7), нейтральную (рН = 7). Это объясняется тем, что соли в водных растворах могут подвергаться гидролизу.
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов Н + или ОН — , и раствор соли становится кислотным или щелочным соответственно.
Классификация солей
Любую соль можно представить как продукт взаимодействия основания с кислотой. Например, соль KClO образована сильным основанием KOH и слабой кислотой HClO.
В зависимости от силы основания и кислоты можно выделить четыре типа солей.
Рассмотрим поведение солей различных типов в растворе.
1. Соли, образованные сильным основанием и слабой кислотой.
Например, соль цианид калия KCN образована сильным основанием KOH и слабой кислотой HCN:
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения:
2) полная диссоциация соли (сильного электролита):
Образующиеся при этих процессах ионы Н + и CN — взаимодействуют между собой, связываясь в молекулы слабого электролита — цианистоводородной кислоты HCN, тогда как гидроксид — ион ОН — остается в растворе, обусловливая тем самым его щелочную среду. Происходит гидролиз по аниону CN — .
Запишем полное ионное уравнение происходящего процесса (гидролиза):
Этот процесс обратим, и химическое равновесие смещено влево (в сторону образования исходных веществ), т. к. вода — значительно более слабый электролит, чем цианистоводородная кислота HCN:
Уравнение показывает, что:
1) в растворе есть свободные гидроксид-ионы ОН — , и концентрация их больше, чем в чистой воде, поэтому раствор соли KCN имеет щелочную среду (рН > 7);
2) в реакции с водой участвуют ионы CN — , в таком случае говорят, что идет гидролиз по аниону. Другие примеры анионов слабых кислот, которые участвуют в реакции с водой:
• муравьиной HCOOH — анион HCOO — ;
• уксусной CH3COOH — анион CH3COO — ;
• сероводородной H2S — анион S 2- ;
Рассмотрим гидролиз карбоната натрия Na2CO3:
Происходит гидролиз соли по аниону CO3 2- . Полное ионное уравнение гидролиза:
Сокращенное ионное уравнение гидролиза:
Продукты гидролиза — кислая соль NaHCO3 и гидроксид натрия NaOH.
Среда водного раствора карбоната натрия — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН — . Кислая соль NaHCO3 тоже может подвергаться гидролизу, который протекает в очень незначительной степени, и им можно пренебречь.
Подведем итог тому, что вы узнали о гидролизе по аниону:
1) по аниону соли, как правило, гидролизуются обратимо;
2) химическое равновесие в таких реакциях сильно смещено влево;
3) реакция среды в растворах подобных солей щелочная (рН > 7);
4) при гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
2. Соли, образованные сильной кислотой и слабым основанием.
Рассмотрим гидролиз хлорида аммония NH4Cl.
В водном растворе соли происходят два процесса:
1) незначительная обратимая диссоциация молекул воды (очень слабого амфотерного электролита), которую упрощенно можно записать с помощью уравнения:
2) полная диссоциация соли (сильного электролита):
Образующиеся при этом ионы OH — и NH4 взаимодействуют между собой с получением NH3 • H2O (слабый электролит), тогда как ионы Н + остаются в растворе, обусловливая тем самым его кислотную среду.
Полное ионное уравнение гидролиза:
Процесс обратим, химическое равновесие смещено в сторону образования исходных веществ, т. к. вода Н2О — значительно более слабый электролит, чем гидрат аммиака NH3 • H2O.
Сокращенное ионное уравнение гидролиза:
Уравнение показывает, что:
1) в растворе есть свободные ионы водорода Н + , и их концентрация больше, чем в чистой воде, поэтому раствор соли имеет кислотную среду (pH + ; в таком случае говорят, что идет гидролиз по катиону.
В реакции с водой могут участвовать и многозарядные катионы: двухзарядные М 2+ (например, Ni 2 +, Cu 2 +, Zn 2+ …), кроме катионов щелочноземельных металлов, трехзарядные М 3 + (например, Fe 3 +, Al 3 +, Cr 3+ …).
Рассмотрим гидролиз нитрата никеля Ni(NO3)2, гидролиз соли по катиону:
Происходит гидролиз соли по катиону Ni 2+ .
Полное ионное уравнение гидролиза:
Сокращенное ионное уравнение:
Продукты гидролиза — основная соль NiOHNO3 и азотная кислота HNO3.
Среда водного раствора нитрата никеля кислотная (рН + .
Гидролиз соли NiOHNO3 протекает в значительно меньшей степени, и им можно пренебречь. Таким образом:
1) по катиону соли, как правило, гидролизуются обратимо;
2) химическое равновесие реакций сильно смещено влево;
3) реакция среды в растворах таких солей кислотная (рН — из молекул воды, образуя слабое основание; анион слабой кислоты связывает ионы Н + из молекул воды, образуя слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислотной или слабощелочной. Это зависит от констант диссоциации двух слабых электролитов — кислоты и основания, которые образуются в результате гидролиза.
Например, рассмотрим гидролиз двух солей: ацетата аммония NH4CH3COO и формиата аммония NH4HCCO:
В водных растворах этих солей катионы слабого основания NH + взаимодействуют с гидроксид-ионами ОН — (напомним, что вода диссоциирует H2O = H + + OH — ), а анионы слабых кислот CH3COO — и HCOO — взаимодействуют с катионами Н + с образованием молекул слабых кислот — уксусной CH3COOH и муравьиной HCOOH.
Запишем ионные уравнения гидролиза:
В этих случаях гидролиз тоже обратимый, но равновесие смещено в сторону образования продуктов гидролиза — двух слабых электролитов.
В первом случае среда раствора нейтральная (рН = 7), т. к. Kд(CH3COOH) = Kд(NH3 • H2O) = 1,8 • 10 -5 . Во втором случае среда раствора будет слабокислотной (pH -4 и Kд(NH3 • H2O) + связываются образующимися при гидролизе по аниону ионами ОН — . Это усиливает гидролиз и приводит к образованию нерастворимого гидроксида алюминия и газообразного сероводорода:
Поэтому сульфид алюминия Al2S3 нельзя получить реакцией обмена между водными растворами двух солей, например, хлорида алюминия AlCl3 и сульфида натрия Na2S.
В результате гидролиза и по катиону, и по аниону:
1) если соли гидролизуются и по катиону, и по аниону обратимо, то химическое равновесие в реакциях гидролиза смещено вправо; реакция среды при этом или нейтральная, или слабокислотная, или слабощелочная, что зависит от соотношения констант диссоциации образующихся основания и кислоты;
2) соли могут гидролизоваться и по катиону, и по аниону необратимо, если хотя бы один из продуктов гидролиза уходит из сферы реакции.
4. Соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу.
Рассмотрим «поведение» в растворе хлорида калия KCl.
Соль в водном растворе диссоциирует на ионы (KCl = K + + Cl — ), но при взаимодействии с водой слабый электролит образоваться не может. Среда раствора нейтральная (рН = 7), т. к. концентрации ионов Н + и ОН — в растворе равны, как в чистой воде.
Другими примерами подобных солей могут быть галогениды, нитраты, перхлораты, сульфаты, хроматы и дихроматы щелочных металлов, галогениды (кроме фторидов), нитраты и перхлораты щелочноземельных металлов.
Следует также отметить, что реакция обратимого гидролиза полностью подчиняется принципу Ле Шателье. Поэтому гидролиз соли можно усилить (и даже сделать необратимым) следующими способами:
1) добавить воды (уменьшить концентрацию);
2) нагреть раствор, при этом усиливается эндотермическая диссоциация воды:
, а значит, увеличивается количество Н + и ОН — , которые необходимы для осуществления гидролиза соли;
3) связать один из продуктов гидролиза в труднорастворимое соединение или удалить один из продуктов в газовую фазу; например, гидролиз цианида аммония NH4CN будет значительно усиливаться за счет разложения гидрата аммиака с образованием аммиака NH3 и воды Н2О:
Гидролиз можно подавить (значительно уменьшить количество подвергающейся гидролизу соли), действуя следующим образом:
1) увеличить концентрацию растворенного вещества;
2) охладить раствор (для ослабления гидролиза растворы солей следует хранить концентрированными и при низких температурах);
3) ввести в раствор один из продуктов гидролиза; например, подкислять раствор, если его среда в результате гидролиза кислотная, или подщелачивать, если щелочная.
Значение гидролиза
Гидролиз солей имеет и практическое, и биологическое значение.
Еще в древности в качестве моющего средства использовали золу. В золе содержится карбонат калия K2CO3, который в воде гидролизуется по аниону, водный раствор приобретает мылкость за счет образующихся при гидролизе ионов ОН — .
В настоящее время в быту мы используем мыло, стиральные порошки и другие моющие средства. Основной компонент мыла — это натриевые и калиевые соли высших жирных карбоновых кислот: стеараты, пальмитаты, которые гидролизуются.
Гидролиз стеарата натрия C17H35COONa выражается следующим ионным уравнением:
т. е. раствор имеет слабощелочную среду.
Соли, создающие необходимую щелочную среду раствора, содержатся в фотографическом проявителе. Это карбонат натрия Na2CO3, карбонат калия K2CO3, бура Na2B4O7 и другие соли, гидролизующиеся по аниону.
Если кислотность почвы недостаточна, у растений появляется болезнь — хлороз. Ее признаки — пожелтение или побеление листьев, отставание в росте и развитии. Если рН > 7,5, то в нее почвы вносят удобрение сульфат аммония (NH4)2SO4, которое способствует повышению кислотности благодаря гидролизу по катиону, проходящему в почве:
Неоценима биологическая роль гидролиза некоторых солей, входящих в состав нашего организма.
Например, в состав крови входят соли гидрокарбонат и гидрофосфат натрия. Их роль заключается в поддержании определенной реакции среды.
Это происходит за счет смещения равновесия процессов гидролиза:
Если в крови избыток ионов Н + , они связываются с гидроксид-ионами ОН — , и равновесие смещается вправо. При избытке гидроксид-ионов ОН — равновесие смещается влево. Благодаря этому кислотность крови здорового человека колеблется незначительно.
Или например: в составе слюны человека есть ионы HPO4 — . Благодаря им в полости рта поддерживается определенная среда (рН = 7-7,5).
Шпаргалка
Справочный материал для прохождения тестирования:
http://him.1sept.ru/article.php?ID=200400702
http://chem-mind.com/2017/04/26/%D1%82%D0%B5%D0%BC%D0%B0-%E2%84%9636-%D0%B3%D0%B8%D0%B4%D1%80%D0%BE%D0%BB%D0%B8%D0%B7-%D1%81%D0%BE%D0%BB%D0%B5%D0%B9/