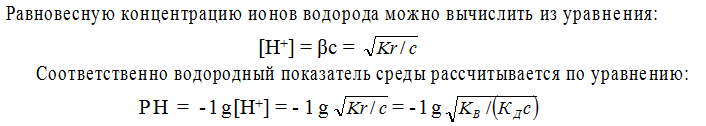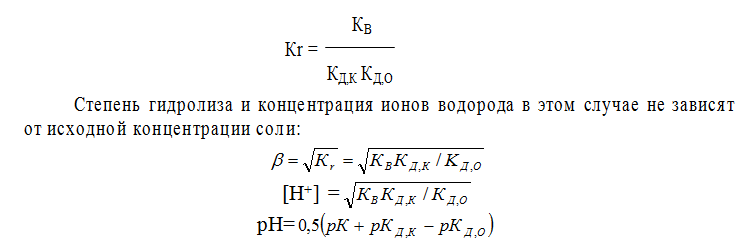Гидролиз какой соли описывается уравнением s2
1.4. Гидролиз солей
Гидролиз – процесс обменного взаимодействия ионов соли с водой, приводящий к образованию малодиссоциированных веществ и сопровождающийся изменением реакции ( pH ) среды.
Суть гидролиза солей заключается в том, что происходит смещение равновесия диссоциации воды вследствие связывания одного из ее ионов с образованием малодиссоциированного или труднорастворимого вещества. В результате гидролиза могут образовываться молекулы слабых кислот и оснований, анионы кислых солей или катионы основных солей. В большинстве случаев гидролиз является обратимым процессом. При повышении температуры и разбавлении гидролиз усиливается. Гидролиз идет по-разному в зависимости от силы кислоты и основания, образовавших соль. Рассмотрим различные случаи гидролиза солей.
а) Соль образована слабой кислотой и сильным основанием ( K 2 S ).
При растворении в воде K2S диссоциирует
K2S
При составлении уравнений гидролиза в первую очередь необходимо определить ионы соли, связывающие ионы воды в малодиссоциирующие соединения, т.е. ионы, обусловливающие гидролиз.
В данном случае ионы S 2- связывают катион H + , образуя ион HS –
S 2– +H2O
Уравнение гидролиза в молекулярной форме
K2S + H2O
Практически гидролиз соли преимущественно ограничивается первой ступенью с образованием кислой соли (в данном случае KHS). Таким образом, гидролиз соли, образованной сильным основанием и слабой кислотой (такой, как K2S) протекает по аниону соли. Избыток ионов OH – в растворе обусловливает щелочную реакцию среды в растворе (pН>7).
При растворении в воде CuCl2 диссоциирует
СuCl2
Ионы Cu 2+ соединяются с ионами OH – , образуя гидроксоионы CuOH + . Гидролиз соли ограничивается первой ступенью, и образование молекулы Cu(OH)2 не происходит. Ионно-молекулярное уравнение имеет вид
Cu 2+ + HOH
В данном случае продуктами гидролиза являются основная соль и кислота. Уравнение гидролиза в молекулярной форме записывается следующим образом
CuCl2 + H2O
Таким образом, гидролиз соли, образованной слабым основанием и сильной кислотой (в данном случае CuCl2) протекает по катиону соли. Избыток ионов H + в растворе обусловливает кислую реакцию среды в растворе (рН
При растворении в воде Al 2 ( SO 4 )3 диссоциирует
Al 2 ( SO 4 )3
В данном случае ионы Al 3+ соединяются с ионами ОН — , образуя гидроксоионы AlOH 2+ . Гидролиз соли ограничивается первой ступенью, и образование молекулы Al ( OH )3 не происходит. Ионно-молекулярное уравнение имеет вид
Al 3+ + Н2О 
Продуктами электролиза является основная соль и кислота.
Уравнение гидролиза в молекулярной форме записывается следующим образом
Al2(SO4)3+2 Н 2 О 
в) Соль образована слабой кислотой и слабым основанием (CH3COONH4).
CH3COO – + NH4 + + H2O 
В этом случае образуются два малодиссоциированных соединения, и pH раствора зависит от относительной силы кислоты и основания. Если продукты гидролиза могут удаляться из раствора, то гидролиз протекает до конца. Например
Возможны и другие случаи необратимого гидролиза, их нетрудно предсказать, ведь для необратимости процесса небходимо, чтобы хотя бы один из продуктов гидролиза уходил из сферы реакции.
г) Соли, образованные сильной кислотой и сильным основанием ( NaCl , K 2 SO 4 , RbBr и др.) гидролизу не подвергаются, т.к. единственным малодиссоциирующим соединением является H2O (рН=7). Растворы этих солей имеют нейтральную среду. Например
NaCl + H 2 O 
Na + + Cl – + H2O 
H 2 O 
Реакции обратимого гидролиза полностью подчиняются принципу Ле–Шателье. Поэтому гидролиз соли можно усилить (и даже сделать необратимым) следующими способами:
1) добавить воды;
2) нагреть раствор, при этом усиливается эндотермическая диссоциация воды, а значит, увеличивается количество ионов Н + и ОН – , которые необходимы для осуществления гидролиза соли;
3) связать один из продуктов гидролиза в труднорастворимое соединение или удалить один из продуктов в газовую фазу; например, гидролиз цианида аммония NH 4 CN будет значительно усиливаться за счет разложения гидрата аммиака с образованием аммиака NH 3 и воды:
NH4 + + CN – + H2O 
Гидролиз можно подавить , действуя следующим образом:
1) увеличить концентрацию растворенного вещества;
2) охладить раствор ( для ослабления гидролиза растворы солей следует хранить концентрированными и при низких температурах);
3) ввести в раствор один из продуктов гидролиза; например, подкислять раствор, если его среда в результате гидролиза кислая, или подщелачивать, если щелочная.
Взаимное усиление гидролиза Допустим, что в разных сосудах установились равновесия
CO3 2– + H2O 
Al 3+ + H2O 
Обе соли гидролизованы незначительно, но если растворы смешать, то происходит связывание ионов H + и OH – . В соответствии с принципом Ле-Шателье оба равновесия смещаются вправо, гидролиз усиливается и протекает полностью
Это называется взаимным усилением гидролиза. Таким образом, если смешивать растворы солей, из которых одна гидролизуется по катиону, а другая – по аниону, гидролиз усиливается и протекает полностью.
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
A25. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
8- 25-1 . При сливании растворов хлорида алюминия и карбоната натрия.
1) образуется только осадок, а газ не выделяется 2) образуется осадок и выделяется газ
3) выделяется газ, а раствор остается прозрачным 4) ничего не происходит
8-25-2. В водных растворах не подвергается гидролизу
1)сульфат натрия 2)сульфат алюминия 3)сульфит натрия 4)сульфат меди
8-25- 3. В водных растворах не подвергается гидролизу хлорид
1) меди 2) бария 3) цинка 4) бериллия
8-25- 4. В водных растворах необратимо гидродролизуются
А) нитрат железа(III) Б) нитрат железа(II) В) фосфат натрия
Г) сульфид алюминия Д) силикат аммония Е) нитрат цезия
1) А,Б,Е 2) В, Д 3) Г 4)Г, Д
8-25- 5. Гидролиз по аниону имеет место в водных растворах:
1) А, Б, Е 2) В, Г, Д 3) Г, Д 4)В, Д
8- 25-6 .Полному и необратимому гидролизу подвергается
1) сульфид алюминия 2) силикат натрия 3) сульфид калия 4) хлорид бария
8 -25-7 . Какое вещество полностью гидролизуется в водном растворе?
8- 25-8 . И анион, и катион гидролизуются в растворе соли
1) силикат натрия 2) сульфид аммония 3) ацетат калия 4) хлорид меди(II)
8-2 5-9 . Только анион гидролизуется в растворе соли
1) ацетат аммония 2) иодид калия 3) бромид алюминия 4) фторид натрия
8-25-10. Соль, которая гидролизуется не по аниону — это 1) ВаСl 2 2) CuCl 2 3) CaCl 2 4) К 2 НРО 4
8-25-11 . При растворении в воде хлорида цинка среда становится
1) нейтральной 2) кислой 3) щелочной 4) слабощелочной
8-25-12 . При растворении в воде сульфида калия среда становится
1)нейтральной 2) кислой 3) щелочной
8-25-13 . При растворении в воде алюмокалиевых квасцов среда становится
1)нейтральной 2) кислой 3) щелочной
8- 25- 14. Щелочную среду имеет раствор
1) сульфата калия 2) силиката натрия 3) хлорида цинка 4) нитрата аммония
8- 25- 15. Кислая среда в растворе 1) КI 2) NaF 3) NaNO 2 4) CuSO 4
8- 25- 16. Нейтральную среду имеет водный раствор 1) K 2 SiO 3 2)CaCl 2 3) NH 4 NO 3 4)ZnSO 4
8- 25- 17. Нейтральная среда в растворе
1) сульфита калия 2) нитрата натрия 3) ацетата натрия 4) фторида калия
8- 25- 18. Кислую среду имеет водный раствор
1)нитрата меди (II) 2)нитрата бария 3)ацетата калия 4)карбоната натрия
8- 25- 19. Кислую среду имеет раствор
1) ацетата натрия 2) хлорида бария 3) фосфата калия 4) бромида меди (II)
8- 25- 20. Кислая среда в растворе 1) NаНСО 3 2) FеС1 3 3) Na 3 PO 4 4) KCl
8-25-21.Щелочную среду имеет водный раствор:
1) фторида калия 2) хлорида алюминия 3) бромида натрия 4) хлорида цинка
8- 25- 22. Кислую среду имеет водный раствор 1) Na 3 PO 4 2) KCl 3) Na 2 CO 3 4) ZnSO 4
8-2 5-23 .Среда раствора карбоната калия
1) щелочная 2) кислая 3) нейтральная 4) слабокислая
8-25-24.Одинаковую реакцию среды имеют растворы хлорида меди (II) и
1) хлорида натрия 2) ацетата кальция 3) хлорида калия 4) нитрата цинка
8- 25-25 . Лакмус становится красным в водном растворе
8- 25-26 . В растворе йодида цинка лакмус имеет окраску
1) красную 2) синюю 3) зелёную 4) фиолетовую
8- 25-27 . В растворе нитрата алюминия метилоранж имеет окраску
1) красную 2) жёлтую 3) оранжевую 4) бесцветную.
8-25-29. Лакмус станет синим в растворе
1) сульфида калия 2) сульфата натрия 3) хлорида цинка 4) нитрата магния
8- 25-3 0. Фенолфталеин приобретёт малиновую окраску в растворе
1) сульфата меди (II) 2) хлорида калия 3) карбоната натрия 4) нитрата бария
8- 25-31 . Гидролиз какой соли описывается уравнением S 2- + H 2 O ⇄ HS — + OH —
1) Сульфида алюминия 2) Сульфида аммония 3) Гидросульфида натрия 4) Сульфида натрия
8- 25-32 . В результате гидролиза хлорида аммония:
1) увеличивается концентрация ионов водорода в растворе;
2) уменьшается концентрация ионов водорода в растворе;
3) увеличивается концентрация гидроксид-ионов в растворе;
4) концентрация ионов водорода и гидроксид-ионов в растворе остается неизменной
8- 2 5 -33 . В результате гидролиза ацетата натрия:
1) увеличивается концентрация протонов в растворе;
2) увеличивается концентрация гидроксид-ионов в растворе;
3) концентрация гидроксид-ионов и протонов в растворе остается неизменной;
4) реакция не идет.
8- 25-34 . В четырёх пробирках находятся водные растворы перечисленных ниже солей. Раствор какой соли можно отличить от других с помощью лакмуса?
8- 25-35 . В четырех пробирках находятся водные растворы перечисленных ниже солей. Раствор какой соли можно отличить от других с помощью фенолфталеина?
8- 25-36 . Какие ионы присутствуют в водном растворе фосфата натрия?
1) Na + , PO 4 3– 2) Na + , PO 4 3– , OH – 3) Na + , PO 4 3– , OH – , H + 4) Na + , PO 4 3– , H 2 PO 4 – , HPO 4 2– ,OH –
8-2 5- 3 7 . Установите соответствие между формулой соли и средой ее водного раствора.
ФОРМУЛА СОЛИ СРЕДА РАСТВОРА
8-25 -38 . Установите соответствие между солью и ее способностью к гидролизу.
СОЛЬ СПОСОБНОСТЬ К ГИДРОЛИЗУ
1) SrCl 2 А) по катиону
2) NH 4 F Б) по аниону
3) CuSO 4 В) по катиону и аниону
4) СН 3 СООNa Г) гидролизу не подвергается
8-2 5-39 . Установите соответствие между составом соли и типом ее гидролиза в водном растворе
СОСТАВ СОЛИ ТИП ГИДРОЛИЗА
1) нитрат цинка А) по катиону
2) карбонат натрия Б) по аниону
3) хлорид кальция В) по катиону и аниону
Г) гидролизу не подвергается
8-2 5-40 . Установите соответствие между составом соли и типом ее гидролиза в водном растворе
СОСТАВ СОЛИ ТИП ГИДРОЛИЗА
1) СrСl 3 A) по катиону
2) А1Вr 3 Б) по аниону
3) NaCl В) по катиону и аниону
Г) гидролизу не подвергается
8-2 5-41 . Установите соответствие между составом соли и типом её гидролиза в водном растворе
СОСТАВ СОЛИ ТИП ГИДРОЛИЗА
1) КВr А) по катиону
2) СuСl 2 Б) по аниону
3) К 2 SO 3 В) по катиону и аниону
Г) гидролизу не подвергается
8-25-42.Установите соответствие между солью и концентрациями ионов водорода и ионов гидроксида в растворе этой соли.
СОЛЬ КОНЦЕНТРАЦИИ [H+] и [OH–]
8- 25-43 . Установите соответствие между составом соли и типом её гидролиза в водном растворе
СОСТАВ СОЛИ ТИП ГИДРОЛИЗА .
1) FеС1 2 А) по катиону
2) К NO 3 Б) по аниону
3) Аl 2 S 3 В) по катиону и аниону
Г) гидролизу не подвергается
8-2 5-44 . Установите соответствие между солью и окраской лакмуса в её водном растворе:
НАЗВАНИЕ СОЛИ ОКРАСКА ЛАКМУСА
1) LiCl А) фиолетовая
2) CH 3 COONa Б) синяя
4)K 2 S i O 3 Г) оранжевая
8- 25-45 . Установите соответствие между формулой соли и её способностью к гидролизу.
ФОРМУЛА СОЛИ СПОСОБНОСТЬ К ГИДРОЛИЗУ
1) NН 4 NO 3 А) по катиону
2) NаI Б) по аниону
3) СН 3 СООК В) по катиону и аниону
4) Аl 2 S 3 Г) гидролизу не подвергается
8-25-46.Установите соответствие между названием соли и типом гидролиза её в водном растворе:
НАЗВАНИЕ СОЛИ ТИП ГИДРОЛИЗА
1) сульфид хрома (III) А) по катиону
2)хлорид аммония Б) по аниону
3)карбонат калия B) по катиону и аниону
8- 2 5 -47 . Установите соответствие между названием соли и отношением её к гидролизу.
НАЗВАНИЕ СОЛИ ОТНОШЕНИЕ К ГИДРОЛИЗУ
А) пропионат аммония 1)не гидролизуется
Б) сульфид цезия 2)гидролизуется по катиону
В) сульфид алюминия 3)гидролизуется по аниону
Г) карбонат натрия 4)гидролизуется по катиону и аниону
8-25-48.Чтобы ослабить или прекратить гидролиз в растворе хлоридa алюминия необходимо:
А) Добавить гидроксид натрия
Б) Добавить серную кислоту
В) Добавить воду
Г) Охладить раствор
Д) Нагреть раствор
1) А,В,Д 2) Б, Г 3) Б,В,Г 4) Г
8-25-49.Гидролиз водных растворов каких солей ослабляется при добавлении минеральной кислоты:
1) А, В, Д 2) Б, Г, Е 3) А, Д 4) В,Д
Краткое описание документа:
Для того, чтобы понять, что такое гидролиз солей, вспомним для начала, как диссоциируют кислоты и щелочи.
Общим между всеми кислотами является то, что при их диссоциации обязательно образуются катионы водорода (Н+), при диссоциации же всех щелочей всегда образуются гидроксид-ионы (ОН−).
В связи с этим, если в растворе, по тем или иным причинам, больше ионов Н+ говорят, что раствор имеет кислую реакцию среды, если ОН− — щелочную реакцию среды.
Если с кислотами и щелочами все понятно, то какая же реакция среды будет в растворах солей?
На первый взгляд, она всегда должна быть нейтральной. И правда же, откуда, например, в растворе сульфида натрия взяться избытку катионов водорода или гидроксид-ионов.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 956 человек из 80 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 51 человек из 29 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 33 человека из 19 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 569 515 материалов в базе
Материал подходит для УМК
«Химия. Базовый уровень», Габриелян О.С.
«Химия (углублённый уровень)», Еремин В.В., Кузьменко Н.Е., Дроздов А.А. и др./ Под ред. Лунина В.В.
Другие материалы
- 14.04.2018
- 369
- 0
- 14.04.2018
- 492
- 0
- 11.04.2018
- 393
- 0
- 10.04.2018
- 295
- 0
- 10.04.2018
- 227
- 0
- 10.04.2018
- 215
- 0
- 10.04.2018
- 584
- 14
- 10.04.2018
- 238
- 0
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 14.04.2018 2414
- DOCX 56.5 кбайт
- 5 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Тележинская Елена Леонидовна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 5 лет
- Подписчики: 177
- Всего просмотров: 5074824
- Всего материалов: 4448
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Рособрнадзор не планирует переносить досрочный период ЕГЭ
Время чтения: 0 минут
В Забайкалье в 2022 году обеспечат интернетом 83 школы
Время чтения: 1 минута
В России могут объявить Десятилетие науки и технологий
Время чтения: 1 минута
Полный перевод школ на дистанционное обучение не планируется
Время чтения: 1 минута
ЕГЭ в 2022 году будут сдавать почти 737 тыс. человек
Время чтения: 2 минуты
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Гидролиз солей, образованных кислотой и основанием
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Гидролиз солей.
Гидролиз – химическое обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодисcоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых или катионов основных солей) и сопровождающееся изменением рН среды. Гидролизу не подвергаются соли, образованные сильными кислотами и основаниями, например КСl.
Гидролиз соли, образованной слабой кислотой и сильным основанием, например CH3COONa. Соль в растворе полностью диссоциирует на ионы:
Вода, как уже указывалось, является слабым электролитом:
Ионы водорода воды взаимодействуют с ацетат-ионами с образованием слабой уксусной кислоты
Таким образом, гидролиз в ионной форме можно представит уравнением
Как видно, в результате гидролиза появилось некоторое избыточное количество гидроксид-ионов, а реакция среды стала основной, следовательно, при гидролизе соли, образованной сильным основанием и слабой кислотой, происходит увеличение рН системы, т. е. среда становится основной (происходит подщелачивание раствора).
Показателем глубины протекания гидролиза является степень гидролиза β, представляющая собой отношение концентрации гидролизованных молекул сгидр к исходной концентрации растворенных молекул электролита:
Принимая для упрощения, что в разбавленных растворах активность ионов мало отличается от их концентрации сиона = аиона, запишем константу равновесия реакции гидролиза:
Так как концентрация воды при гидролизе изменяется очень мало, то принимаем ее постоянной и, умножая на константу равновесия, получим константу гидролиза Кr:
Как указывалось ранее, [OH – ][ Н + ] ≈ КВ, а отношение – [Н + ][А – ] / [НА]
является константой диссоциации КД слабой кислоты НА. Таким образом, константа гидролиза равна отношению ионного произведения воды и константы диссоциации слабого электролита:
Если выразить концентрацию ионов и молекул при установлении равновесия
через степень гидролиза β и исходную концентрацию иона с, то получаем, что
Подставив эти значения в уравнение
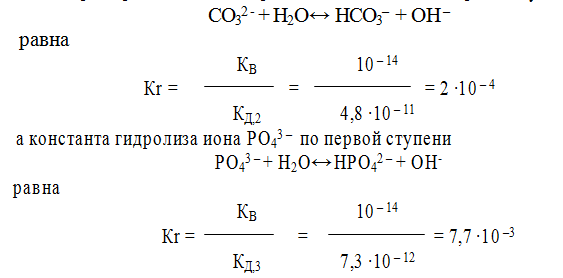
Если гидролизу подвергается многоосновной анион, то гидролиз протекает по стадиям:
Константа гидролиза по первой ступени значительно выше, чем константа гидролиза по последней ступени. Например, для гидролиза СО3 2 – , при 298 К
Поэтому, при расчете концентраций ионов [ОН – ] или [Н + ], второй и третьей ступенью гидролиза обычно пренебрегают. Анализ уравнений гидролиза показывает, что в уравнении Кr = КВ / КД для расчета константы гидролиза по первой ступени входит константа диссоциации слабого электролита по последней ступени. Например, константа гидролиза иона СО3 2- по первой ступени
Гидролиз солей, образованных сильной кислотой и слабым основанием, напримерNH4C1. В растворе соль NH4Cl диссоциирована
Гидролизу подвергается ион слабого основания NH4 +
Как видно, в результате гидролиза соли появляется некоторое избыточное количество ионов водорода, т. е. среда подкисляется. Таким образом, гидролиз соли, образованной сильной кислотой и слабым основанием, приводит к подкислению раствора.
Степень гидролиза и константа гидролиза в данном случае описываются теми же уравнениями, но лишь с включением константы диссоциации слабого основания.
Гидролиз соли, образованной слабым основанием и слабой кислотой, напримерNH4F
Как видно, в результате гидролиза образуются как ионы водорода, так и ионы гидроксида. Константа гидролиза зависит от константы диссоциации как слабого основания КД,О, так и слабой кислоты КД,К
Как видно, в зависимости от соотношения рКД,К и рКД,О среда может иметь как кислую, так и основную реакцию.
Гидролиз играет важную роль в природных и технологических процессах. Например, расщепление пищи в желудочно-кишечном тракте идет по реакции гидролиза ее компонентов. Энергия в организмах в основном переносится с помощью аденозинтрифосфата (АТФ), гидролиз которого характеризуется отрицательным значением энергии Гиббса (-30,5 кДж/моль).
Гидролиз используется в технике при получении ценных продуктов из древесины, жиров и других веществ.
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN; б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение, а) Цианид калия KCN — соль слабой одноосновной кислоты (см. табл. 9) HCN и сильного основания КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы K + и анионы CN. Катионы K + не могут связывать ионы ОН воды, так как КОН — сильный электролит. Анионы же CN связывают ионы H + воды, образуя молекулы слабого элекролита HCN. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
CN – + H2O ↔ HCN + OH –
или в молекулярной форме
KCN + H2O↔ HCN + KOH
В результате гидролиза в растворе появляется некоторый избыток ионов ОН, поэтому раствор KCN имеет щелочную реакцию( рН > 7).
Таблица 19. Константы и степени диссоциации некоторых слабых электролитов
| Электролиты | Формула | Численные значения констант диссоциации | Степень диссоциации в 0,1 н. растворе, % |
| Азотистая кислота | HNO2 | K= 4,0 · 10 -4 | 6,4 |
| Аммиак (гидроксид) | NH4OH | K= 1,8 · 10 -5 | 1,3 |
| Муравьиная кислота | HCOOH | K= 1,76 · 10 -4 | 4,2 |
| Ортоборная кислота | H3BO3 | K1= 5,8 · 10 -10 | 0,007 |
| K2= 1,8 · 10 -13 | |||
| K3= 1,6 · 10 -14 | |||
| Ортофосфорная кислота | H3PO4 | K1= 7,7 · 10 -3 | 27 |
| K2= 6,2 · 10 -8 | |||
| K3= 2,2 · 10 -13 | |||
| Сернистая кислота | H2SO3 | K1= 1,7 · 10 -2 | 20,0 |
| K2= 6,2 · 10 -8 | |||
| Сероводородная кислота | H2S | K1= 5,7 · 10 -8 | 0,07 |
| K2= 1,2 · 10 -15 | |||
| Синильная кислота | HCN | K= 7,2 · 10 -10 | 0,009 |
| Угольная кислота | H2CO3 | K1= 4,3 · 10 -7 | 0,17 |
| K2= 5,6 · 10 -11 | |||
| Уксусная кислота | CH3COOH | K= 1,75 · 10 -5 | 1,3 |
| Фтороводородная кислота | HF | K= 7,2 · 10 -4 | 8,5 |
| Хлорноватистая кислота | HClO | K= 3,0 · 10 -8 | 0,05 |
б) Карбонат натрия Na2CO3 — соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли CO3 2- , связывая водородные ионы воды, образуют анионы кислой соли НСО3, а не молекулы Н2СО3, так как ионы НСО3 диссоциируют гораздо труднее, чем молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
или в молекулярной форме
В растворе появляется избыток ионов ОН, поэтому раствор Na2CO3 имеет щелочную реакцию (рН > 7).
в) Сульфат цинка ZnSO4 — соль слабого многокислотного основания Zn(OH)2 и сильной кислоты H2SO4. В этом случае катионы Zn 2+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH + . Образования молекул Zn(OH)2 не происходит, так как ионы ZnOH + диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Zn 2+ + H2O ↔ ZnOH + + H +
или в молекулярной форме
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (рН 3+ + H2O ↔ AlOH 2+ + H +
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы H + и ОH образуют молекулу слабого электролита Н2O. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН)3 и СО2 (Н2СО3). Ионно-молекулярное уравнение:
http://infourok.ru/gidroliz-soley-sreda-vodnih-rastvorov-kislaya-neytralnaya-schelochnaya-2868711.html
http://farmf.ru/lekcii/gidroliz-solej-obrazovannyh-kislotoj-i-osnovaniem/