Соли хрома: химические свойства и получение
Соли хрома
Соли хрома (II)
Все соли хрома (II) – сильные восстановители. В растворах окисляются даже кислородом воздуха.
Например , хлорид хрома (II) окисляется кислородом в растворе в присутствии щелочи до соединений хрома (III):
Концентрированные кислоты-окислители (азотная и серная) также окисляют соединения хрома (II):
Соли хрома (III)
Хром с валентностью III образует два типа солей:
- Соли, в которых хром (III) является катионом. Например , хлорид хрома (III) CrCl3.
- Соли, в которых хром (III) входит в состав кислотного остатка – хромиты и гидроксокомплексы хрома (III) . Например , хромит калия, KCrO2. или гексагидроксохромат (III) калия K3[Cr(OH)6].
1. Соли хрома (III) проявляют слабые восстановительные свойства . окисляются под действием сильных окислителей в щелочной среде.
Например , бром в присутствии гидроксида калия окисляет хлорид хрома (III):
2CrCl3 + 3Br2 + 16KOH → 2K2CrO4 + 6KBr + 6KCl + 8H2O
или сульфат хрома (III):
Пероксид водорода в присутствии щелочи также окисляет соли хрома (III):
Даже перманганат калия в щелочной среде окисляет соли хрома (III):
Комплексные соли хрома (III) также окисляются сильными окислителями в присутствии щелочей.
Например , гексагидроксохроматы окисляются бромом в щелочи:
Оксид свинца (IV) также окисляет хромиты:
2. Соли хрома (III) в щелочной среде образуют гидроксид хрома (III), который сразу растворяется, образуя гидроксокомплекс.
2CrCl3 + 6KOH → 2Cr(OH)3 + 6KCl
3. Более активные металлы вытесняют хром (III) из солей.
Например , цинк реагирует с хлоридом хрома (III):
Гидролиз солей хрома (III)
Растворимые соли хрома (III) и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Cr 3+ + H2O = CrOH 2+ + H +
II ступень: CrOH 2+ + H2O = Cr(OH )2 + + H +
Однако сульфиды, сульфиты, карбонаты хрома (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой в момент образования.
Например , при сливании растворов солей хрома (III) и сульфита, гидросульфита, карбоната или сульфида натрия протекает взаимный гидролиз:
Более подробно про гидролиз можно прочитать в соответствующей статье.
Хромиты
Соли, в которых хром (III) входит в состав кислотного остатка (хромиты) — образуются из оксида хрома (III) при сплавлении с щелочами и основными оксидами:
Для понимания свойств хромитов их удобно мысленно разделить на два отдельных вещества.
Например , хромит натрия мы поделим мысленно на два вещества: оксид хрома (III) и оксид натрия.
NaСrO2 разделяем на Na2O и Cr2O3
При этом очевидно, что хромиты реагируют с кислотами. При недостатке кислоты образуется гидроксид хрома (III):
NaCrO2 + HCl (недостаток) + H2O → Cr(OH)3 + NaCl
В избытке кислоты гидроксид хрома (III) не образуется:
NaCrO2 + 4HCl (избыток) → CrCl3 + NaCl + 2H2O
NaCrO2 + 4HCl → CrCl3 + NaCl + 2H2O
Под действием избытка воды хромиты гидролизуются:
Соли хрома (VI)
Оксиду хрома ( VI ) соответствуют две кислоты – хромовая Н2 CrO 4 и дихромовая Н2 Cr 2 O 7. Поэтому хром в степени окисления +6 образует два типа солей: хроматы и дихроматы.
Например , хромат калия K2CrO4 и дихромат калия K2Cr2O7.
1. Различить эти соли довольно легко: хроматы желтые, а дихроматы оранжевые. Хроматы устойчивы в щелочной среде, а дихроматы устойчивы в кислой среде.
При добавлении к хроматам кислот они переходят в дихроматы.
Например , хромат калия взаимодействует с серной кислотой и разбавленной соляной кислотой с образованием дихромата калия:
И наоборот: дихроматы реагируют с щелочами с образованием хроматов.
Например , дихромат калия взаимодействует с гидроксидом калия с образованием хромата калия:
Видеоопыт взаимных переходов хроматов и дихроматов при добавлении кислоты или щелочи можно посмотреть здесь.
2. Хроматы и дихроматы проявляют сильные окислительные свойства. При взаимодействии с восстановителями они восстанавливаются до соединений хрома (III).
В нейтральной среде хроматы и дихроматы восстанавливаются до гидроксида хрома (III).
Например , дихромат калия реагирует с сульфитом натрия в нейтральной среде:
Хромат калия окисляет сульфид аммония:
При взаимодействии с восстановителями в щелочной среде хроматы и дихроматы образуют комплексные соли.
Например , хромат калия окисляет гидросульфид аммония в щелочной среде:
Хромат натрия окисляет сернистый газ:
Хромат натрия окисляет сульфид натрия:
При взаимодействии с восстановителями в кислой среде хроматы и дихроматы образуют соли хрома (III).
Например , дихромат калия окисляет сероводород в присутствии серной кислоты:
Дихромат калия окисляет йодид калия, фосфид кальция, соединения железа (II), сернистый газ, концентрированную соляную кислоту:
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Гидролиз солей хрома (III)Хром Положение в периодической системе химических элементов Хром расположен в 6 группе (или в побочной подгруппе VI группыв короткопериодной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева. Электронное строение атома хрома Электронная конфигурация хромав основном состоянии: +24Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 1s 3s Примечательно, что у атома хрома уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень. Физические свойства Хром– твердый металл голубовато-белого цвета. Очень чистый хром поддается механической обработке. В природе встречается в чистом виде и широко применяется в различных отраслях науки, техники и производства. Чаще всего хром применяется, как компонент сплавов, которые используются при изготовлении медицинского или химического технологического оборудования и приборов. Температура плавления 1890 о С, температура кипения 2680 о С, плотность хрома 7,19 г/см 3 . Нахождение в природе Хром – довольно распространенный металл в земной коре (0,012 масс.%). Основной минерал, содержащий хром – хромистый железняк FeO·Cr2O3 (или Fe(CrO2)2). Способы получения Хромполучают из хромита железа. Для восстановления используют кокс: Еще один способ получения хрома: восстановление из оксида алюминием (алюмотермия): 2Al + Cr2O3 → 2Cr + Al2O3 Качественные реакции Например, хлорид хрома (II)взаимодействует с гидроксидом натрия: Например, хлорид хрома (III)взаимодействует с гидроксидом калия: При дальнейшем добавлении щелочи амфотерный гидроксид хрома (III) растворяется с образованием комплексной соли: Обратите внимание, если мы поместим соль хрома (III) в избыток раствора щелочи, то осадок гидроксида хрома (III) не образуется, т.к. в избытке щелочи соединения хрома (III) сразу переходят в комплекс: Соли хрома можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей хрома (II) с водным раствором аммиака также образуется коричневый осадок гидроксида хрома (II). При взаимодействии растворимых солей хрома (III) с водным раствором аммиака также образуется коричневый осадок гидроксида хрома (III). Химические свойства В соединениях хром может проявлять степени окисления от +1 до +6. Наиболее характерными являются соединения хрома со степенями окисления +3 и +6. Менее устойчивы соединения хрома со степенью окисления +2. Хром образует комплексные соединения с координационным числом 6. 1. При комнатной температуре хром химически малоактивен из-за образования на его поверхности тонкой прочной оксидной пленки. При нагревании оксидная пленка хрома разрушается, и он реагирует практически со всеми неметаллами: кислородом, галогенами, серой, азотом, кремнием, углеродом, фосфором. 1.1. При взаимодействии хрома с галогенамиобразуются галогениды: 1.2. Хром реагирует с серой с образованием сульфида хрома: 1.3. Хром взаимодействует с фосфором. При этом образуется бинарное соединение – фосфид хрома: 1.4. С азотом хромреагирует при нагревании до 1000 о С с образованием нитрида: 1.5. Хром не взаимодействует с водородом. 1.6. Хром взаимодействует с кислородом с образованием оксида: 2. Хром взаимодействует и со сложными веществами: 2.1. Хром реагирует с парами воды в раскаленном состоянии: 2.2. В ряду напряжений хром находится левее водорода и поэтому в отсутствии воздуха может вытеснить водород из растворов минеральных кислот (соляной и разбавленной серной кислоты), образуя соли хрома (II). Например, хром бурно реагирует с соляной кислотой: В присутствии кислорода образуются соли хрома (III): 2.3. При обычных условиях хром не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV),сульфат хрома (III)и вода: 2Cr + 6H2SO4 → Cr2(SO4)3 + 3SO2 + 6H2O 2.4. Хром не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации. Только при сильном нагревании концентрированная азотная кислота растворяет хром: Cr + 6HNO3 → Cr(NO3)3 + 3NO2 + 3H2O 2.5. Растворы щелочей на хром практически не действуют. 2.6. Однако хром способен вытеснять многие металлы, например медь, олово, серебро и др. из растворов их солей. Например, хром реагирует с хлоридом меди с образованием хлорида хрома (III) и меди: 2Cr + 3CuCl2→ 2CrCl3+ 3Cu Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами, хлоратами в щелочной среде. Например, при сплавлении хрома с хлоратом калия в щелочи хром окисляется до хромата калия: Хлорат калия и нитрат калия также окисляют хром: Оксид хрома (III) Способы получения Оксид хрома (III)можно получить различными методами: 1. Термическим разложением гидроксида хрома (III): 2. Разложением дихромата аммония: 3.Восстановлением дихромата калия углеродом (коксом) или серой: Химические свойства Оксид хрома (III) – типичный амфотерный оксид. При этом оксид химически довольно инертен. В высокодисперсном состоянии с трудом взаимодействует с кислотами и щелочами. 1. При сплавлении оксида хрома (III) с основными оксидами активных металлов образуются соли-хромиты. Например, оксид хрома (III) взаимодействует с оксидом натрия: 2. Оксид хрома (III) взаимодействует с растворимыми основаниями (щелочами).При этом в расплаве образуются соли—хромиты,а в растворе реакция практически не идет. При этом оксид хрома (III) проявляет кислотные свойства. Например, оксид хрома (III) взаимодействует с гидроксидом натрия в расплаве с образованием хромита натрия и воды: 3. Оксид хрома (III) не взаимодействует с водой. 4. Оксид хрома (III) проявляет слабые восстановительные свойства. В щелочных расплавах окислителей окисляется до соединений хрома (VI). Например, оксид хрома (III) взаимодействует с нитратом калияв щелочной среде: Оксид хрома (III) окисляется бромом в присутствии гидроксида натрия: Озоном или кислородом: Нитраты и хлораты в расплаве щелочи также окисляют оксид хрома (III): Сr2O3 + 3NaNO3 + 2Na2CO3 → 2Na2CrO4 + 2CO2 + 3NaNO2 5. Оксид хрома (III) в высокодисперсном состоянии при сильном нагревании взаимодействует с сильными кислотами. Например, оксид хрома (III) реагирует с серной кислотой: 6. Оксид хрома (III) проявляет слабые окислительные свойствапри взаимодействии с более активными металлами. Например, оксид хрома (III) реагирует с алюминием (термит): Реакция очень экзотермическая, сопровождается выделением большого количества света: Если сжечь большой объем термита в тигле, то можно получить металлический хром: 7. Оксид хрома (III) – твердый, нелетучий. А следовательно, онвытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении. Например, из карбоната калия: Оксид хрома (II) Химические свойства Оксид хрома (II) имеет основный характер, ему соответствует гидроксид хрома (II), обладающий основными свойствами. 1. При обычной температуре устойчив на воздухе, выше 100°С окисляется кислородом. Все соединения хрома (II) – сильные восстановители. 4CrO + O2→ 2Cr2O3 2. При высоких температурах оксид хрома (II) диспропорционирует: 3. Оксид хрома (II) не взаимодействует с водой. 4. Оксид хрома (II) проявляет основные свойства. Взаимодействует с сильными кислотами и кислотными оксидами. Например, оксид хрома (II) взаимодействует с соляной кислотой: Оксид хрома (VI) Оксид хрома (VI) CrO3 – темно-красное кристаллическое вещество. Гигроскопичен, расплывается на воздухе, малоустойчив, разлагается при нормальных условиях. Способы получения Оксид хром (VI)можно получить действием концентрированной серной кислоты на сухие хроматы или дихроматы: Химические свойства Оксид хрома (VI) – кислотный. Сильно ядовит. Оксиду хрома (VI) соответствуют хромовая (H2CrO4) и дихромовая (H2Cr2O7) кислоты. 2. Оксид хрома (VI) проявляет кислотные свойства. Взаимодействует с основаниямии основными оксидами. Например, оксид хрома (VI) взаимодействует с гидроксидом калия с образованием хромата калия: CrO3+ 2KOH → K2CrO4+ H2O Или с оксидом лития с образованием хромата лития: 3. Оксид хрома (VI) – очень сильный окислитель: окисляет углерод, серу, иод, фосфор, превращаясь при этом в оксид хрома (III). Например, сера окисляется до оксида серы (IV): И некоторые органические веществ, например, этанол: Гидроксид хрома (III) Гидроксид хрома (III) Cr(OH)3 – это твердое вещество серо-зеленого цвета. Способы получения 1. Гидроксид хрома (III) можно получить действием раствора аммиакана соли хрома (III). Например, хлорид хрома (III) реагирует с водным раствором аммиака с образованием гидроксида хрома (III)и хлорида аммония: 2. Пропусканием углекислого газа, сернистого газа или сероводородачерез раствор гексагидроксохромата калия: Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество K3[Cr(OH)6] на составные части: KOH и Cr(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Cr(OH)3не реагирует с СО2, то мы записываем справа Cr(OH)3 без изменения. Гидроксид калия реагирует с избытком углекислого газа с образованием гидрокарбоната калия 3. Гидроксид хрома (III) можно получить действием недостатка щелочи на избыток соли хрома (III). Например, хлорид хрома (III)реагирует снедостатком гидроксида калияс образованием гидроксида хрома (III)ихлорида калия: 4. Также гидроксид хрома (III) образуется при взаимодействии растворимых солей хрома (III)с растворимыми карбонатами, сульфитами и сульфидами. Сульфиды, карбонаты и сульфиты хрома (III) необратимо гидролизуются в водном растворе. Например: бромид хрома (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида хрома (III), выделяется углекислый газ и образуется бромид натрия: Хлорид хрома (III)реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия: Химические свойства 1. Гидроксид хрома (III) реагирует с растворимыми кислотами. При этом образуются средние соли. Например, гидроксид хрома (III) взаимодействует с соляной кислотой с образованием нитрата хрома (III): 2. Гидроксид хрома (III) взаимодействует с кислотными оксидами сильных кислот. Например, гидроксид хрома (III) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (III): 3.Гидроксид хрома (III) взаимодействует с растворимыми основаниями (щелочами).При этом враствореобразуются комплексные соли. При этом гидроксид хрома (III) проявляет кислотные свойства. Например, гидроксид хрома (III) взаимодействует с избытком гидроксидом натрия с образованием гексагидроксохромата: 4.Гидроксид хрома (III) разлагаетсяпри нагревании: 5. Под действием окислителей в щелочной среде переходит в хромат. Например, при взаимодействии с бромом в щелочной среде гидроксид хрома (III) окисляется до хромата: Гидроксид хрома (II) Способы получения 1. Гидроксид хрома (II) можно получить действием раствора аммиакана соли хрома (II). Например, хлорид хрома (II) реагирует с водным раствором аммиака с образованием гидроксида хрома (II)и хлорида аммония: 2. Гидроксид хрома (II) можно получить действием щелочи на соли хрома (II). Например, хлорид хрома (II)реагирует сгидроксидом калияс образованием гидроксида хрома (II)ихлорида калия: Химические свойства 1. Гидроксид хрома (II) проявляет основные свойства. В частности, реагирует с растворимыми кислотами. Например, гидроксид хрома (II) взаимодействует с соляной кислотой с образованием хлорида хрома (II).Соли хрома (II) окрашивают раствор в синий цвет. Cr(OH)2 + 2HCl → CrCl2 + 2H2O 2. Гидроксид хрома (II) взаимодействует с кислотными оксидами сильных кислот. Например, гидроксид хрома (II) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (II): Cr(OH)2 + SO3 → CrSO4 + H2O 3. Гидроксид хрома (II) – сильный восстановитель. Например, под действием кислородавоздуха гидроксид хрома (II) окисляется до гидроксида хрома (III): 4Cr(OН)2 + O2 + 2Н2О → 4Cr(OН)3 Соли хрома Соли хрома (II) Все соли хрома (II) –сильные восстановители. В растворах окисляются даже кислородом воздуха. Например, хлорид хрома (II) окисляется кислородом в растворе в присутствии щелочи до соединений хрома (III): Концентрированные кислоты-окислители (азотная и серная)также окисляют соединения хрома (II): Соли хрома (III) Хром с валентностью III образует два типа солей: · Соли, в которых хром (III) является катионом. Например, хлорид хрома (III) CrCl3. · Соли, в которых хром (III) входит в состав кислотного остатка – хромиты и гидроксокомплексы хрома (III). Например, хромит калия,KCrO2. или гексагидроксохромат (III) калия K3[Cr(OH)6]. 1. Соли хрома (III) проявляют слабые восстановительные свойства, окисляются под действием сильных окислителей в щелочной среде. Например, бром в присутствии гидроксида калия окисляет хлорид хрома (III): 2CrCl3 + 3Br2+ 16KOH → 2K2CrO4 + 6KBr + 6KCl + 8H2O или сульфат хрома (III): Пероксид водорода в присутствии щелочи также окисляет соли хрома (III): Даже перманганат калия в щелочной среде окисляет соли хрома (III): Комплексные соли хрома (III) также окисляются сильными окислителями в присутствии щелочей. Например, гексагидроксохроматы окисляются бромом в щелочи: Оксид свинца (IV) также окисляет хромиты: 2. Соли хрома (III) в щелочной среде образуют гидроксид хрома (III), который сразу растворяется, образуя гидроксокомплекс. 3. Более активные металлы вытесняют хром (III) из солей. Например, цинк реагирует с хлоридом хрома (III): Гидролиз солей хрома (III) Растворимые соли хрома (III) и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть: I ступень: Cr 3+ + H2O = CrOH 2+ + H + II ступень: CrOH 2+ + H2O = Cr(OH)2 + + H + Однако сульфиды, сульфиты, карбонаты хрома (III)и их кислые солигидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водойв момент образования. Например, при сливании растворов солей хрома (III) и сульфита, гидросульфита, карбоната или сульфида натрия протекает взаимный гидролиз: Хромиты Соли, в которых хром (III) входит в состав кислотного остатка (хромиты) — образуются из оксида хрома (III)при сплавлении с щелочами и основными оксидами: Cr2O3+ Na2O → 2NaCrO2 Для понимания свойств хромитов их удобно мысленно разделить на два отдельных вещества. Например, хромит натрия мы поделим мысленно на два вещества: оксид хрома (III) и оксид натрия. При этом очевидно, что хромиты реагируют с кислотами. При недостатке кислоты образуется гидроксид хрома (III): В избытке кислоты гидроксид хрома (III) не образуется: Под действием избытка воды хромиты гидролизуются: Соли хрома (VI) Оксиду хрома (VI) соответствуют две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7. Поэтому хром в степени окисления +6 образует два типа солей: хроматы и дихроматы. 1. Различить эти соли довольно легко: хроматы желтые, а дихроматы оранжевые. Хроматы устойчивы в щелочной среде, а дихроматы устойчивы в кислой среде. При добавлении к хроматам кислот они переходят в дихроматы. Например, хромат калия взаимодействует с серной кислотой и разбавленной соляной кислотой с образованием дихромата калия: И наоборот: дихроматы реагируют с щелочами с образованием хроматов. Например, дихромат калия взаимодействует с гидроксидом калия с образованием хромата калия: K2Cr2O7 + 2KOH → 2K2CrO4+ H2O 2. Хроматы и дихроматы проявляют сильные окислительные свойства. При взаимодействии с восстановителями они восстанавливаются до соединений хрома (III). В нейтральной среде хроматы и дихроматы восстанавливаются до гидроксида хрома (III). Например, дихромат калия реагирует с сульфитом натрия в нейтральной среде: Хромат калия окисляет сульфид аммония: При взаимодействии с восстановителями в щелочной среде хроматы и дихроматы образуют комплексные соли. Например, хромат калия окисляет гидросульфид аммония в щелочной среде: 2K2CrO4 + 3NH4HS + 2H2O + 2KOH → 3S + 2K3[Cr(OH)6] + 3NH3 Хромат натрия окисляет сернистый газ: Хромат натрия окисляет сульфид натрия: При взаимодействии с восстановителями в кислой среде хроматы и дихроматы образуют соли хрома (III). Дихромат калия окисляет йодид калия, фосфид кальция, соединения железа (II), сернистый газ, концентрированную соляную кислоту: источники: http://acetyl.ru/o/ncr12c1o33.php http://poisk-ru.ru/s3140t23.html |

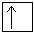
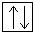 2s
2s 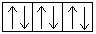
 3d
3d 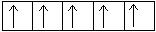

 Качественная реакция на ионы хрома +2 – взаимодействие избытка солей хрома (II) с щелочами. При этом образуется коричневый аморфный осадок гидроксида хрома (II).
Качественная реакция на ионы хрома +2 – взаимодействие избытка солей хрома (II) с щелочами. При этом образуется коричневый аморфный осадок гидроксида хрома (II). Качественная реакция на ионы хрома +3 – взаимодействие избытка солей хрома (III) с щелочами. При этом образуется серо-зеленый аморфный осадок гидроксида хрома (III).
Качественная реакция на ионы хрома +3 – взаимодействие избытка солей хрома (III) с щелочами. При этом образуется серо-зеленый аморфный осадок гидроксида хрома (III).

