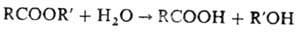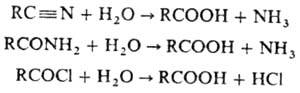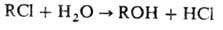Номенклатура жиров
Общее название жиров – триацилглицерины (триглицериды).
Существует несколько способов назвать молекулу жира.
Например, жир, образованный тремя остатками стеариновой кислоты, будет иметь следующие названия:
Физические свойства жиров
Жиры растворимы в органических растворителях и нерастворимы в воде. С водой жиры не смешиваются.
| Животные жиры — предельные | Растительные жиры (масла) — непредельные |
| Твёрдые, образованы предельными кислотами – стеариновой и пальмитиновой. Все животные жиры, кроме рыбьего – твёрдые. | Жидкие, образованы непредельными кислотами – олеиновой, линолевой и другими. Все растительные жиры, кроме пальмового масла – жидкие. |
Химические свойства жиров
1. Гидролиз (омыление) жиров
Жиры подвергаются гидролизу в кислой или щелочной среде или под действием ферментов.
1.1. Кислотный гидролиз
Под действием кислот жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
| Например, при гидролизе тристеарата глицерина в кислой среде образуется стеариновая кислота и глицерин |
1.2. Щелочной гидролиз — омыление жиров
При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
| Например, при гидролизе тристеарата глицерина гидроксидом натрия образуется стеарат натрия . |
2. Гидрирование (гидрогенизация) ненасыщенных жиров
Гидрогенизация жиров — это процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира.
При этом остатки непредельных кислот переходят в остатки предельных, жидкие растительные жиры превращаются в твёрдые (маргарин).
| Например, триолеат глицерина при гидрировании превращается в тристеарат глицерина: |
| Количественной характеристикой степени ненасыщенности жиров служит йодное число, показывающее, какая масса йода может присоединиться по двойным связям к 100 г жира. |
3. Мыло и синтетические моющие средства
При щелочном гидролизе жиров образуются мыла – соли высших жирных кислот.
Стеарат натрия – твёрдое мыло.
Стеарат калия – жидкое мыло.
Моющая способность мыла зависит от жесткости воды. Оно хорошо мылится и стирает в мягкой воде, плохо стирает в жёсткой воде и совсем не стирает в морской воде, так как содержащие в ней ионы Ca 2+ и Mg 2+ дают с высшими кислотами нерастворимые в воде соли.
| Например, тристеарат глицерина взаимодействует с сульфатом кальция |
Поэтому наряду с мылом используют синтетические моющие средства.
Их производят из других веществ, например из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты.
Спирт реагирует с серной кислотой с образованием алкилсульфата .
Далее алкилсульфат гидролизуется щелочью:
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли этих веществ растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Липиды. Классификация. Гидролиз жиров. Аналитическая характеристика жира. Реакция омыления.Липиды
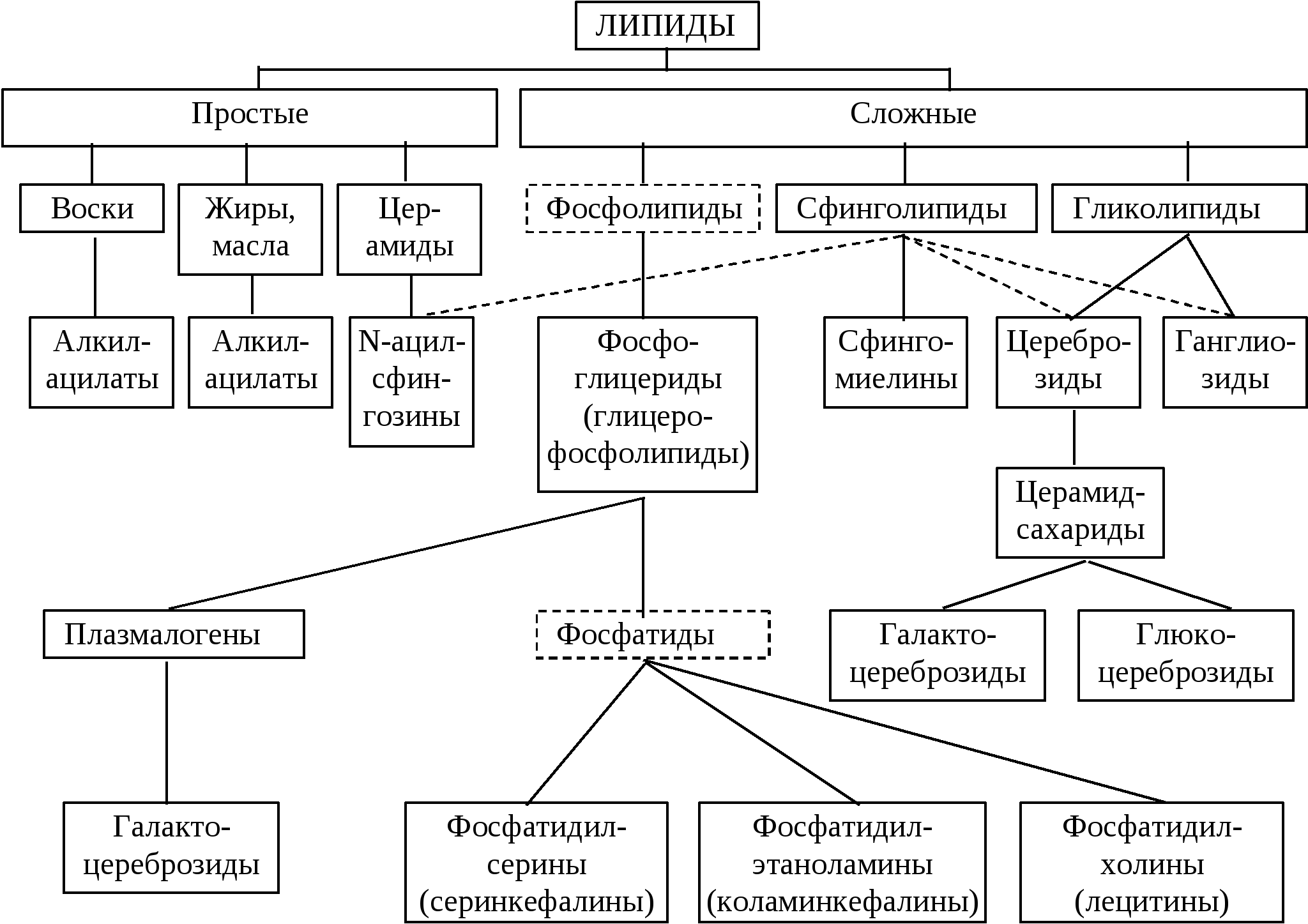
А. Классификация липидов
Липиды — большая группа веществ биологического происхождения, хорошо растворимых в органических растворителях, таких, как метанол, ацетон, хлороформ и бензол. В то же время эти вещества нерастворимы или мало растворимы в воде. Слабая растворимость связана с недостаточным содержанием в молекулах липидов атомов с поляризующейся электронной оболочкой, таких, как О, N, S или P (см. с. 14)
Липиды подразделяются на омыляемые и неомыляемые. Из огромного множества липидов здесь приведены лишь некоторые представители. Отдельные классы липидов обсуждаются в последующих разделах.
Омыляемые липиды. Структурные компоненты омыляемых липидов связаны сложноэфирной связью. Эти липиды легко гидролизуются в воде под действием щелочей или ферментов. Омыляемые липиды включают три группы веществ: сложные эфиры,фосфолипиды и гликолипиды. В группу сложных эфиров входят нейтральные жиры (глицерин+три жирные кислоты), воски (жирный спирт+жирная кислота) и эфиры стеринов (стерин+жирная кислота). Группа фосфолипидов включает фосфатидовые кислоты (глицерин+две жирные кислоты+фосфатная группа), фосфатиды (глицерин+две жирные кислоты+фосфатная группа+спирт) исфинголипиды (сфингозин+жирная кислота+фосфатная группа+спирт). К группе гликолипидов относятся цереброзиды (сфингозин+жирная кислота+один углеводный остаток) и ганглиозиды (сфингозин+жирная кислота+несколько углеводных остатков, в том числе нейраминовая кислота).
Группа неомыляемых липидоввключает предельные углеводороды и каротиноиды, а также спирты. В первую очередь это спирты с длинной алифатической цепью, циклические стерины (например, холестерин) и стероиды (эстрадиол, тестостерон и др.). Важнейшую группу липидов образуют жирные кислоты. К этой группе относятся также эйкозаноиды, которые можно рассматривать как производные жирных кислот
Гидролиз жиров[править | править вики-текст]
Гидролиз для жиров характерен, так как они являются сложными эфирами. Он осуществляется под действием минеральных кислот и щелочей при нагревании. Гидролиз жиров в живых организмах происходит под влиянием ферментов. Результат гидролиза — образование глицерина и соответствующих карбоновых кислот: С3H5(COO)3-R + 3H2O ↔ C3H5(OH)3 + 3RCOOH
Расщепление жиров на глицерин и соли высших карбоновых кислот проводится обработкой их щёлочью — (едким натром), перегретым паром, иногда — минеральными кислотами. Этот процесс называется омыление жиров (см. Мыло).
С3H5(COO)3-(C17H35)3 + 3NaOH → C3H5(OH)3 + 3C17H35COONa
тристеарин (жир) + едкий натр → глицерин + стеарат натрия (мыло)
Аналитическая характеристика жиров
Кроме температуры плавления и затвердевания, для характеристики жиров применяются следующие величины: кислотное число, число омыления, йодное число.
Природные жиры нейтральны. Однако при переработке или хранении вследствие процессов гидролиза или окисления образуются свободные кислоты, количество которых непостоянно. Кислотное число представляет собой число миллиграммов гидроксида калия, необходимое для нейтрализации свободных жирных кислот, содержащихся в 1 г жира.
Число омыления равно числу миллиграммов гидроксида калия, расходующихся при омылении 1 г жира кипячением последнего с избытком гидроксида калия в спиртовом растворе. Число омыления чистого триолеина равно 192. Высокое число омыления указывает на присутствие кислот с «меньшими молекулами». Малые числа омыления указывают на присутствие более высокомолекулярных кислот или же неомыляемых веществ. При взаимодействии с щелочами жиры гидролизуются с образованием солей высокомолекулярных кислот, называемых «мылами».
Йодное число выражается числом граммов йода, которое может присоединяться по двойным связям к 100 г жира. Для определения йодного числа применяют растворы хлорида йода ICl, бромида йода IBr, или йода в растворе сулемы, которые более реакционноспособны, чем сам йод. Йодное число является мерой ненасыщенности кислот жиров. Оно важно для оценки качества высыхающих масел.[1,2]
ОМЫЛЕНИЕ, гидролиз сложного эфира с образованием спирта и к-ты (или ее соли):
Происхождение термина «омыление» связано с методом произ-ва мыла из жиров. Омылением часто наз. гидролитич. превращения любых производных к-т, приводящие к к-там или их солям (омыление нитрилов, амидов,хлорангидридов и т.п.):
Поскольку галогензамещенные углеводороды можно рассматривать как эфиры галогеноводородных к-т, их гидролизтакже часто называют омылением:
Иногда термин «омыление» применяют к др. случаям гидролиза орг. соед., напр. омыление простых эфиров.
32. Высшие жирные кислоты. Мыла. Детергенты. Химические свойства Высшие жирные кислоты (ВЖК), натуральные (природные) и синтетические карбоновые кислоты алифатического ряда с числом атомов углерода в молекуле не менее 6.
Натуральные высшие жирные кислоты — преимущественно одноосновные кислоты нормального строения с четным числом атомов углерода в молекуле; могут быть насыщенными и ненасыщенными (с двойными связями, реже с тройными). Кроме карбоксильной группы, они могут содержать другие функциональные группы, например ОН. Содержатся в животных жирах и растительных маслах в виде сложных эфировглицерина (так называемых глицеридов), а также в природных восках в виде эфиров высших жирных спиртов. Наиболее распространены кислоты с 10-22 атомами углерода в молекуле (см. табл. 1).
Получают натуральные высшие жирные кислоты из жиров и масел. В промышленности используют преимущественно высокотемпературный (200-225 oС) гидролиз под давлением (
2,50 МПа), реже — кислотныйгидролиз в присутствии контакта Петрова. В лабораторных условиях высшие жирные кислоты синтезируют кислотным гидролизом в присутствии реактива Твитчеля (смесь олеиновой и серной кислот с бензолом), ферментативным (липазным) гидролизом, омылением растворами гидроксидов металлов I группы с последующим разложением образовавшихся солей (мыл) водными растворами H2SO4 или НСl.
мыла, соли высших жирных (С8-С18), нафтеновых и смоляных кислот; одни из основных моющих средств. Технические смеси водорастворимых (калиевых, натриевых, аммониевых и три-этаноламмониевых) солей этих кислот называют щелочными мылами, водонерастворимые соли, содержащие металлы II, III и других групп (например, Са, Mg, Ni, Mn, Al, Co, Pb и других) — металлическими.
Щелочные мыла получают главным образом из стеариновой, пальмитиновой, лауриновой, олеиновой, нафтеновых кислот, канифоли и таллового масла.
Индивидуальные соли высших жирных кислот — кристаллические вещества; плотность около 1,05 г/см 3 , т. пл. 225-260 °С. В зависимости от условий кристаллизации мыла существуют в моноклинной или ромбической форме; последняя характеризуется лучшей растворимостью в воде. При наличии в мыле ничтожных количеств воды температураплавления понижается до 100°С. Соли ненасыщенных жирных кислот лучше растворимых в воде и труднее кристаллизуются, чем соли насыщенных. Безводные мыла гигроскопичны; их гигроскопичность зависит от природы кислотного остатка и связанного с ним катиона. При повышенных температурах мыла и вода смешиваются во всех отношениях; при комнатной — водные растворы мыла образуют твердые гели, содержащие воду, макс. кол-во которой зависит от природы жирной кислоты и иона металла. При определенной концентрации мыла образуют мицеллярныерастворы и проявляют максимальное моющее действие. Важная характеристика мыла-концентрация, при которой происходит образование мицелл, называют критической концентрацией мицеллообразования (см. табл.). В области критической концентрации свойства растворов мыла (поверхностное натяжение, электрическая проводимость, осмотическое давление и др.) резко изменяются.
Детергенты (лат. detergens, detergentis очищающий) — поверхностно-активные вещества; в медицине используются в качестве моющих и дезинфицирующих средств, применяются также при изготовлении некоторых фармацевтических, в т.ч. ферментных, препаратов, в пищевой промышленности и др.
Поверхностно-активные вещества (ПАВ) при добавлении к так называемым дисперсным системам концентрируются на границе раздела фаз, вызывают снижение поверхностного (межфазного) натяжения и дают возможность этим прежде четко разделенным фазам «проникать» друг в друга, т.е. растворяться. В воде молекулы Д. при определенной концентрации, превышающей так называемую критическую концентрацию мицеллообразования (в среднем от 10 -2 до 10 -4 моль/л), объединяются в агрегаты (мицеллы). С липидами, белками, каротиноидами и другими нерастворимыми в воде веществами Д. образуют смешанные мицеллы, способствуя тем самым переходу этих веществ в раствор (на этом основано применение Д. в качестве моющих средств) и иногда — изменению их химических свойств.
Желчные кислоты и их соли обладают свойствами Д. и, попадая с желчью в тонкую кишку, взаимодействуют с липидами пищи, делают их водорастворимыми и тем самым доступными для расщепления липолитическими ферментами пищеварительного тракта и способными всасываться в кишечнике. Некоторые ПАВ (например, додецилсульфат натрия) вызывают диссоциацию белковых комплексов. Такие ПАВ способны инактивировать вирусы и бактериальные токсины.
Ряд ПАВ, обладающих сильным бактерицидным действием, применяют для дезинфекции белья в прачечных, стеклянной посуды в учреждениях общественного питания и больницах, мытья и обеззараживания медицинского инструментария. Различные моющие средства,являющиеся Д., получили широкое распространение. Такие ПАВ, как жировое мыло, стиральные порошки типа «Новость», сульфанол и др., используют для дезактивации. Многие Д.
являются хорошими пенообразователями и эмульгаторами, благодаря чему они применяются для приготовления лекарственных эмульсий и мазей (см. Лекарственные формы), косметических препаратов (кремов и т.п.), маргаринов, майонезов и др.
33 Оксикислоты. Яблочнвая, молочная,и лимонная кислоты. Химические свойства,Оксикислоты — производные кислот, которые получаются в результате замещения одного или нескольких атомов водорода в радикале кислоты одной или несколькими гидроксильными (спиртовыми) группами.
В простейших случаях оксикислоты содержат одну карбоксильную и одну гидроксогруппу, тогда их общая формула будет:
| СООН |
| ОН |
| R |
Более общая формула оксикислот:
| (СООН)n |
| (ОН)m |
| R |
Таким образом, оксикислоты имеют две различные функциональные группы: карбоксильную (кислотную) и гидроксильную (спиртовую) группы.
Соединения, содержащие различные функциональные группы, обычно называются соединениями со смешанными функциями.
В зависимости от наличия одного или нескольких карбоксилов оксикислоты делят на одноосновные (с одним карбоксилом), двухосновные (с двумя карбоксилами), трехосновные (с тремя карбоксилами) и т. д.
По числу спиртовых гидроксилов различают монооксикислоты (с одним гидроксилом), диоксикислоты (с двумя гидроксилами) и т. д.
В большинстве случаев оксикислоты обозначают эмпирическими наименованиями – по нахождению в том или ином продукте и т.д.
| НООС−СН2−СН−С |
| ОH |
| O |
| ОН |
| яблочная кислота |
| СН3−СН−С |
| ОH |
| O |
| ОН |
| молочная кислота |
Например, одноосновная кислота с тремя атомами углерода, найденная впервые в молоке, называется молочной кислотой; двухосновная оксикислота с четырьмя атомами углерода, впервые найденная в яблоках – яблочной кислотой, и т. д.
Наряду с этими названиями пользуются и другими, например, прибавляя слово окси- к названию той кислоты, от которой производится данная оксикислота путем замещения водорода на гидроксил. Так, молочной кислоте (с тремя атомами углерода) соответствует пропионовая СН3–СН2–СООН, и поэтому молочную кислоту называют также оксипропионовой кислотой, а яблочную – оксиянтарной кислотой. Место гидроксильной группы оксикислоты обозначают обычно греческой буквой, начиная обозначения атомов в углеродной цепи в порядке греческого алфавита от того атома углерода, который непосредственно связан с карбоксильной группой. Поэтому более точное название молочной кислоты – с обозначением места гидроксила – α-оксипропио-новая кислота (альфа-оксипропионовая кислота):
| СН3−СН−С |
| ОH |
| O |
| ОН |
| α |
| β |
| СН3−СН−С |
| ОH |
| O |
| ОН |
Согласно международной номенклатуре, названия оксикислот производят от названий соответствующих кислот, прибавляя приставку окси- и указывая положение углеродного атома, у которого стоит спиртовая группа. Например, молочная кислота по международной номенклатуре называется 2-оксипропановой.
Молочная кислота (соли лактаты) CH3CH(OH)COOH. Широко распространена в природе, является продуктом молочнокислого брожения углеводов. Содержит асимметрический атом углерода и существует в виде двух энантиомеров. В природе встречаются оба энантиомера молочной кислоты. При молочнокислом брожении образуется рацемическая D,L-молочная кислота. D-молочная (мясо-молочная) кислота образуется при восстановлении пировиногралной кислоты под действием кофермента НАД Н и накапливается в мышцах при интенсивной работе.
Химия липидов
Основу строения омыляемых липидов составляют спирты – высшие одноатомные, глицерол или двухатомный аминоспирт сфингозин. В случае 2-х последних один из гидроксилов может быть этерифицирован замещеным остатком фосфорной кислоты. Различают простые (двухкомпонентные) и сложные (многокомпонентные) липиды.
Классификация омыляемых липидов
К простым липидам принято относить жиры воска и масла. Воска – сложные эфиры высших одноатомных спиртов и высших карбоновых кислот. Они образуют защитную смазку на коже человека и животных и предохраняют растения от высыхания. Примерами служат цетиловый эфир пальмитиновой кислоты (содержится в спермацетовом масле) и мирицилпальмитат (содержится в пчелином воске).
Жиры и масла (нейтральные жиры, глицеролипиды, триацилглицерины) – глицериновые эфиры высших жирных кислот (ЖК). В организме человека триацилглицерины играют роль структурных компонентов клеток и запасного вещества. Их энергетическая ценность примерно в 2 раза превышает таковую белков и углеводов. Однако, повышенное содержание триацилглицеринов в крови наряду с холестерином является фактором атерогенности. Твердые триацилглицерины называют жирами, жидкие – маслами. Простые триацилглицерины содержат остатки одинаковых ЖК, а сложные – различных. В триацилглицеринах животного происхождения, как правило, преобладают остатки насыщенных ЖК (такие триацилглицерины, как правило, твердые), в то время как в растительных организмах как правило приобладают триацилглицерины, содержащие ненасыщенные ЖК (такие триацилглицерины, как правило, жидкие). Природные жиры и масла представляют собой смеси смешанных триацилглицеринов. Их количественной характеристикой служит процентное соотношение отдельных кислот, а также йодное число – мера ненасыщенности, указывающее количество граммов йода, способное присоединится к 100 г вещества.
Омыляемые сложные липиды делят на три большие группы – фосфолипиды, сфинголипиды и гликолипиды.
Фосфолипиды – липиды, при гидролизе которых в качестве одного из компонентов образуется фосфорная кислота. К ним относятся глицерофосфолипиды и некоторые сфинголипиды. Фосфолипиды характеризуются значительным содержанием ненасыщенных ЖК.
Глицерофосфолипиды – производные глицерол-3-фосфата, являются основным компонентом клеточных мебран. Природные глицерофосфолипиды имеют одинаковую конфигурацию и являются производными L-глицерол-3-фосфата, образующегося из дигидроксиацетонфосфата под действием фермента глицерофосфатдегидрогеназы.
Среди глицерофосфолипидов наиболее распространены L-фосфатиды:
Как правило, в природных фосфатидах в положении С1 находится остаток насыщенной ЖК, а в положении С2 – ненасыщенной. Оставшаяся свободной одна из ОН-групп фосфорной кислоты при физиологических рН (≈7,4) ионизирована. Примерами соединений этого класса являются фосфатидилинозитол, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилэтаноламин.
Несколько менее распространены липиды с простой эфирной связью – плазмалогены:
Сфинголипиды представляют собой структурные аналоги глицерофосфолипидов, где вместо глицерина используется сфингозин – ненасыщенный длинноцепочечный двухатомный аминоспирт. Примерами сфинголипидов служат церамиды – N-ацильные производные сфингозина, аминогруппа которых ацилирована ЖК:
Важную группу сфинголипидов составляют сфингомиелины, впервые обнаруженные в нервной ткани. В сфингомиелинах гидроксил С1 церамида ацилирован фосфорилхолиновой группой, поэтому их также можно отнести и к фосфолипидам:
Гликолипиды включают углеводные остатки, чаще всего D-галактозу, и не содержат остатков фосфорной кислоты и связанных с ней азотистых оснований. Типичные представители гликолипидов – цереброзиды и ганглиозиды. Оба этих соединения являются сфингозинсодержащими липидами, вследствие чего их можно отнести и к сфингозинам. В цереброзидах, содержащихся в миелиновых оболочнах нервных волокон остаток церамида связан с D-галактозой или D-глюкозой β-гликозидной связью:
Ганглиозиды – богатые углеводами сложные липиды, впервые выделенные из серого вещества головного мозга. В структурном отношении они сходны с цереброзидами, отличаясь тем, что вместо моносахарида они содержат олигосахаридный остаток сложной структуры.
Характерной особенностью сложных липидов является их бифильность, обусловленная присутствием в составе их молекул неполярных гидрофобных и высокополярных ионизированных гидрофильных группировок:
Находясь на поверхности раздела полярной и неполярной фаз такие липиды проявляют свойства эмульгаторов. В составе биомембран они также обусловливают высокое электрическое сопротивление и селективную проницаемость бислоя. Поэтому большая часть анестетиков хорошо растворимы в липидной фазе, что облегчает их проникновение через мембраны нервных клеток.
1.3 Некоторые свойства омыляемых липидов
а) Реакция гидролиза – гидролиз представляет собой первую стадию процесса утилизации жиров в организме. Кроме того, с помощью этой реакции можно устанавливать структуру липидов, а также получать мыла (Ca- и Mg-соли высших карбоновых кислот). Реакцию гидролиза осуществляют либо под воздействием перегретого пара (промышленный метод), либо при нагревании в присутствии водных растворов минеральных кислот и щелочей (омыление). Все эти реакции проходят по схеме бимолекулярного нуклеофильного замещения SN2. В организме гидролиз осуществляется под действием ферментов – липаз.
В плазмалогенах, как и в других виниловых эфирах простая эфирная связь расщепляется в присутствии кислоты, но не щелочи:
б) Реакция присоединения – Липиды содержащие остатки непредельных ЖК присоединяют по двойным связям водород, галогены, галогеноводороды и в кислой среде воду.
Йодное число этого триацилглицерола равно 30.
В промышленности широко применяется каталитическое гидрогенирование ненасыщенных растительных масел в результате чего последние превращаются в твердые жиры. Процесс протекает при 160 — 200°С и давлении 2 -15 атм.
Искусственное масло (маргарин) представляет собой эмульсию гидрогенизованного растительного масла в молоке.
в) Реакция окисления – Процессы окисления липидов весьма разнообразны. В частности, окисление кислородом воздуха ненасыщенных триацилглицеролов при хранении (автоокисление), сопровождаемое гидролизом, является частью процесса, так называемого, прогоркания масла. Первичными продуктами реакции липидов с молекулярным кислородом являются гидроперекиси, образующиеся в результате инициации цепного свободнорадикального окислительного процесса:
Указанная реакция является начальной стадией процесса так называемого свободнорадикального свободнорадикального перекисного окисления липидов (ПОЛ), впервые исследованный в мембранах гепатоцитов в работах и во II Московском медицинском институте им. . В последствии стало известно, что ПОЛ представляет собой один из наиболее важных процессов в живых организмах. Именно он является основной причиной повреждения клеточных мембран при различных патологиях и экстремальных состояниях, например при лучевой болезни, гипербарической оксигенации и канцергенезе. На первой стадии развития окислительного процесса в организме происходит инициация цепной реакции свободными радикалами типа НО· или НО2·, образующимися при окислении Fe2+ кислородом в водной среде (Реакция Фентона).
При атаке таким радикалом по метиленовой группе липида, соседней с двойной связью, образуется аллильный радикал, стабилизированный π-электронами двойной связи. Образовавшийся радикал может давать начало промежуточным пероксидам, которые будучи весьма нестабильными, легко распадаются с образованием продуктов альдегидной и кетонной природы, которые далее окисляются с образованием одно — и двухосновных карбоновых кислот – конечных продуктов реакции.
Окисление ненасыщенных ЖК пероксикислотами приводит к образованию эпоксидов:
Ненасыщенные липиды в мягких условиях могут подвергаться окислению раствором перманганата калия с образованием гликолей, а в более жестких условиях — кислот:
В организме человека и животных липиды выполняют также функцию энергетического резерва, включаясь в энергетический обмен в условиях голодания или при недостатке углеводов в пище. Энергетическая ценность липидов в несколько раз превышает таковую углеводов. Высвобождение энергии, заключенной в химических связях липидов с последующим ее трансформированием в энергию макроэргических фосфатных связей молекулы АТФ осуществляется в процессе, получившем название β-окисления ЖК, приводящему к образованию амфиболического интермедиата – ацетил-СоА:
2. Неомыляемые липиды
Неомыляемые липиды не гидролизуются в кислой и щелочной среде. Обычно их подразделяют на 2 больших подкласса: стероиды и терпены. Стероиды присутствуют, главным образом в животных тканях, тогда как терпены присутствуют в основном в тканях растений. Стероиды и терпены построены из одинаковых изопреновых фрагментов и относятся к категории изопреноидов.
К терпенам относят группу соединений, включающую себя как полиизопреновые углеводороды, так и их кислородсодержащие производные – спирты, альдегиды и кетоны. Сами углеводороды называют терпеновыми, а их производные – терпеноидами. Изопреновые единицы в терпенах соединены по принципу «голова к хвосту»:
Общая формула терпеновых углеводородов соответствует выражению – (С5Н8)n. Они могут иметь как циклическое, так и ациклическое строение. Терпены состоящие из 2-х изопреновых единиц называют монотерпенами, 3-х — сесквитерпенами, 4-х – дитерпенами. Примером ациклических терпенов могут служить мирцен, а также родственные ему спирт и альдегид – гераниол и цитраль, выполняющие функции феромонов у рабочих пчел.
Другим примером может служить сквален – интермедиат биосинтеза холестерола.
Среди терпенов, однако, наиболее распространены моно — и бициклические представители. Многие из них либо непосредственно находят применение в медицине, либо служат сырьем для синтеза многих лекарственных средств. По своему строению такие терпены сходны с некоторыми циклическими предельными углеводородами:
Типичными представителями моноциклических терпенов является (±)-лимонен (дипентен), содержащийся в лимонном масле, скипидаре и масле тмина и имеющий скелет ментана, а также ментол, содержащийся в эфирном масле перечной мяты и обладающий антисептическим, болеутоляющим и успокаивающим действием.
Лимонен получают из изопрена в результате реакции диенового синтеза при его нагревании:
При полной гидратации дипентена в кислой среде согласно правилу Марковникова образуется двухатомный спирт терпин, препарат которого в виде гидрата используется в качестве отхаркивающего средства при хроническом бронхите.
Замещенные дипентены, например каннабидиол представляют собой психоактивные вещества и являются действующим началом гашиша (марихуаны):
Ментол входит в состав валидола, а также мазей, применяемых при насморке:
Примерами бициклических терпенов являются α-пинен и камфора.
Камфора издавна применяется в медицине как стимулятор сердечной деятельности. Она способна вступать во взаимодействие с бромом по α-положению относительно карбонильного атома углерода. При этом образуется бромкамфора, которая улучшает деятельность сердца и оказывает успокаивающее действие на ЦНС.
Особую группу терпенов составляют каротиноиды – растительные пигменты. Некоторые из них способны выполнять функции витаминов. Каротиноиды также участвуют в процессе фотосинтеза. Большинство каротиноидов относится к тетратерпенам. Их молекулы содержат значительное количество двойных связей, что придает каротиноидам специфическую окраску. Типичными их представителями являются α-, β- и γ-каротины, предшественники витаминов группы А.
К терпенам относятся и другие жирорастворимые витамины, такие как витамины группы Е (токоферолы), витамины группы К, а также убихиноны, способные к последовательному окислению (восстановлению) и выполняющие роль челночного переносчика восстановительных эквивалентов в элетронтранспортной цепи митохондрий:
К веществам терпеноидной природы относятся также эйкозаноиды (см. лекцию «Жирные кислоты»).
Стероиды широко распространены в природе и выполняют в организме человека самые разнообразные функции. Стероидная природа характерна для желчных кислот, мужских и женских половых гормонов, гормонов коры надпочечников. Холестерин входит в состав клеточных мембран и определяет такое их важное свойство как микровязкость. В настоящее время известно более 20 000 стероидов.
Стероиды имеют циклическое строение. В основе их структуры лежит структура циклопентанопергидрофенантрена (стерана), состоящего из трех конденсированных циклогексановых колец (А, В, С) и циклопентанового кольца D.
Характерной особенностью биогенных стероидов является наличие кислородсодержащего заместителя при С3, «ангулярных» С18- и С19-метильных групп, а также алифатического заместителя R при С17. Величина этого радикала является одним из критериев классификации стероидов.
Незамещенный стеран содержит 6 ассиметрических атомов углерода и, поэтому, может обладать 26=64 стереоизоерами. С введением заместителей к любым неузловым атомам число стереизомеров еще более увеличивается. Сочленение колец A-B, B-C, C-D может быть как цис-, так и транс-. Однако, в природных стероидах кольца В-С всегда, а кольца C-D почти всегода сочленены в транс-конфигурации, в то время как кольца А-В могут иметь как цис-, так и транс-сочленение. Все циклогексановые кольца находятся в форме кресла.
Положение атомов водорода или заместителей снизу или сверху условной плоскости обозначается соответственно α и β. Стереохимия сочленений колец А-В указывается по ориентации атома водорода в 5-м положении (см. рисунок выше).
Циклический скелет стероидов достаточно жесткий и для него нехарактерны конформационные переходы, меняющие пространственное расположение заместителей.
При обычном написании формул стероидов циклический скелет принято изображать плоским. Заместители и атомы водорода будут при таком изображении располагаться либо над плоскостью рисунка (β-конфигурация), либо под ней (α-конфигурация).
Типичными представителями стероидов являются холестерол (стерины), холевая кислота (желчные кислоты), эстрадиол и тестостерон (половые гормоны), кортикостерон (гормон коры надпочечников глюкокортикоидного ряда).
Холестерол – наиболее распространенный представитель стеринов. Особенностью его структуры является наличие двойной связи между С5 и С6 атомами углерода.
При ее восстановлении образуется копростанол и холестанол. являющиеся стереоизомерами друг друга.
Очищенный холестерин – белое кристаллическое оптически активное вещество. В оргнизме встречается как в свободном состоянии, так и в виде сложного эфира. Из общего количества холистерина только 20% его поступает с пищей. Основная его часть синтезируется в организме de novo.
Ниже приводятся формулы некоторых наиболее важных желчных кислот и стероидных гормонов:
http://lektsii.org/2-92306.html
http://pandia.ru/text/80/122/22646.php